


- 高中化学苏教版(2021) 选择性必修2 专题3 第四单元 第2课时 分子晶体 混合型晶体-同步学案 试卷 1 次下载
- 高中化学苏教版(2021) 选择性必修2 专题4 专题知识体系构建与核心素养提升-同步学案 试卷 1 次下载
- 高中化学苏教版(2021) 选择性必修2 专题4 第一单元 第1课时 杂化轨道理论与分子空间结构-同步学案 试卷 1 次下载
- 高中化学苏教版(2021) 选择性必修2 专题4 第一单元 第2课时 价层电子对互斥模型 等电子原理-同步学案 试卷 1 次下载
- 高中化学苏教版(2021) 选择性必修2 专题4 第一单元 第3课时 分子的极性 手性分子-同步学案 试卷 1 次下载
高中化学苏教版(2021) 选择性必修2 专题4 第一单元 微专题5 分子(或离子)空间结构与杂化轨道理论-同步学案
展开微专题5 分子(或离子)空间结构与杂化轨道理论
一、分子(或离子)空间结构的判断
判断分子(或离子)的空间结构时,要能够正确计算价电子对数:一是运用计算式推导出价电子对数;二是看配位原子数。如下表:
价电子对数 | 杂化类型 | 配位原子数 | 孤电子对数 | 价层电子对互斥模型 | 分子空间结构 | 实例 |
2 | sp | 2 | 0 | 直线形 | 直线形 | BeCl2 |
3 | sp2 | 3 | 0 | 平面三角形 | 平面三角形 | BF3 |
2 | 1 | V形 | SnBr2 | |||
4 | sp3 | 4 | 0 | 四面体型 | 正四面体型 | CH4 |
3 | 1 | 三角锥型 | NH3 | |||
2 | 2 | V形 | H2O |
![]()
1.下列分子或离子中,价层电子对互斥模型与粒子的空间结构一致的是( )
A.SO2 B.HCHO
C.NCl3 D.H3O+
答案 B
解析 当中心原子没有孤电子对时,价层电子对互斥模型与分子的空间结构就是一致的,SO2、NCl3、H3O+的中心原子均有孤电子对,A、C、D项错误。
2.下列说法正确的是( )
A.CH2Cl2分子的空间结构为正四面体型
B.H2O分子中氧原子的杂化轨道类型为sp2,分子的空间结构为V形
C.CO2分子中碳原子的杂化轨道类型为sp,分子的空间结构为直线形
D.SO的空间结构为平面三角形
答案 C
解析 CH4中4个共价键完全相同,为正四面体型,CH2Cl2分子的4个共价键不完全相同,所以分子的空间结构不是正四面体型,A错误;H2O分子中O原子的价电子对数为=4,为sp3杂化,含有2个孤电子对,分子的空间结构为V形,B错误;CO2中C原子的价电子对数为=2,为sp杂化,分子的空间结构为直线形,C正确;SO中S原子的价电子对数为=4,为sp3杂化,含1个孤电子对,分子的空间结构为三角锥型,D错误。
3.(2020·青岛检测)下列分子中,中心原子杂化类型相同,分子的空间结构也相同的是( )
A.BeCl2、CO2 B.H2O、SO2
C.SO2、CH4 D.NF3、CH2O
答案 A
解析 根据价层电子对互斥模型可知,H2O中O原子的孤电子对数为=2,成键电子对数为2,采取sp3杂化,故H2O为V形结构,SO2中S原子的孤电子对数为=1,成键电子对数为2,采取sp2杂化,故SO2为V形结构,B项不符合题意;同样分析可知,BeCl2中Be原子采取sp杂化,BeCl2是直线形结构,CO2中C原子采取sp杂化,CO2是直线形结构,A项符合题意;SO2中S原子采取sp2杂化,SO2是V形结构,CH4中C原子采取sp3杂化,CH4是正四面体型结构,C项不符合题意;NF3中N原子采取sp3杂化,NF3是三角锥型结构,CH2O中C原子采取sp2杂化,CH2O是平面三角形结构,D项不符合题意。
4.硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
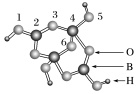
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的空间结构模型如图所示,则在Xm-中,2号硼原子的杂化类型为__________;m=__________(填数字)。
(2)BN中B的化合价为__________,请解释原因:__________________________________。
(3)BF3和过量NaF作用可生成NaBF4,BF的空间结构为____________;NaBF4的电子式为________。
答案 (1)sp2 2
(2)+3 N的电负性大于B的电负性
(3)正四面体型 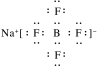
解析 (1)根据图示可知,2号B原子的价电子对数为3,且无孤电子对,故采取sp2杂化;根据图示可知,该阴离子的化学式为[H4B4O9]m-,其中H显+1价,B显+3价、O显-2价,所以m=2。(2)由于电负性:N>B,所以BN中B显+3价。
二、键角的判断与比较
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间结构的主要因素之一。在高中阶段学习中,影响键角大小的因素主要有三:一是中心原子的杂化类型;二是中心原子的孤电子对数;三是中心原子的电负性大小等。
1.中心原子杂化类型不同的粒子,键角大小:sp杂化>sp2杂化>sp3杂化,如键角:CH≡CH>CH2==CH2>CH4。
2.中心原子杂化方式相同的粒子,由于斥力:孤电子对与孤电子对之间>孤电子对与成键电子对之间>成键电子对与成键电子对之间,孤电子对数越多,对成键电子对的斥力越大,键角越小。如键角:CH4>NH3>H2O。
3.中心原子杂化方式相同且孤电子对数也相同,利用中心原子的电负性大小,比较键角大小。如H2O、H2S中,中心原子均为sp3杂化,分子空间结构均为V形,由于电负性:O>S,吸引电子的能力:O>S,且键长:O—H键<S—H键,使得H2O、H2S中成键电子对的斥力逐渐减弱,键角减小,即键角:H2O(104°30′)>H2S(92°)。
4.同一粒子中不同共价键的键角,由于斥力:双键间>双键与单键间>单键间,则键角大小不同。如甲醛中:![]() ,键角:α>β。
,键角:α>β。
![]()
5.在SO2分子中,分子的空间结构为V形,S原子采取sp2杂化,那么SO2的键角( )
A.等于120° B.大于120°
C.小于120° D.等于180°
答案 C
解析 由于SO2分子的价层电子对互斥模型为平面三角形,从理论上讲其键角应为120°,但是由于SO2分子中的S原子有一对孤电子对,对其他的两个化学键存在排斥作用,因此分子中的键角要小于120°。
6.下列分子或离子中键角由大到小排列正确的是( )
①BCl3 ②NH3 ③H2O ④PCl ⑤BeCl2
A.⑤④①②③ B.④①②⑤③
C.⑤①④②③ D.③②④①⑤
答案 C
解析
微粒 | 中心原子上孤电子对数 | 中心原子上价电子对数 | 价层电子对互斥模型名称 | 杂化轨道类型 | 空间 结构 | 键角 |
①BCl3 | ×(3-3×1)=0 | 3 | 平面三角形 | sp2 | 平面三角形 | 120° |
②NH3 | ×(5-3×1)=1 | 4 | 四面体型 | sp3 | 三角锥型 | 107°18′ |
③H2O | ×(6-2×1)=2 | 4 | 四面体型 | sp3 | V形 | 104°30′ |
④PCl | ×(5-1-4×1)=0 | 4 | 正四面体型 | sp3 | 正四面体型 | 109°28′ |
⑤BeCl2 | ×(2-2×1)=0 | 2 | 直线形 | sp | 直线形 | 180° |
故键角由大到小的顺序为⑤①④②③。
7.下列物质的分子中,键角最小的是( )
A.H2O B.BF3 C.H2S D.CH4
答案 C
解析 BF3分子中B原子采取sp2杂化,sp2杂化的理论键角为120°,B原子无孤电子对,所以BF3分子的键角为120°;CH4分子中C原子采取sp3杂化,sp3杂化的理论键角为109°28′,并且C原子无孤电子对,所以CH4的键角为109°28′;H2S和H2O分子中的S、O原子均采取sp3杂化,sp3杂化的理论键角为109°28′,由于两种分子中均存在两对孤电子对,孤电子对占据正四面体的两个顶角,且孤电子对斥力大于成键电子对的斥力,导致H2O分子的键角<109°28′,但O原子半径小,所以H2O分子中成键电子对间的斥力大于H2S分子中成键电子对间的斥力,即H2O分子键角大于H2S分子键角;综上,分子键角的大小顺序为BF3>CH4>H2O>H2S,所以键角最小的是H2S。
8.比较下列物质中键角的大小(填“>”“=”或“<”)。
(1)CH4______P4。
(2)NH3______PH3______AsH3。
(3)PF3______PCl3。
(4)光气(COCl2)中∠Cl—C==O______∠Cl—C—Cl。
答案 (1)> (2)> > (3)< (4)>
9.(2020·武汉二中高二月考)按要求回答下列问题:
(1)CH3COOH中C原子的杂化轨道类型为__________________________。
(2)醛基中碳原子的杂化轨道类型是________。
(3)化合物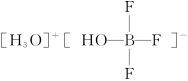 中阳离子的空间结构为______________,阴离子的中心原子轨道采取__________杂化。
中阳离子的空间结构为______________,阴离子的中心原子轨道采取__________杂化。
(4)X的单质与氢气可化合生成气体G,其水溶液pH>7。G分子中X原子的杂化轨道类型是______。
(5)S单质的常见形式为S8,其环状结构如图所示,S原子采取的轨道杂化方式是__________。
![]()
(6)H+可与H2O形成H3O+,H3O+中O原子采取________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为___________________________________________________。
答案 (1)sp3、sp2 (2)sp2 (3)三角锥型 sp3 (4)sp3
(5)sp3 (6)sp3 H3O+中O原子只有1对孤电子对,H2O中O原子有2对孤电子对,前者成键电子对与孤电子对的排斥力较小,因而键角大
解析 (1)CH3COOH分子中,—CH3和—COOH上的碳原子的杂化轨道类型分别是sp3和sp2。(2)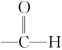 上的碳原子形成3个σ键和1个π键,采取sp2杂化。(4)G是NH3分子,N原子采取sp3杂化。(5)硫原子形成2个S—S键,还有2对孤电子对,杂化方式为sp3。(6)H2O和H3O+中的氧原子均采取sp3杂化,其键角的差异是由成键电子对与孤电子对的斥力差异所造成的。
上的碳原子形成3个σ键和1个π键,采取sp2杂化。(4)G是NH3分子,N原子采取sp3杂化。(5)硫原子形成2个S—S键,还有2对孤电子对,杂化方式为sp3。(6)H2O和H3O+中的氧原子均采取sp3杂化,其键角的差异是由成键电子对与孤电子对的斥力差异所造成的。









