


所属成套资源:通用版高考化学一轮复习检测含答案解析
(通用版)高考化学一轮复习检测20 物质结构与性质(含答案解析)
展开
这是一份(通用版)高考化学一轮复习检测20 物质结构与性质(含答案解析),共10页。试卷主要包含了5NA等内容,欢迎下载使用。
(通用版)高考化学复习检测:20 物质结构与性质(含答案解析)1.下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子的能级的是( )A.![]() B.
B.![]() C.1s22s22p3 D.
C.1s22s22p3 D.![]() 2.以NA表示阿伏加德罗常数的值,下列说法错误的是( )
2.以NA表示阿伏加德罗常数的值,下列说法错误的是( )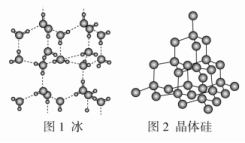
 A.18 g冰(图1)中含O—H键数目为2NAB.28 g晶体硅(图2)中含有Si—Si键数目为2NAC.44 g干冰(图3)中含有NA个晶胞结构单元D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA 3.下列指定微粒的个数比为2∶1的是( )A.Be2+中的质子和电子B.H原子中的中子和质子C.NaHCO3晶体中的阳离子和阴离子D.BaO2(过氧化钡)固体中的阴离子和阳离子 4.以下微粒含配位键的是( ) ①N2H ②CH4 ③OH- ④NH ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OHA.①②④⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部 5.下列有关化学键的叙述,正确的是( )A.离子化合物中可能含共价键B.所有物质都存在化学键C.含有极性键的分子一定是极性分子D.含有共价键的化合物一定是共价化合物 6.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如下图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A.18 g冰(图1)中含O—H键数目为2NAB.28 g晶体硅(图2)中含有Si—Si键数目为2NAC.44 g干冰(图3)中含有NA个晶胞结构单元D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA 3.下列指定微粒的个数比为2∶1的是( )A.Be2+中的质子和电子B.H原子中的中子和质子C.NaHCO3晶体中的阳离子和阴离子D.BaO2(过氧化钡)固体中的阴离子和阳离子 4.以下微粒含配位键的是( ) ①N2H ②CH4 ③OH- ④NH ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OHA.①②④⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部 5.下列有关化学键的叙述,正确的是( )A.离子化合物中可能含共价键B.所有物质都存在化学键C.含有极性键的分子一定是极性分子D.含有共价键的化合物一定是共价化合物 6.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如下图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( ) A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个OB.晶体中每个K+周围有8个O,每个O周围有8个KC.晶体中与每个K+距离最近的K+有8个D.晶体中与每个K+距离最近的K+有6个 7.下列排序正确的是( )A.酸性:H2CO3<C6H5OH<CH3COOHB.碱性:Ba(OH)2<Ca(OH)2<KOHC.熔点:MgBr2<SiCl4<BND.沸点:PH3<NH3<H2O 8.下列说法中正确的是( )A.第三周期所有元素中钠的第一电离能最小B.钠的第一电离能比镁的第一电离能大C.在所有元素中,氟的第一电离能最大D.钾的第一电离能比镁的第一电离能大 9.下列关于元素第一电离能的说法不正确的是( )A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大C.最外层电子排布式为ns2np6(当只有K层时为1s2)的原子,第一电离能较大D.对于同一元素而言,原子的电离能I1<I2<I3…… 10.下面有关晶体的叙述中,不正确的是( )A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子B.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 11.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个OB.晶体中每个K+周围有8个O,每个O周围有8个KC.晶体中与每个K+距离最近的K+有8个D.晶体中与每个K+距离最近的K+有6个 7.下列排序正确的是( )A.酸性:H2CO3<C6H5OH<CH3COOHB.碱性:Ba(OH)2<Ca(OH)2<KOHC.熔点:MgBr2<SiCl4<BND.沸点:PH3<NH3<H2O 8.下列说法中正确的是( )A.第三周期所有元素中钠的第一电离能最小B.钠的第一电离能比镁的第一电离能大C.在所有元素中,氟的第一电离能最大D.钾的第一电离能比镁的第一电离能大 9.下列关于元素第一电离能的说法不正确的是( )A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大C.最外层电子排布式为ns2np6(当只有K层时为1s2)的原子,第一电离能较大D.对于同一元素而言,原子的电离能I1<I2<I3…… 10.下面有关晶体的叙述中,不正确的是( )A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子B.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 11.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )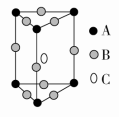 A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4 12.下列各组原子中,彼此化学性质一定相似的是( )A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子D.最外层都只有一个电子的X、Y原子 13.金属晶体中金属原子有三种常见的堆积方式:六方堆积、面心立方堆积和体心立方堆积。a、b、c分别代表这三种晶胞的结构,a、b、c三种晶胞内金属原子个数比为( )
A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4 12.下列各组原子中,彼此化学性质一定相似的是( )A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子D.最外层都只有一个电子的X、Y原子 13.金属晶体中金属原子有三种常见的堆积方式:六方堆积、面心立方堆积和体心立方堆积。a、b、c分别代表这三种晶胞的结构,a、b、c三种晶胞内金属原子个数比为( )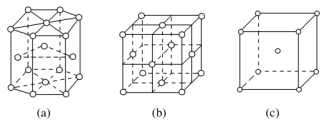 A.3∶2∶1 B.11∶8∶4 C.9∶8∶4 D.21∶14∶9 14.N2的结构可以表示为
A.3∶2∶1 B.11∶8∶4 C.9∶8∶4 D.21∶14∶9 14.N2的结构可以表示为![]() ,CO的结构可以表示为
,CO的结构可以表示为![]() ,其中椭圆框表示π键,下列说法中不正确的是( )A.N2分子与CO分子中都含有三键B.CO分子中有一个π键是配位键C.N2与CO互为等电子体D.N2与CO的化学性质相同 15.下列叙述中正确的是( )A.质量数是原子核内质子质量与中子质量之和B.具有相同质子数的微粒,其化学性质一定相同C.最外层有5个电子的原子都是非金属原子D.最外层有8个电子的微粒,不一定是稀有气体的原子 16.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )A.SO2、CS2、HI都是直线形的分子B.BF3键角为120°,SnBr2键角大于120°C.CH2O、BF3、SO3都是平面三角形的分子D.PCl3、NH3、PCl5都是三角锥形的分子 17.关于晶体的叙述中,正确的是( )A.原子晶体中,共价键的键能越大,熔、沸点越高B.分子晶体中,分子间的作用力越大,该分子越稳定C.分子晶体中,共价键的键能越大,熔、沸点越高D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 18.下列推论正确的是( )A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3B.NH为正四面体结构,可推测PH也为正四面体结构C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子 19.X是第三周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )A.X最高价氧化物对应的水化物一定是强酸B.X元素的氢化物化学式一定为H2XC.X的单质一定是良好的半导体材料D.X元素的氧化物一定能与烧碱反应 20.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法正确的是( )A.X的氢化物溶于水显酸性B.Y的氧化物是离子化合物C.Z的氧化物的水化物是强酸D.X和Z的最高价氧化物对应的水化物都是弱酸 21.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
,其中椭圆框表示π键,下列说法中不正确的是( )A.N2分子与CO分子中都含有三键B.CO分子中有一个π键是配位键C.N2与CO互为等电子体D.N2与CO的化学性质相同 15.下列叙述中正确的是( )A.质量数是原子核内质子质量与中子质量之和B.具有相同质子数的微粒,其化学性质一定相同C.最外层有5个电子的原子都是非金属原子D.最外层有8个电子的微粒,不一定是稀有气体的原子 16.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )A.SO2、CS2、HI都是直线形的分子B.BF3键角为120°,SnBr2键角大于120°C.CH2O、BF3、SO3都是平面三角形的分子D.PCl3、NH3、PCl5都是三角锥形的分子 17.关于晶体的叙述中,正确的是( )A.原子晶体中,共价键的键能越大,熔、沸点越高B.分子晶体中,分子间的作用力越大,该分子越稳定C.分子晶体中,共价键的键能越大,熔、沸点越高D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 18.下列推论正确的是( )A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3B.NH为正四面体结构,可推测PH也为正四面体结构C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子 19.X是第三周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )A.X最高价氧化物对应的水化物一定是强酸B.X元素的氢化物化学式一定为H2XC.X的单质一定是良好的半导体材料D.X元素的氧化物一定能与烧碱反应 20.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法正确的是( )A.X的氢化物溶于水显酸性B.Y的氧化物是离子化合物C.Z的氧化物的水化物是强酸D.X和Z的最高价氧化物对应的水化物都是弱酸 21.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。 (1)已知BA5为离子化合物,写出其电子式:________。(2)B元素基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
(1)已知BA5为离子化合物,写出其电子式:________。(2)B元素基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了_______________________________________________。(4)G位于第________族________区,该元素的核外电子排布式为_______________________。(5)检验F元素的方法是____________,请用原子结构的知识解释产生此现象的原因:________________________________________________________________________。 22.已知反应:
,该同学所画的电子排布图违背了_______________________________________________。(4)G位于第________族________区,该元素的核外电子排布式为_______________________。(5)检验F元素的方法是____________,请用原子结构的知识解释产生此现象的原因:________________________________________________________________________。 22.已知反应:![]() 。(1)基态Fe原子核外共有________种运动状态不相同的电子;Fe3+的价电子排布图为____________。(2)NaH的电子式为__________________;1 mol NaOH含有σ键数目为________,其中O原子的杂化类型为________;Fe3+可以和SCN-形成配合物,该反应是典型的可逆反应,说明配位原子配位能力________(填“强”或“弱”)。(3)上述反应中含Na的化合物晶体类型均为____________晶体;NaH的熔点显著高于NaOH,主要原因是_________________________________________________________________________________。(4)某种单质铁的晶体为体心立方堆积,则铁原子的配位数为________;若r(Fe)表示Fe原子的半径,单质铁的原子空间利用率为________________[列出含r(Fe)的计算表达式]。 23.短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外层电子数是Y和Z两元素原子最外层电子数的总和;Y元素原子的最外层电子数是它的电子层数的2倍,X和Z可以形成XZ3化合物。请回答:(1)X、Y、Z元素的名称分别是________、________、________。(2)化合物XZ3的分子式是________,电子式是____________。(3)X、Y的含氧酸的分子式分别为________________、________________。 24. (1)下列关于CH4和CO2的说法正确的是________(填序号)。a.固态CO2属于分子晶体b.CH4分子中含有极性共价键,是极性分子c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp(2)Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有________ mol σ键。(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
。(1)基态Fe原子核外共有________种运动状态不相同的电子;Fe3+的价电子排布图为____________。(2)NaH的电子式为__________________;1 mol NaOH含有σ键数目为________,其中O原子的杂化类型为________;Fe3+可以和SCN-形成配合物,该反应是典型的可逆反应,说明配位原子配位能力________(填“强”或“弱”)。(3)上述反应中含Na的化合物晶体类型均为____________晶体;NaH的熔点显著高于NaOH,主要原因是_________________________________________________________________________________。(4)某种单质铁的晶体为体心立方堆积,则铁原子的配位数为________;若r(Fe)表示Fe原子的半径,单质铁的原子空间利用率为________________[列出含r(Fe)的计算表达式]。 23.短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外层电子数是Y和Z两元素原子最外层电子数的总和;Y元素原子的最外层电子数是它的电子层数的2倍,X和Z可以形成XZ3化合物。请回答:(1)X、Y、Z元素的名称分别是________、________、________。(2)化合物XZ3的分子式是________,电子式是____________。(3)X、Y的含氧酸的分子式分别为________________、________________。 24. (1)下列关于CH4和CO2的说法正确的是________(填序号)。a.固态CO2属于分子晶体b.CH4分子中含有极性共价键,是极性分子c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp(2)Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有________ mol σ键。(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。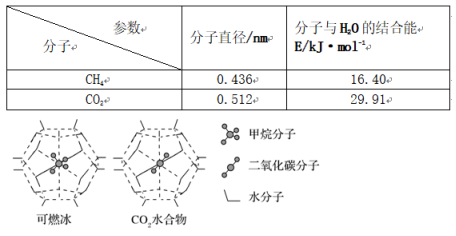 ①“可燃冰”中分子间存在的2种作用力是______________________。②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是______________________________。
①“可燃冰”中分子间存在的2种作用力是______________________。②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是______________________________。
答案解析1.答案为:C; 2.答案为:C;解析:1个水分子中含有2个O—H键,18 g冰的物质的量为1 mol,含O—H键数目为2NA,A项正确;28 g晶体硅中含有1 mol Si原子,每个硅原子与其他4个Si形成4个Si—Si键,每个硅原子形成的共价键为×4=2,则1 mol单质硅含有2 mol Si—Si键,B项正确;1个晶胞结构单元含有4个二氧化碳分子,44 g干冰中含有晶胞结构单元个数小于NA个,C项错误;在石墨烯中,每个碳原子形成3个共价键,所以每个碳原子实际占化学键为1.5个,12 g石墨烯即1 mol所含碳碳键数目为1.5NA,D项正确。 3.答案为:A;解析:A选项,Be2+为4号元素的阳离子,质子数为4,电子数为2,所以,质子数∶电子数=2∶1;B选项,质量数=质子数+中子数,所以,质子数∶中子数=1∶1;C选项,阳离子为Na+,阴离子为HCO,它们的比值为1∶1;D选项,BaO2是离子化合物,由阴离子O和阳离子Ba2+组成,其比值为1∶1。 4.答案为:C;解析:①N2H的结构式为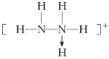 ;⑦H3O+的结构式为
;⑦H3O+的结构式为![]() ;Fe(CO)3、Fe(SCN)3、[Ag(NH3)2]OH均为配合物,中心离子(或原子)与配体之间均含配位键。 5.答案为:A;解析:A项,离子化合物中一定含有离子键,可能含共价键如NaOH等,A项正确;B项,稀有气体不存在化学键,B项错误;C项,CO2分子中含有极性键,但CO2分子属于非极性分子,C项错误;D项,某些离子化合物(如NaOH)中也含有共价键,D项错误。 6.答案为:A; 7.答案为:D;解析:A项,酸性应为CH3COOH>H2CO3>C6H5OH,错误。B项,碱性应为Ba(OH)2>KOH>Ca(OH)2,错误。C项,熔点:原子晶体>离子晶体>分子晶体,即BN>MgBr2>SiCl4,错误。D项,由于NH3、H2O分子间形成氢键,所以沸点:H2O>NH3>PH3,正确。 8.答案为:A;解析:C项,在所有元素中,He的第一电离能最大。 9.答案为:B;解析:第一电离能越小,表明该元素原子越易失去电子,活泼性越强,A项正确;同周期元素的原子半径从左到右逐渐减小,第一电离能一般来说依次增大,但有反常,如第一电离能:N>O、Mg>Al,B项错;C项所述元素为0族元素,性质稳定,第一电离能都较大。 10.答案为:B;解析:氯化钠晶体中每个Na+周围距离相等且紧邻的Na+共有12个,B项错误。 11.答案为:B;解析:A粒子数为6×=;B粒子数为6×+3×=2;C粒子数为1;故A、B、C粒子数之比为1∶4∶2。 12.答案为:C;解析:A中1s2结构的原子为He,1s22s2结构的原子为Be,两者性质不相似;B项X原子为Mg,Y原子N层上有2个电子的有多种元素,如第四周期中Ca、Fe等都符合,化学性质不一定相似;C项为同主族的元素,化学性质一定相似;D项最外层只有1个电子的元素有H、Li、Na、K、Cr、Cu等,故性质不一定相似。 13.答案为:A;解析:a中:3+2×+12×=6;b中:8×+6×=4; c中:8×+1=2所以三种晶胞内金属原子个数之比为3∶2∶1。 14.答案为:D;解析:由题意可知N2分子中N原子之间、CO分子中C、O原子之间均通过2个π键,一个σ键,即三键结合,其中,CO分子中1个π键由O原子单方面提供孤电子对,C原子提供空轨道通过配位键形成。N2化学性质相对稳定,CO具有比较强的还原性,两者化学性质不同。15.答案为:D;解析:质量数是质子数和中子数的和,质子数相同的微粒,可能是原子,也可能是分子或离子,因此化学性质不一定相同,第ⅤA族锑、铋最外层电子数为5,属于金属原子,故A、B、C不正确。 16.答案为:C;解析:A项,SO2是V形分子;CS2、HI是直线形的分子,错误;B项,BF3键角为120°,是平面三角形结构;而Sn原子价电子是4,在SnBr2中两个价电子与Br形成共价键,还有一对孤对电子,对成键电子有排斥作用,使键角小于120°,错误;C项,CH2O、BF3、SO3都是平面三角形的分子,正确;D项,PCl3、NH3都是三角锥形的分子,而PCl5是三角双锥形结构,错误。 17.答案为:A;解析:B项,分子的稳定性取决于分子内部的共价键强弱,与分子间作用力无关;C项,分子晶体熔、沸点高低,取决于分子间作用力的大小;D项,也可能是分子晶体,如HCl。 18.答案为:B;解析:NH3分子间存在氢键,沸点反常偏高,大于PH3,A项错误;N、P是同主族元素,形成的离子:NH和PH结构类似,都是正四面体构型,B项正确;CO2是分子晶体,而SiO2是原子晶体,C项错误;C2H6中两个—CH3对称,是非极性分子,而C3H8是锯齿形结构,D项错误。 19.答案为:D;解析:A项,根据已知位、构、性方面的信息推断,X为Si或S,最高价氧化物对应的水化物为H2SiO3或H2SO4,前者是弱酸,后者是强酸,错误;B项,气态氢化物为SiH4或H2S,错误;C项,单质为Si或S,前者是半导体材料,后者是绝缘体材料,错误;D项,氧化物为SiO2或SO2、SO3,都是酸性氧化物,正确。 20.答案为:B;解析:由题意知Z的最外层电子数为6、Y的最外层电子数为2,X的最外层电子数为13-6-2=5,依X、Y、Z的原子序数依次递增,可知X只能有两个电子层,X为N,所以Y、Z分别为Mg、S;由NH3溶于水显碱性、MgO是离子化合物、H2SO3是弱酸、HNO3和H2SO4均是强酸,可知只有B正确。 21.答案为:(1)
;Fe(CO)3、Fe(SCN)3、[Ag(NH3)2]OH均为配合物,中心离子(或原子)与配体之间均含配位键。 5.答案为:A;解析:A项,离子化合物中一定含有离子键,可能含共价键如NaOH等,A项正确;B项,稀有气体不存在化学键,B项错误;C项,CO2分子中含有极性键,但CO2分子属于非极性分子,C项错误;D项,某些离子化合物(如NaOH)中也含有共价键,D项错误。 6.答案为:A; 7.答案为:D;解析:A项,酸性应为CH3COOH>H2CO3>C6H5OH,错误。B项,碱性应为Ba(OH)2>KOH>Ca(OH)2,错误。C项,熔点:原子晶体>离子晶体>分子晶体,即BN>MgBr2>SiCl4,错误。D项,由于NH3、H2O分子间形成氢键,所以沸点:H2O>NH3>PH3,正确。 8.答案为:A;解析:C项,在所有元素中,He的第一电离能最大。 9.答案为:B;解析:第一电离能越小,表明该元素原子越易失去电子,活泼性越强,A项正确;同周期元素的原子半径从左到右逐渐减小,第一电离能一般来说依次增大,但有反常,如第一电离能:N>O、Mg>Al,B项错;C项所述元素为0族元素,性质稳定,第一电离能都较大。 10.答案为:B;解析:氯化钠晶体中每个Na+周围距离相等且紧邻的Na+共有12个,B项错误。 11.答案为:B;解析:A粒子数为6×=;B粒子数为6×+3×=2;C粒子数为1;故A、B、C粒子数之比为1∶4∶2。 12.答案为:C;解析:A中1s2结构的原子为He,1s22s2结构的原子为Be,两者性质不相似;B项X原子为Mg,Y原子N层上有2个电子的有多种元素,如第四周期中Ca、Fe等都符合,化学性质不一定相似;C项为同主族的元素,化学性质一定相似;D项最外层只有1个电子的元素有H、Li、Na、K、Cr、Cu等,故性质不一定相似。 13.答案为:A;解析:a中:3+2×+12×=6;b中:8×+6×=4; c中:8×+1=2所以三种晶胞内金属原子个数之比为3∶2∶1。 14.答案为:D;解析:由题意可知N2分子中N原子之间、CO分子中C、O原子之间均通过2个π键,一个σ键,即三键结合,其中,CO分子中1个π键由O原子单方面提供孤电子对,C原子提供空轨道通过配位键形成。N2化学性质相对稳定,CO具有比较强的还原性,两者化学性质不同。15.答案为:D;解析:质量数是质子数和中子数的和,质子数相同的微粒,可能是原子,也可能是分子或离子,因此化学性质不一定相同,第ⅤA族锑、铋最外层电子数为5,属于金属原子,故A、B、C不正确。 16.答案为:C;解析:A项,SO2是V形分子;CS2、HI是直线形的分子,错误;B项,BF3键角为120°,是平面三角形结构;而Sn原子价电子是4,在SnBr2中两个价电子与Br形成共价键,还有一对孤对电子,对成键电子有排斥作用,使键角小于120°,错误;C项,CH2O、BF3、SO3都是平面三角形的分子,正确;D项,PCl3、NH3都是三角锥形的分子,而PCl5是三角双锥形结构,错误。 17.答案为:A;解析:B项,分子的稳定性取决于分子内部的共价键强弱,与分子间作用力无关;C项,分子晶体熔、沸点高低,取决于分子间作用力的大小;D项,也可能是分子晶体,如HCl。 18.答案为:B;解析:NH3分子间存在氢键,沸点反常偏高,大于PH3,A项错误;N、P是同主族元素,形成的离子:NH和PH结构类似,都是正四面体构型,B项正确;CO2是分子晶体,而SiO2是原子晶体,C项错误;C2H6中两个—CH3对称,是非极性分子,而C3H8是锯齿形结构,D项错误。 19.答案为:D;解析:A项,根据已知位、构、性方面的信息推断,X为Si或S,最高价氧化物对应的水化物为H2SiO3或H2SO4,前者是弱酸,后者是强酸,错误;B项,气态氢化物为SiH4或H2S,错误;C项,单质为Si或S,前者是半导体材料,后者是绝缘体材料,错误;D项,氧化物为SiO2或SO2、SO3,都是酸性氧化物,正确。 20.答案为:B;解析:由题意知Z的最外层电子数为6、Y的最外层电子数为2,X的最外层电子数为13-6-2=5,依X、Y、Z的原子序数依次递增,可知X只能有两个电子层,X为N,所以Y、Z分别为Mg、S;由NH3溶于水显碱性、MgO是离子化合物、H2SO3是弱酸、HNO3和H2SO4均是强酸,可知只有B正确。 21.答案为:(1) 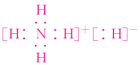 (2)3 哑铃(或纺锤) (3)泡利原理(4)ⅦB d 1s22s22p63s23p63d54s2或[Ar]3d54s2(5)焰色反应 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量解析:由题给信息可知元素A、B、C、D、E、F、G分别为H、N、Mg、P、Cl、K、Mn。(1)离子化合物NH5为氢化铵。(2)氮原子的基态原子能量最高的电子为p电子,p电子云有3个方向,原子轨道呈哑铃形或纺锤形。(3)题图中3s轨道的两个电子自旋状态相同,违背了泡利原理。(5)检验钾元素的方法是利用焰色反应。其原理是电子跃迁时会释放能量,释放特定频率的光谱。 22.答案为:(1)26
(2)3 哑铃(或纺锤) (3)泡利原理(4)ⅦB d 1s22s22p63s23p63d54s2或[Ar]3d54s2(5)焰色反应 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量解析:由题给信息可知元素A、B、C、D、E、F、G分别为H、N、Mg、P、Cl、K、Mn。(1)离子化合物NH5为氢化铵。(2)氮原子的基态原子能量最高的电子为p电子,p电子云有3个方向,原子轨道呈哑铃形或纺锤形。(3)题图中3s轨道的两个电子自旋状态相同,违背了泡利原理。(5)检验钾元素的方法是利用焰色反应。其原理是电子跃迁时会释放能量,释放特定频率的光谱。 22.答案为:(1)26 ![]() (2)Na+[H]- NA sp3 弱(3)离子 H-半径小,NaH的晶格能大于NaOH的晶格能(4)8 解析:(1)基态Fe原子核外有26个电子,每个电子的运动状态均不相同,故基态Fe原子核外有26种运动状态不相同的电子;基态Fe原子的核外电子排布式为[Ar]3d64s2,则Fe3+的核外电子排布式为[Ar]3d5,其价电子排布图为
(2)Na+[H]- NA sp3 弱(3)离子 H-半径小,NaH的晶格能大于NaOH的晶格能(4)8 解析:(1)基态Fe原子核外有26个电子,每个电子的运动状态均不相同,故基态Fe原子核外有26种运动状态不相同的电子;基态Fe原子的核外电子排布式为[Ar]3d64s2,则Fe3+的核外电子排布式为[Ar]3d5,其价电子排布图为![]() 。(2)NaH是离子化合物,由Na+和H-构成,其电子式为Na+[H]-。NaOH由Na+和OH-构成,其中OH-含有极性键(O—H键),故1 mol NaOH含有的σ键数目为NA。OH-中O原子形成1个σ键,且O原子有3对孤对电子,故O原子采取sp3杂化。Fe3+与SCN-形成配合物的反应为典型的可逆反应,说明生成的配合物稳定性较弱,易分解生成Fe3+、SCN-,据此推知配位原子的配位能力较弱。(3)NaH和NaOH均由离子构成,均属于离子晶体;离子晶体的熔点与晶格能的大小有关,晶格能越大,晶体的熔点越高,而晶格能的大小与离子半径、所带电荷数有关。H-的半径小于OH-的半径,则NaH的晶格能大于NaOH,因此NaH的熔点高于NaOH的熔点。(4)某单质铁的晶体为体心立方堆积,则Fe原子的配位数为8;每个晶胞中含有Fe原子个数为1+8×=2,结合球体的体积公式“V=πr3”可知,2个Fe原子的总体积为πr3(Fe);设晶胞的棱长为a,由[4r(Fe)]2=3a2可得a=,则晶胞的体积为3,故单质铁的原子空间利用率为=。 23.答案为:(1)氮 碳 氢;(2)NH3
。(2)NaH是离子化合物,由Na+和H-构成,其电子式为Na+[H]-。NaOH由Na+和OH-构成,其中OH-含有极性键(O—H键),故1 mol NaOH含有的σ键数目为NA。OH-中O原子形成1个σ键,且O原子有3对孤对电子,故O原子采取sp3杂化。Fe3+与SCN-形成配合物的反应为典型的可逆反应,说明生成的配合物稳定性较弱,易分解生成Fe3+、SCN-,据此推知配位原子的配位能力较弱。(3)NaH和NaOH均由离子构成,均属于离子晶体;离子晶体的熔点与晶格能的大小有关,晶格能越大,晶体的熔点越高,而晶格能的大小与离子半径、所带电荷数有关。H-的半径小于OH-的半径,则NaH的晶格能大于NaOH,因此NaH的熔点高于NaOH的熔点。(4)某单质铁的晶体为体心立方堆积,则Fe原子的配位数为8;每个晶胞中含有Fe原子个数为1+8×=2,结合球体的体积公式“V=πr3”可知,2个Fe原子的总体积为πr3(Fe);设晶胞的棱长为a,由[4r(Fe)]2=3a2可得a=,则晶胞的体积为3,故单质铁的原子空间利用率为=。 23.答案为:(1)氮 碳 氢;(2)NH3 ![]() (3)HNO3(或HNO2) H2CO3解析:短周期即一、二、三周期,又原子序数依次变小,核外电子层数之和是5,所以X、Y、Z原子核外电子层数分别是2、2、1,在元素周期表内的二、二、一周期,所以Z在第一周期,X、Y在第二周期。Y元素原子的最外层电子数是它的电子层数的2倍,则Y是碳(C)元素,其最外层电子数是4。原子序数X>Y,又X和Z可以形成化合物XZ3,所以预测Z是氢(H)元素、X是氮(N)元素,正好与X元素原子最外层电子数是Y和Z两元素原子最外层电子数的总和相吻合。 24.答案为:(1)ad;(2)8;(3)①氢键、范德华力 ②CO2的分子直径小于笼状空腔直径,且与H2O的结合力大于CH4解析:(1)a项,固态CO2是由CO2分子通过分子间作用力结合而成的分子晶体,正确;b项,CH4分子中含有极性共价键,但由于该分子中的共价键排列对称,因此该分子是非极性分子,错误;c项,固态时CH4和CO2都是分子晶体,分子之间通过分子间作用力结合,分子间作用力越强,物质的熔、沸点就越高,而不是取决于分子内共价键的强弱,错误;d项,CH4分子中碳原子形成的都是σ键,C原子采取sp3杂化,而CO2分子中的C原子与两个O原子形成的是碳氧双键,含有2个σ键和2个π键,C原子采取sp杂化,正确。故答案选a、d。(2)Ni能与CO形成正四面体型的配合物Ni(CO)4,在每个配位体中含有1个σ键,在每个配位体与中心原子之间也形成1个σ键,所以1 mol Ni(CO)4中含有8 mol σ键。(3)①“可燃冰”中分子间存在的2种作用力分别是分子间作用力(也叫范德华力)和氢键。②根据表中的数据可知,笼状结构的空腔直径为0.586 nm,大于CO2分子的直径(0.512 nm),而且CO2与H2O分子之间的结合力大于CH4,因此可以实现用CO2置换出“可燃冰”中CH4的设想。
(3)HNO3(或HNO2) H2CO3解析:短周期即一、二、三周期,又原子序数依次变小,核外电子层数之和是5,所以X、Y、Z原子核外电子层数分别是2、2、1,在元素周期表内的二、二、一周期,所以Z在第一周期,X、Y在第二周期。Y元素原子的最外层电子数是它的电子层数的2倍,则Y是碳(C)元素,其最外层电子数是4。原子序数X>Y,又X和Z可以形成化合物XZ3,所以预测Z是氢(H)元素、X是氮(N)元素,正好与X元素原子最外层电子数是Y和Z两元素原子最外层电子数的总和相吻合。 24.答案为:(1)ad;(2)8;(3)①氢键、范德华力 ②CO2的分子直径小于笼状空腔直径,且与H2O的结合力大于CH4解析:(1)a项,固态CO2是由CO2分子通过分子间作用力结合而成的分子晶体,正确;b项,CH4分子中含有极性共价键,但由于该分子中的共价键排列对称,因此该分子是非极性分子,错误;c项,固态时CH4和CO2都是分子晶体,分子之间通过分子间作用力结合,分子间作用力越强,物质的熔、沸点就越高,而不是取决于分子内共价键的强弱,错误;d项,CH4分子中碳原子形成的都是σ键,C原子采取sp3杂化,而CO2分子中的C原子与两个O原子形成的是碳氧双键,含有2个σ键和2个π键,C原子采取sp杂化,正确。故答案选a、d。(2)Ni能与CO形成正四面体型的配合物Ni(CO)4,在每个配位体中含有1个σ键,在每个配位体与中心原子之间也形成1个σ键,所以1 mol Ni(CO)4中含有8 mol σ键。(3)①“可燃冰”中分子间存在的2种作用力分别是分子间作用力(也叫范德华力)和氢键。②根据表中的数据可知,笼状结构的空腔直径为0.586 nm,大于CO2分子的直径(0.512 nm),而且CO2与H2O分子之间的结合力大于CH4,因此可以实现用CO2置换出“可燃冰”中CH4的设想。
相关试卷
这是一份(通用版)高考化学一轮复习检测21 物质结构与性质综合题(含答案解析),共10页。
这是一份2023届人教版高考化学一轮复习物质结构与性质阶段检测含答案,共7页。试卷主要包含了下表是元素周期表中的一部分等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习单元训练卷第十八单元物质结构及性质A卷(含解析),共8页。试卷主要包含了选择题的作答,非选择题的作答,下列说法不正确的是,下列说法正确的是等内容,欢迎下载使用。









