
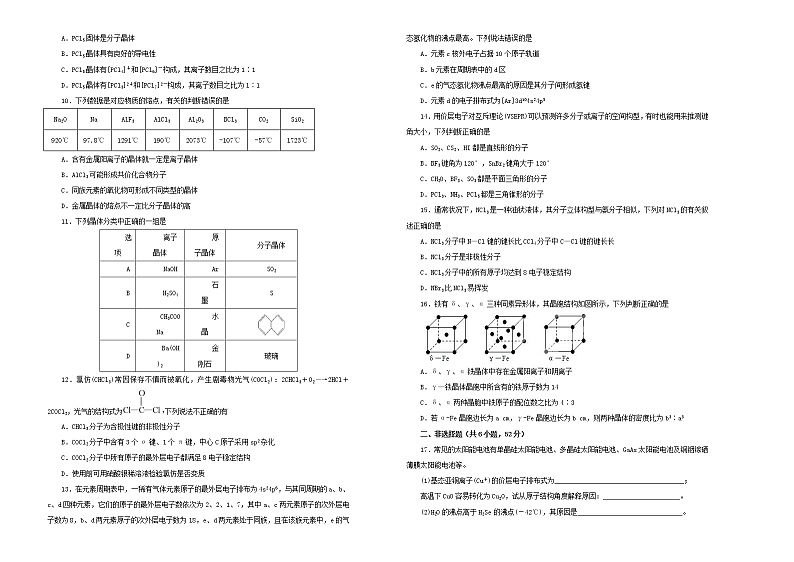
还剩5页未读,
继续阅读
所属成套资源:(通用版)高考化学一轮复习单元训练卷AB卷(含解析)
成套系列资料,整套一键下载
(通用版)高考化学一轮复习单元训练卷第十八单元物质结构及性质B卷(含解析)
展开这是一份(通用版)高考化学一轮复习单元训练卷第十八单元物质结构及性质B卷(含解析),共8页。试卷主要包含了选择题的作答,非选择题的作答,下列各项叙述中,正确的是,经X射线研究证明等内容,欢迎下载使用。
第十八单元 物质结构及性质
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39
一、选择题(每小题3分,共48分)
1.下列有关化学用语表示正确的是
A.Al3+的结构示意图: B.HClO的电子式:H
C.中子数为8的氮原子:N D.二氧化碳分子的比例模型:
2.下列说法正确的是
A.含有非极性键的分子不一定是共价化合物
B.分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响
C.根据π键的成键特征判断C=C键能是C﹣C键能的2倍
D.H2O中心原子采取sp杂化
3.某物质的化学式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液不产生沉淀,加入强碱也没有NH3放出,则关于此化合物的说法中正确的是
A.该配合物中中心原子(离子)的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与中心原子(离子)形成配位键
D.配合物中心原子(离子)与Cl-形成配位键,而与NH3分子不形成配位键
4.前20号主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y、Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。含有元素Z的盐的焰色反应为紫色。下到说法正确的是
A.原子半径的大小W<X
C.Z的单质与水反应比Y的单质与水反应剧烈
D.工业上通过电解W、Y组成的化合物制备单质Y
5.下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.最外层都只有一个电子的X、Y原子
D.2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子
6.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
7.下列各项叙述中,正确的是
A.能层序数越大,s原子轨道的形状不相同,但半径越大
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子由1s22s22p63s2→ls22s22p63p2时,原子吸收能量,由基态转化成激发态
D.原子价电子排布式为5s1的元素,其氢氧化物不能使氢氧化铝溶解
8.2018年7月5日《科学》杂志在线报道:合成一种新的具有超高热导率半导体材料——砷化硼(BAs)。通过反应4BI3(g)+As4(g)4BAs(s,晶体)+6I2(g)可制备BAs晶体。下列说法错误的是
图(a) 图(b) 图(c)
A.图(a)表示As4结构,As4分子中成键电子对与孤电子对数目之比为3∶1
B.图(b)表示晶态单质硼的B12基本结构单元,该基本单元为正20面体
C.图(b)所示晶态单质硼的熔点为2180℃,它属于原子晶体
D.图(c)表示BAs晶胞结构,As原子的配位数为4
9.经X射线研究证明:PCl5在固体状态时,由空间构型分别是正四面体和正八面体两种离子构成,下列关于PCl5的推断正确的是
A.PCl5固体是分子晶体
B.PCl5晶体具有良好的导电性
C.PCl5晶体有[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1
D.PCl5晶体有[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1
10.下列数据是对应物质的熔点,有关的判断错误的是
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920℃
97.8℃
1291℃
190℃
2073℃
-107℃
-57℃
1723℃
A.含有金属阳离子的晶体就一定是离子晶体
B.AlCl3可能形成共价化合物分子
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
11.下列晶体分类中正确的一组是
选项
离子晶体
原子晶体
分子晶体
A
NaOH
Ar
SO2
B
H2SO4
石墨
S
C
CH3COONa
水晶
D
Ba(OH)2
金刚石
玻璃
12.氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl+2COCl2,光气的结构式为下列说法不正确的有
A.CHCl3分子为含极性键的非极性分子
B.COCl2分子中含有3个σ键、1个π键,中心C原子采用sp2杂化
C.COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.使用前可用硝酸银稀溶液检验氯仿是否变质
13.在元素周期表中,一稀有气体元素原子的最外层电子排布为4s24p6,与其同周期的a、b、c、d四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中a、c两元素原子的次外层电子数为8,b、d两元素原子的次外层电子数为18,e、d两元素处于同族,且在该族元素中,e的气态氢化物的沸点最高。下列说法错误的是
A.元素c核外电子占据10个原子轨道
B.b元素在周期表中的d区
C.e的气态氢化物沸点最高的原因是其分子间形成氢键
D.元素d的电子排布式为[Ar]3d104s24p5
14.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.CH2O、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
15.通常状况下,NCl3是一种油状液体,其分子立体构型与氨分子相似,下列对NCl3的有关叙述正确的是
A.NCl3分子中N—Cl键的键长比CCl4分子中C—Cl键的键长长
B.NCl3分子是非极性分子
C.NCl3分子中的所有原子均达到8电子稳定结构
D.NBr3比NCl3易挥发
16.铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,下列判断正确的是
A.δ、γ、α铁晶体中存在金属阳离子和阴离子
B.γ—铁晶体晶胞中所含有的铁原子数为14
C.δ、α两种晶胞中铁原子的配位数之比为4∶3
D.若α-Fe晶胞边长为a cm,γ-Fe晶胞边长为b cm,则两种晶体的密度比为b3∶a3
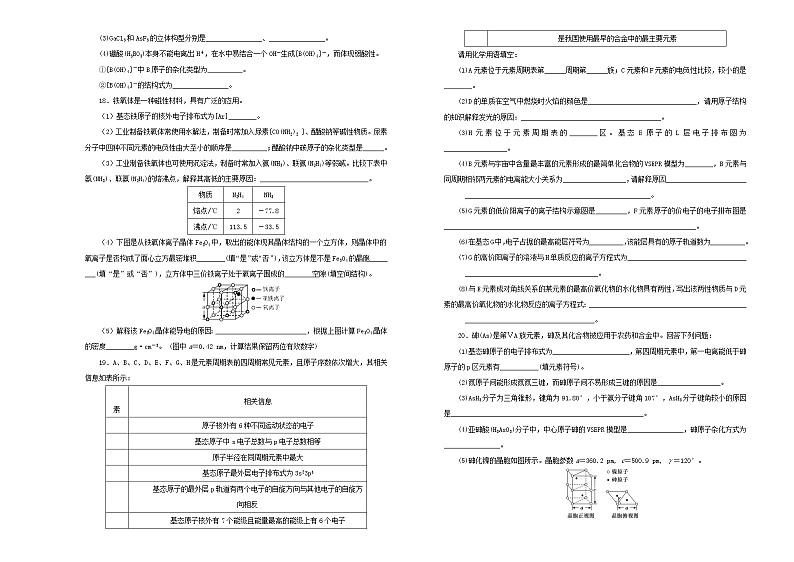
二、非选择题(共6小题,52分)
17.常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为_____________________________________;
高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________。
(2)H2O的沸点高于H2Se的沸点(-42℃),其原因是______________________________。
(3)GaCl3和AsF3的立体构型分别是________________、________________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为__________。
②[B(OH)4]-的结构式为________________。
18.铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布式为[Ar]________。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是__________;醋酸钠中碳原子的杂化类型是______。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因:_______________________________。
物质
N2H4
NH3
熔点/℃
2
-77.8
沸点/℃
113.5
-33.5
(4)下图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积________(填“是”或“否”),该立方体是不是Fe3O4的晶胞_____
___(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________空隙(填空间结构)。
(5)解释该Fe3O4晶体能导电的原因:__________________________,根据上图计算Fe3O4晶体的密度________g·cm-3。 (图中a=0.42 nm,计算结果保留两位有效数字)
19.A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示:
元素
相关信息
A
原子核外有6种不同运动状态的电子
C
基态原子中s电子总数与p电子总数相等
D
原子半径在同周期元素中最大
E
基态原子最外层电子排布式为3s23p1
F
基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反
G
基态原子核外有7个能级且能量最高的能级上有6个电子
H
是我国使用最早的合金中的最主要元素
请用化学用语填空:
(1)A元素位于元素周期表第______周期第______族;C元素和F元素的电负性比较,较小的是________。
(2)D的单质在空气中燃烧时火焰的颜色是_______________________________,请用原子结构的知识解释发光的原因:________________________________________。
(3)H元素位于元素周期表的________区。基态E原子的L层电子排布图为__________________。
(4)B元素与宇宙中含量最丰富的元素形成的最简单化合物的VSEPR模型为________,B元素与同周期相邻两元素的电离能大小关系为__________________,请解释原因_______________________
_____________________________________________________。
(5)G元素的低价阳离子的离子结构示意图是_________,F元素原子的价电子的电子排布图是________________________________________________________________________。
(6)在基态G中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为__________。
(7)G的高价阳离子的溶液与H单质反应的离子方程式为__________________________________
______________________________________。
(8)与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_____________________________________________
_____________________________________。
20.砷(As)是第ⅤA族元素,砷及其化合物被应用于农药和合金中。回答下列问题:
(1)基态砷原子的电子排布式为______________________,第四周期元素中,第一电离能低于砷原子的p区元素有___________(填元素符号)。
(2)氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因是__________________。
(3)AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是_______________________________________________________。
(4)亚砷酸(H3AsO3)分子中,中心原子砷的VSEPR模型是________________,砷原子杂化方式为________________。
(5)砷化镍的晶胞如图所示。晶胞参数a=360.2 pm, c=500.9 pm, γ=120°。
该晶体密度的计算式为_____________________________________________g·cm-3。
单元训练金卷·高三·化学卷(B)
第十八单元 物质结构及性质
答 案
一、选择题(每小题3分,共48分)
1.【答案】A
【解析】A.Al3+的核电荷数为13,核外只有10个电子,离子结构示意图为,故A正确; B.HClO是共价化合物,分子内氧原子分别与H、Cl各形成1个共用电子对,其电子式为,故B错误;C.中子数为8的氮原子的质量数为15,其核素表示形成为,故C错误;D.二氧化碳分子中碳原子的半径比氧原子半径大,则CO2的比例模型为,故D错误;故答案为A。
2.【答案】A
【解析】A.氧气分子间存在非极性共价键,但氧气是单质,不是化合物,故A正确;B.化学键是指分子或晶体中,直接相邻的原子之间的强烈相互作用,分子间作用力是指分子间存在着将分子聚集在一起的作用力,分子间作用力比化学键弱得多,化学键影响物质的化学性质和物理性质,分子间作用力影响物质熔沸点和溶解性,影响着物质的溶解度,故B错误;C.已知碳碳双键中含有1个σ键和1个π键,C-C中只含有1个σ键,而且π键不稳定键能比σ键小,所以碳碳双键的键能比碳碳单键键能的2倍要小,故B错误;D.H2O中价层电子对个数=σ键个数+孤电子对个数=2+2=4,所以采取sp3杂化,故D错误;答案:A
3.【答案】C
【解析】化学式为PtCl4·2NH3的物质,其水溶液不导电说明它不是离子化合物,在溶液中不能电离出阴、阳离子,加入AgNO3不产生沉淀,用强碱处理没有NH3放出,说明不存在游离的Cl-和NH3,所以该物质的配位化学式为[PtCl4(NH3)2]。
4.【答案】C
【解析】W的原子最外层电子数是次外层电子数的3倍,推出W为O,含有Z元素盐的焰色反应为紫色,说明Z为K,X、Y、Z分属不同的周期,原子序数依次增大,因此X为F,X、Y、Z的原子序数之和是W原子序数的5倍,推出Y为Mg,A、原子半径大小顺序是K>Mg>O>F,故A错误;B、非金属性越强,其氢化物的稳定性越强,F的非金属性强于O,因此HF的稳定性强于H2O,故B错误;C、K比Mg活泼,K与水反应剧烈程度强于Mg与水,故C正确;D、MgO的熔点很高,因此工业上常电解熔融状态的MgCl2制备Mg,故D错误。
5.【答案】D
【解析】A.X和Y的价电子数目不相等,二者性质不同,故A错误;B.原子核外M层上仅有两个电子的X为Mg元素,原子核外N层上仅有两个电子的Y可能为Ca、Sc、Ti、V、Fe、Co、Ni、Zn等元素,价电子数不同,性质不相同,故B错误;C.最外层都只有一个电子的X、Y原子,可能为H与碱金属元素,性质有相似地方,都具有还原性,但与ⅠB族元素性质不同,虽然最外层也有1个电子,故C错误;D.2p轨道上有三个未成对的电子的X原子是N原子,3p轨道上有三个未成对的电子的Y原子是P原子,二者位于周期表同一主族,最外层电子数相同,性质相似,故D正确;故答案为D。
6.【答案】A
【解析】由四种元素基态原子电子排布式可知①1s22s22p63s23p4是S元素,②1s22s22p63s23p3是P元素,③1s22s22p3是N元素,④1s22s22p5是F元素;A.同周期自左而右第一电离能呈增大趋势,但N原子2p、P元素原子3p能级均容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能S<P,同主族自上而下第一电离能降低,所以第一电离能N>P,因此第一电离能S<P<N<F,即④>③>②>①,A正确;B.同周期自左而右原子半径减小,所以原子半径P>S,N>F,电子层越多原子半径越大,故原子半径P>S>N>F,即②>①>③>④,B错误;C.同周期自左而右电负性增大,所以电负性P<S,N<F,N元素非金属性比S元素强,所以电负性S<N,故电负性P<S<N<F,即④>③>①>②,C错误;D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>②=③>④,D错误;答案选A。
7.【答案】C
【解析】A、s能级的轨道都是球形的,且电子层序数越大,半径也就越大,故A错误;B、在一个轨道中电子的自旋方向肯定不同,但在同一电子层的不同轨道中,电子的自旋方向是可以相同的,故B错误;C、Mg原子3s2能级上的2个电子吸收能量跃迁到3p2轨道上,由基态转化为激发态,故C正确;D、原子的最外层电子排布是5s1的元素是Rb元素,其氢氧化物是强碱,可以与氢氧化铝反应,故D错误;故选C。
8.【答案】A
【解析】A. 图(a)表示As4结构,每个As原子最外层有5个电子,形成3个σ键,还有1对孤电子对,As4分子中成键电子对与孤电子对数目之比为6∶4,即3∶2,故A错误;B. 图(b)表示晶态单质硼的B12基本结构单元,每个面都是由3个B原子形成的正三角形,每个B原子被5个正三角形共用,一共20个面,所以该基本单元为正20面体,故B正确;C. 单质硼的熔点为2180℃,熔点较高,且原子间通过共价键结合,属于原子晶体,故C正确;D. BAs晶胞中,较大的原子为As原子,在其周围最近的B原子数目为4,所以As原子的配位数为4,故D正确;故选A。
9.【答案】C
【解析】A项,根据题意PCl5固体由两种离子构成,PCl5固体属于离子晶体,A项错误;B项,PCl5晶体属于离子晶体,离子晶体中阴、阳离子不自由移动,PCl5晶体没有良好的导电性,B项错误;C项,两种离子分别是正四面体和正八面体,正四面体的为AB4型,正八面体的为AB6型,根据PCl5的化学式,正四面体型的为[PCl4]+,正八面体型的为[PCl6]-,且两种离子数目之比为1:1,C项正确;D项,两种离子分别是正四面体和正八面体,正四面体的为AB4型,正八面体的为AB6型,根据PCl5的化学式,正四面体型的为[PCl4]+,正八面体型的为[PCl6]-,且两种离子数目之比为1:1,D项错误;答案选C。
10.【答案】A
【解析】A.含有金属阳离子的晶体可能是金属晶体,也可能是离子晶体,所以含有金属阳离子的晶体不一定是离子晶体,故A错误;B.AlCl3的熔点为190℃,比较低,符合分子晶体的物理性质,属于共价化合物分子,故B正确;C.C和Si同主族,但氧化物的晶体类型不同,CO2、SiO2分别属于分子晶体和原子晶体,故C正确;D.Na的熔点比AlCl3低,所以金属晶体的熔点不一定比分子晶体的高,故D正确。
11.【答案】C
【解析】A项中固态Ar为分子晶体;B项中H2SO4为分子晶体、石墨是混合型晶体;D项中玻璃是非晶体。
12.【答案】A
【解析】A项,CHCl3中含C—H键和C—Cl键,C—H键和C—Cl键都是极性键,CHCl3为四面体形分子,分子中正电中心和负电中心不重合,CHCl3为极性分子,错误;B项,单键是σ键,双键中有1个σ键和1个π键,根据COCl2的结构式知,COCl2分子中含有3个σ键、1个π键,中心原子C采用sp2杂化,正确;C项,COCl2的电子式为所有原子的最外层都满足8电子稳定结构,正确;D项,CHCl3不会电离出Cl-,HCl在水溶液中会电离出H+和Cl-,使用前向氯仿中加入AgNO3稀溶液,若产生白色沉淀表明氯仿变质,若无明显现象表明氯仿没有变质,正确。
13.【答案】B
【解析】由题意知,a为Ca、c为K、b为Zn、d为Br;e、d两元素处于同族,且在该族元素中,e的气态氢化物的沸点最高,则e为F;元素c为K,核电荷数为19,核外电子排布式为1s22s22p63s23p64s1,核外电子占据10个原子轨道,A正确;b为 Zn元素,核外电子排布式为1s22s22p63s23p63d104s2,处于周期表中第四周期第ⅡB族,属于ds区,B错误;e的气态氢化物为HF,分子间存在氢键,沸点最高,C正确;元素d为Br,核电荷数为35,电子排布式为[Ar]3d104s24p5,D正确。
14.【答案】C
【解析】A.SO2是V形分子,CS2、HI是直线形的分子,错误;B.BF3键角为120°,是平面三角形结构;而Sn原子价电子数是4,在SnBr2中两个价电子与Br形成共价键,还有一对孤电子对,对成键电子有排斥作用,使键角小于120°,错误;C.CH2O、BF3、SO3都是平面三角形的分子,正确;D.PCl3、NH3都是三角锥形的分子,而PCl5是三角双锥形分子,错误。
15.【答案】C
【解析】因碳原子半径比氮原子的大,故N—Cl键的键长比C—Cl键的键长短;NCl3分子立体构型类似NH3,故NCl3是极性分子;NBr3与NCl3二者结构相似,由于NBr3的相对分子质量较大,分子间作用力较大,所以NBr3的沸点比NCl3高,因此NBr3比NCl3难挥发。
16.【答案】C
【解析】A、金属晶体中存在金属阳离子和自由电子,不存在阴离子,选项A错误;B、γ—铁晶体晶胞中所含有的铁原子数为=4,选项B错误;C、—晶胞中Fe原子的配位数为8,—晶胞中铁原子的配位数为6,故二者铁原子的配位数之比为8∶6=4∶3,选项C正确;D、—铁晶体晶胞中所含有的铁原子数为8×=1,ρα=,γ—铁晶体晶胞中所含有的铁原子数为 =4,ργ=, b3∶4a3,选项D错误。答案选C。
二、非选择题(共52分)
17.【答案】(1)3d10 Cu2O中Cu+的价层电子排布处于稳定的全充满状态
(2)H2O分子间存在氢键,H2Se分子间无氢键
(3)平面三角形 三角锥形
(4)①sp3 ②或
【解析】(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,根据构造原理知Cu+基态核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,则基态亚铜离子(Cu+)的价层电子排布式为3d10;原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定,故高温下CuO容易转化为Cu2O。(2)H2O和H2Se都是极性分子,但由于H2O的分子间还有氢键存在,所以H2O沸点比H2Se沸点高。(3)GaCl3中价层电子对个数=3+×(3-3×1)=3,且没有孤电子对,所以其空间构型是平面三角形结构;AsF3中价电子对个数=3+×(5-3×1)=4,有一个孤电子对,所以其空间构型是三角锥形。(4)①在[B(OH)4]-中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与4个羟基相连,一对孤电子对,为sp3杂化。②[B(OH)4]-离子中的配位键,氧元素提供孤对电子给硼元素O→B,可表示为或。
18.【答案】(1)3d64s2
(2)O>N>C>H sp3、sp2
(3)联氨分子间形成的氢键数多于氨分子间形成的氢键数
(4)是 是 正八面体
(5)电子可在两种不同价态的铁离子间快速发生转移 5.2
【解析】(1)铁的核外电子总数为26,则基态铁原子的核外电子排布式为[Ar]3d64s2 。(2)尿素[CO(NH2)2 ]所含四种元素分别为N、H、C、O,元素的非金属性越强,电负性越大,则四种元素的电负性由大至小的顺序是O>N>C>H;CH3COONa中甲基中的C原子 sp3杂化,羧基中的C原子 sp2杂化。(3)氨和联氨分子间均存在氢键,但联氨分子间形成的氢键数多于氨分子间形成的氢键数,故联氨的沸点明显高于氨。(4)由图示可知晶体中的氧离子构成面心立方最密堆积,该立方体中氧离子数目为12×+1=4,Fe3+的数目为4×+3×=2,Fe2+的数目为1,则Fe和O的原子数目为3∶4,是Fe3O4的晶胞;立方体中三价铁离子周围有6个氧离子围成的正八面体空隙中心。(5)晶体中电子可在两种不同价态的铁离子间快速发生转移,则Fe3O4晶体能导电;晶体的体积为a3=(0.42×10-7cm)3,每摩尔晶胞的质量为(56×3+16×4) g=232 g,则Fe3O4晶体的密度==5.2 g·cm-3。
19.【答案】(1)二 ⅣA Cl
(2)黄色 电子由高能量的激发态跃迁到低能量的激发态或基态释放能量,以光辐射的形式表现出来
(3)ds
(4)四面体 C
(6)N 16
(7)2Fe3++Cu===2Fe2++Cu2+
(8)Be(OH)2+2OH-===BeO+2H2O
【解析】A的原子核外共有6个电子,A为碳元素;C的核外电子排布式为1s22s22p4,C是氧元素;由于A、B、C原子序数依次递增,故B是氮元素;D是钠元素;E是铝元素;F的p轨道上有5个电子,是氯元素;G的电子排布式为1s22s22p63s23p63d64s2,是铁元素;H是铜元素;所以A、B、C、D、E、F、G、H分别是C、N、O、Na、Al、Cl、Fe、Cu。(1)A为碳元素,原子序数是6,位于元素周期表第二周期第ⅣA族;O与Cl形成的化合物中O元素表现负价,对电子的吸引能力更强,故Cl的电负性较小。(2)钠在空气中燃烧时火焰的颜色是黄色的,钠原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,处于激发态,处于激发态的电子是不稳定的,很快跃迁回能量较低的轨道(低能量的激发态或基态),这时就将多余的能量以光的形式放出。(3)Cu是29号元素,价电子排布式为3d104s1,所以Cu元素位于元素周期表的ds区,Al原子的电子排布式是1s22s22p63s23p1,L层是第二层,电子排布图为(4)N元素与宇宙中含量最丰富的元素形成的最简单化合物为NH3,分子构型为三角锥形;C、N、O三种元素的第一电离能大小顺序是N>O>C;C、N、O元素是同一周期,在同周期中,随原子序数递增,第一电离能逐渐增大,但N元素的2p轨道处于半充满状态,比较稳定,较难失去电子,所以比相邻的氧元素要大。(5)G为Fe元素,其低价阳离子的离子结构示意图是;F为Cl元素,其原子的价电子构型的电子排布图(轨道表示式)是(6)G为Fe元素,其基态原子核外电子排布式是1s22s22p63s23p63d64s2,电子占据的最高能层是4s,所以最高能层符号为N;N层有s、p、d、f 4个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,f能级有7个轨道,所以共有轨道数:1+3+5+7=16。(7)G是Fe,H是Cu,Fe3+与Cu反应生成Fe2+与Cu2+,反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+。(8)E元素是Al,与Al元素成对角线关系的某元素的最高价氧化物的水化物具有两性,该元素为Be,其最高价氧化物的水化物为Be(OH)2,与NaOH反应的离子方程式:Be(OH)2+2OH-===BeO+2H2O。
20.【答案】(1)1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3) Ga、Ge、Se
(2)砷原子半径较大,原子间形成的σ键较长,pp轨道肩并肩重叠程度较小或几乎不能重叠,难以形成π键
(3)砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小
(4)四面体形 sp3
(5)
【解析】(1)砷原子核电荷数为33,基态原子的电子排布式为[Ar]3d104s24p3;同一周期,从左到右,第一电离能呈现增大的趋势,第ⅤA族元素p为半充满状态,第一电离能大于邻近元素的第一电离能;因此第四周期元素中,第一电离能低于砷原子的p区元素有Ga、Ge、Se。(2)由于砷原子半径较大,原子间形成的σ键较长,pp轨道肩并肩重叠程度较小或几乎不能重叠,难以形成π键,所以氮原子间能形成氮氮三键,而砷原子间不易形成三键。(3)AsH3分子键角较小的原因是砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小。(4)亚砷酸(H3AsO3)分子结构式为,砷原子的价层电子对数为4,属于sp3杂化,中心原子砷的VSEPR模型是四面体形。(5)根据砷化镍的晶胞可知:含有的镍原子个数为8×+4×=2,含有砷原子个数为2,所以该晶胞中含有2个砷化镍,该晶胞的质量为2×g,根据晶胞的俯视图可以求出x=a pm=×360.2×10-10cm;该晶胞的体积为×360.2×10-10×360.2×10-10×500.9×10-10 cm3;ρ==g·cm-3。
相关试卷
(通用版)高考化学一轮复习单元训练卷第一单元化学实验基本方法B卷(含解析):
这是一份(通用版)高考化学一轮复习单元训练卷第一单元化学实验基本方法B卷(含解析),共7页。试卷主要包含了选择题的作答,非选择题的作答,下列实验中,所选装置不合理的是,下列操作及其描述错误的是等内容,欢迎下载使用。
(通用版)高考化学一轮复习单元训练卷第十八单元物质结构及性质A卷(含解析):
这是一份(通用版)高考化学一轮复习单元训练卷第十八单元物质结构及性质A卷(含解析),共8页。试卷主要包含了选择题的作答,非选择题的作答,下列说法不正确的是,下列说法正确的是等内容,欢迎下载使用。
(通用版)高考化学一轮复习单元训练卷第二单元化学计量在实验中的应用B卷(含解析):
这是一份(通用版)高考化学一轮复习单元训练卷第二单元化学计量在实验中的应用B卷(含解析),共7页。试卷主要包含了选择题的作答,非选择题的作答,下列说法正确的是,下列有关溶液配制的说法正确的是,下列说法中,正确的是等内容,欢迎下载使用。








