新教材2023高中化学第三章水溶液中的离子反应与平衡素养提升课酸碱中和滴定图像同步测试新人教版选择性必修1
展开素养提升课 酸碱中和滴定图像
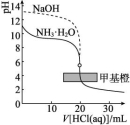
1.图示强酸与强碱滴定过程中的pH曲线
用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L盐酸,滴定过程中的pH曲线如图:
⇒
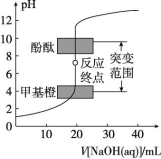
2.强酸(碱)滴定弱碱(酸)pH曲线的比较
氢氧化钠溶液滴定等浓度等体积的盐酸、醋酸的滴定曲线 | 盐酸滴定等浓度等体积的氢氧化钠溶液、氨水的滴定曲线 |
|
|
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高 | |
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)的突跃点变化范围 | |
![]() 典例精析
典例精析
【例】25 ℃时,向10 mL 0.10 mol/L的一元弱酸HA溶液(Ka=1.0×10-3)中逐滴加入0.10 mol/L NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法中正确的是 ( )
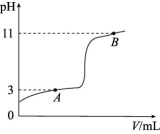
A.A点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在A点和B点时水的电离程度相同
C.B点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D.V=10 mL 时,c(Na+)>c(A-)>c(H+)>c(HA)
解析:A点时,pH=3, c(H+) = 10-3 mol/L,因为Ka=1.0×10-3,所以c(HA)=
c(A-),根据电荷守恒c(A-)+c(OH-)=c(Na+)+c(H+)和c(HA)=c(A-),A项正确。A点溶质为HA和NaA,pH=3,水电离出的c(OH-)=10-11 mol/L;
B点溶质为NaOH和NaA,pH=11,c(OH-)=10-3mol/L,OH-是由 NaOH电离和水电离两部分之和组成的,推断出由水电离出的c(OH-)<
10-3 mol/L,那么水电离的c(H+)>10-11 mol/L,B项错误。根据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),可得c(Na+)=c(A-)+c(OH-)-c(H+),假设C选项成立,则c(A-)+c(OH-)-c(H+)=c(HA)+c(A-)+c(OH-),推出c(HA)+
c(H+)=0,故假设不成立,C项错误。V=10 mL 时,HA与NaOH恰好完全反应生成NaA,A-+H2O![]() HA+OH-,水解后溶液显碱性,c(OH-)>c(H+),即c(HA)>c(H+) ,D项错误。
HA+OH-,水解后溶液显碱性,c(OH-)>c(H+),即c(HA)>c(H+) ,D项错误。
答案:A
解题模板
抓五点破中和滴定图像
反应的“起始”点 | 判断酸、碱的相对强弱 |
反应的“一半”点 | 判断是哪种溶质的等量混合 |
溶液的“中性”点 | 判断溶液中溶质的成分及哪种物质过量或不足 |
“恰好”反应点 | 判断生成的溶质成分及溶液的酸碱性 |
反应的“过量”点 | 判断溶液中的溶质,判断哪种物质过量 |
![]() 活学活用
活学活用
1.以酚酞为指示剂,用0.100 0 mol/L的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积V[NaOH(aq)]的变化关系如图所示。![]() 例如A2-的分布系数:
例如A2-的分布系数:
δ(A2-)=![]()
![]()
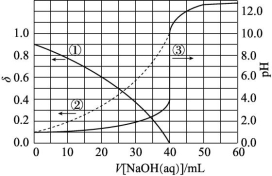
下列叙述中正确的是 ( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol/L
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
解析:曲线①代表δ(HA-),曲线②代表δ(A2-),A项错误;当加入40 mL NaOH溶液时,溶液的pH发生突变,说明恰好完全反应,根据反应2NaOH+H2A![]() Na2A+2H2O,c(H2A)=
Na2A+2H2O,c(H2A)=![]() =0.100 0 mol/L,B项错误;由于H2A第一步完全电离,则HA-的起始浓度为0.100 0 mol/L,根据图像,当V[NaOH(aq)]=0时,HA-的分布系数为0.9,溶液的pH=1,
=0.100 0 mol/L,B项错误;由于H2A第一步完全电离,则HA-的起始浓度为0.100 0 mol/L,根据图像,当V[NaOH(aq)]=0时,HA-的分布系数为0.9,溶液的pH=1,
A2-的分布系数为0.1,则HA-的电离平衡常数Ka=![]() =
=
![]() ≈1×10-2,C项正确;用酚酞作指示剂,酚酞变色的pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),D项错误。
≈1×10-2,C项正确;用酚酞作指示剂,酚酞变色的pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),D项错误。
答案:C
2.(2021·广东茂名高州一中高二期末)常温下,向100 mL 0.01 mol/L HA溶液中逐滴加入0.02 mol/L的MOH溶液,混合溶液的pH随所加MOH溶液体积的变化曲线如图所示(溶液体积的变化忽略不计)。下列说法中正确的是 ( )
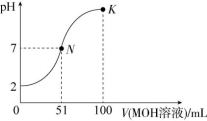
A.MOH为一元强碱
B.K点对应的溶液中:c(M+)+c(MOH)=2c(A-)
C.K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol/L
D.N点水的电离程度小于K点水的电离程度
解析:根据图知,0.01 mol/L的HA溶液的pH=2,说明HA溶液中c(H+)=c(HA),则HA是一元强酸,N点溶液呈中性,N点溶液MOH过量,则N点溶质为MA和MOH,所以MOH为一元弱碱,故A项错误;K点溶液中溶质为等物质的量浓度的MOH、MA,溶液中存在元素质量守恒、电荷守恒,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),根据元素质量守恒得c(M+)+c(MOH)=2c(A-),所以得c(M+)+2c(H+)=2c(OH-)+
c(MOH),c(MOH)+c(OH-)-c(H+)=c(M+)+c(H+)-c(OH-)<0.01 mol/L,故B项正确,C项错误;酸或碱抑制水的电离,弱离子促进水的电离,碱浓度N点小于K点,所以水的电离程度N点大于K点,故D错误。
答案:B
3.用0.100 0 mol/L的标准盐酸分别滴定20.00 mL 0.100 0 mol/L氨水和20.00 mL 0.100 0 mol/L氢氧化钠溶液的滴定曲线如图所示,横坐标为滴定百分数![]() ,纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4~6.2,下列有关滴定过程的说法中正确的是 ( )
,纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4~6.2,下列有关滴定过程的说法中正确的是 ( )
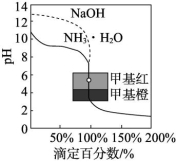
- 滴定氨水,当滴定百分数为50%时,各离子浓度间存在关系:
c(N![]() )+c(H+)=c(OH-)
)+c(H+)=c(OH-)
B.滴定百分数为100%时,即为滴定过程中恰好完全反应的时刻
C.从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳
D.滴定氨水,当滴定百分数为150%时,所得溶液中离子浓度大小关系为c(Cl-)>c(H+)>c(N![]() )>c(OH-)
)>c(OH-)
解析:溶液中存在电荷守恒,c(N![]() )+c(H+)=c(OH-)+c(Cl-),故A项错误;滴定百分数为100%时,酸与碱的物质的量相等,即为滴定过程中恰好完全反应的时刻,故B项正确;从滴定曲线看甲基红变色范围更接近于滴定终点,使用甲基橙显示偏晚,故C项错误;滴定百分数为150%时,即加入盐酸30.00 mL,此时溶质是NH4Cl和HCl,物质的量之比为2∶1,故c(N
)+c(H+)=c(OH-)+c(Cl-),故A项错误;滴定百分数为100%时,酸与碱的物质的量相等,即为滴定过程中恰好完全反应的时刻,故B项正确;从滴定曲线看甲基红变色范围更接近于滴定终点,使用甲基橙显示偏晚,故C项错误;滴定百分数为150%时,即加入盐酸30.00 mL,此时溶质是NH4Cl和HCl,物质的量之比为2∶1,故c(N![]() )>c(H+),故D项错误。
)>c(H+),故D项错误。
答案:B
4.25 ℃时,用2a mol/L NaOH溶液滴定 1.0 L 2a mol/L 氢氟酸,得到混合液中HF、F-的物质的量与溶液pH的变化如图所示。下列说法中正确的是 ( )
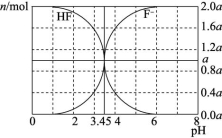
A.pH=3时,溶液中:c(Na+)<c(F-)
B.c(F-)>c(HF)时,溶液一定呈碱性
C.pH=3.45时,NaOH溶液恰好与HF完全反应
D.pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)>2a mol/L
解析:pH=3时,c(H+)>c(OH-),由电荷守恒得c(H+)+c(Na+)=c(F-)+c(OH-),则c(Na+)<c(F-),A项正确;由题图知当3.45<pH<6时即溶液呈酸性时,
c(F-)>c(HF),B项错误;NaOH溶液恰好与HF完全反应时得到的溶液为NaF溶液,溶液显碱性,C项错误;由电荷守恒得c(H+)+c(Na+)=c(F-)+
c(OH-),则c(H+)+c(Na+)-c(OH-)+c(HF)=c(F-)+c(HF),已知n(F-)+n(HF)=
2a mol,溶液的体积大于1.0 L,故c(F-)+c(HF)<2a mol/L,D项错误。
答案:A
5.常温下,向浓度为0.1 mol/L、体积为V L的氨水中逐滴加入浓度为
0.1 mol/L的盐酸,用pH计测得的溶液pH随盐酸的加入量而降低的滴
定曲线如图所示,D点时两种溶液恰好完全反应。根据图中信息回答下列问题。
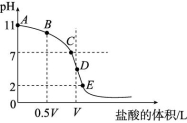
(1)该温度时NH3·H2O的电离平衡常数K= 。
(2)比较B、C、D三点时的溶液中,由水电离出的c(OH-)大小顺序为 。
(3)滴定时,由B点到C点的过程中,下列各选项中数值保持不变的是
(填字母,下空同)。
A.c(H+)·c(OH-) B.![]() C.
C.![]() D.
D.![]()
(4)根据以上滴定曲线判断下列说法中正确的是 (溶液中N元素只存在N![]() 和NH3·H2O两种形式)。
和NH3·H2O两种形式)。
A.点B所示溶液中:c(N![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点C所示溶液中:c(Cl-)=c(NH3·H2O)+c(N![]() )
)
C.点D所示溶液中:c(Cl-)>c(H+)>c(N![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(N![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定至D点之后若继续加入盐酸至图像中的E点(此时不考虑N![]() 水解的影响),则E点对应的横坐标为 。
水解的影响),则E点对应的横坐标为 。
解析:(5)设E点加入盐酸的体积为x L,则剩余盐酸中HCl的物质的量为n余(HCl)=0.1 mol/L×x L-0.1 mol/L×V L=0.1×(x-V) mol,此时溶液的pH=2,则有0.1×(x-V)mol=10-2 mol/L×(x+V) L,解得x=![]() 。
。
答案:(1)10-5 (2)D>C>B (3)ACD (4)D (5)![]()