




还剩21页未读,
继续阅读
人教版(2019)高中化学必修一第三章《溶液中的离子反应与平衡》单元解读课件
展开
这是一份人教版(2019)高中化学必修一第三章《溶液中的离子反应与平衡》单元解读课件,共29页。
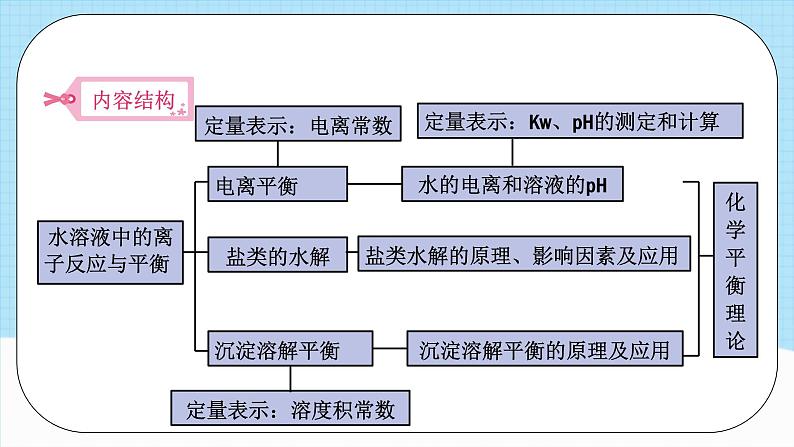
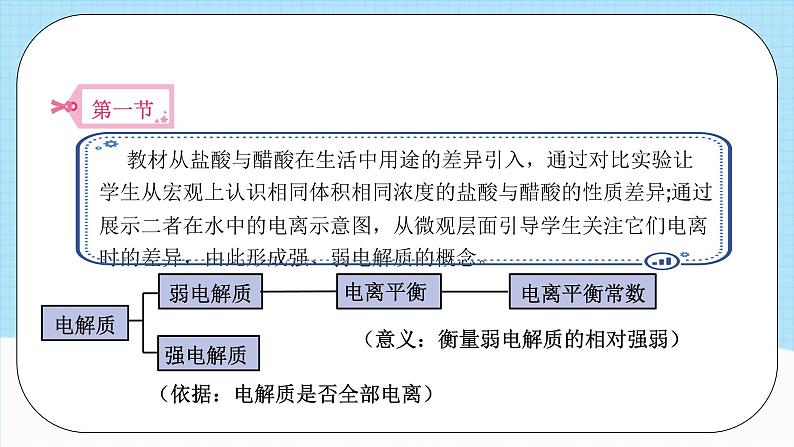
第三章单元解读模块三 教学策略、学生活动 模块一 课标要求、教材解读 从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。课标要求认识盐类水解的原理和影响盐类水解的主要因素。认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。 了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。了解溶液pH的调控在工农业生产和科学研究中的应用。第三章 水溶液中的离子反应与平衡 本章内容实际上是应用前一章所学的化学平衡理论,探讨水溶液中离子间的相互作用,理论与实践兼而有之:电离平衡、水解平衡、沉淀溶解平衡的过程分析,体现了化学平衡理论的指导作用;pH的应用、盐类水解反应的应用、沉淀溶解平衡的应用等,体现了理论知识在生产、生活中的应用价值;酸碱中和滴定的介绍及相应的实验活动则是在培养学生的实验操作技能。从教学功能看,这一章是前一章所学知识的延伸、拓展和巩固。教材解读 水溶液中的离子反应与平衡电离平衡盐类的水解沉淀溶解平衡水的电离和溶液的pH盐类水解的原理、影响因素及应用沉淀溶解平衡的原理及应用定量表示:电离常数定量表示:溶度积常数化学平衡理论定量表示:Kw、pH的测定和计算弱电解质电解质强电解质电离平衡 (依据:电解质是否全部电离)(意义:衡量弱电解质的相对强弱)电离平衡常数水的电离纯水c(H+)=c(OH-)稀的电解质水溶液水的离子积常数Kwc(H+)=c(OH-)中性c(H+)≠c(OH-)酸性或碱性pH(表示溶液的酸碱性) 中和滴定(酸或碱浓度的测定)盐类的水解盐类水解的原理影响盐类水解的主要因素盐类水解的应用沉淀溶解平衡沉淀溶解平衡的原理沉淀溶解平衡的应用沉淀的生成沉淀的溶解沉淀的转化 模块二 教学目标、教学重难点 教学目标模块三 教学策略、学生活动第一节 电离平衡1.利用“POE”(预测、观察、解释)教学策略,自主建构强、弱电解质的概念环节三、利用“POE”教学策略灵活运用概念。环节一、从分类的角度得出概念。环节二、初步运用概念解决简单问题。2.从化学平衡出发学习电离平衡(1)建构电离平衡(2)认识电离平衡的移动教学策略第二节 水的电离和溶液的pH1.运用弱电解质电离模型分析水的电离 水是弱电解质。教学中可以结合CH3COOH的电离,对水的电离进行讨论。可围绕几组问题展开教学。2.利用学生的认知冲突,重新建构溶液酸碱性与pH的关系 学生已经习惯用比较pH与7大小的方法判断溶液的酸碱性,教师可以利用这一点设置教学情境,使学生产生认知冲突,并重新建构溶液的酸碱性与pH的关系。第二节 水的电离和溶液的pH3.理解滴定本质,重视滴定实验操作 酸碱中和滴定实验是中学化学中为数不多的定量实验,教学中如果简单处理为给出实验步骤,让学生练习滴定实验操作,就会成为以锻炼实验技能为主的课堂教学。酸碱中和滴定实验是其他滴定实验的基础,教学中要以滴定目的为出发点,紧紧围绕准确测定溶液中溶质的浓度这一根本任务,在实验前引导学生围绕滴定的原理、如何找到滴定终点、指示剂的作用、可能产生误差的实验操作等问题进行思考。第三节 盐类的水解 1.宏观与微观相结合,探究盐溶液呈现不同酸碱性的原因教学中可以 直接通过“探究”栏目人入手,让学生用pH计(或pH传感器)测定并记录不同排溶液的pH,再对盐的类型进行分析,结合实验结果, 归纳出盐溶液的酸碱性与盐的类型之间的关系2.通过实验探究影响盐类水解的因素研究盐类的水解应该从内因与外因两个角度入手。第三节 盐类的水解 3.利用盐类水解的原理解决实际问题(1)热的纯碱溶液去除油污的原理;(2)氯化铵溶液可以除铁锈的原理;(3)配制氯化铁溶液时,要先将氯化铁晶体溶解在浓盐酸中的原因;(4)制备氢氧化铁胶体的原理;(5)明矾作为净水剂的原理;(6)草木灰不能与铵态氦肥混合使用的原因;(7)干灼烧氧化钳溶液,最终得到氧化铝的原因;(8)制备无水氧化镁时,要在氧化氢气流中加热氧化镁晶体(MgCl2·6H2O)的原因。第四节 沉淀溶解平衡1.运用可溶电解质的溶解平衡建构难溶电解质的沉淀溶解平衡2.运用化学平衡移动原理理解沉淀的生成、溶解及转化(1)沉淀的生成和溶解(2)沉淀的转化活动一:取少量Mg于试管中,向其中加入少量的蒸馏水并加热,冷却后向其中滴加酚酞溶液,可观察到溶液变红。活动二:利用教材中的表3-3,计算20℃时,AgCl、AgS饱和溶液中溶质的物质的量浓度(溶液的密度近似看作1g/cm3)。 强酸与强碱的中和滴定活动建议学生活动课时建议课程结束
第三章单元解读模块三 教学策略、学生活动 模块一 课标要求、教材解读 从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。课标要求认识盐类水解的原理和影响盐类水解的主要因素。认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。 了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。了解溶液pH的调控在工农业生产和科学研究中的应用。第三章 水溶液中的离子反应与平衡 本章内容实际上是应用前一章所学的化学平衡理论,探讨水溶液中离子间的相互作用,理论与实践兼而有之:电离平衡、水解平衡、沉淀溶解平衡的过程分析,体现了化学平衡理论的指导作用;pH的应用、盐类水解反应的应用、沉淀溶解平衡的应用等,体现了理论知识在生产、生活中的应用价值;酸碱中和滴定的介绍及相应的实验活动则是在培养学生的实验操作技能。从教学功能看,这一章是前一章所学知识的延伸、拓展和巩固。教材解读 水溶液中的离子反应与平衡电离平衡盐类的水解沉淀溶解平衡水的电离和溶液的pH盐类水解的原理、影响因素及应用沉淀溶解平衡的原理及应用定量表示:电离常数定量表示:溶度积常数化学平衡理论定量表示:Kw、pH的测定和计算弱电解质电解质强电解质电离平衡 (依据:电解质是否全部电离)(意义:衡量弱电解质的相对强弱)电离平衡常数水的电离纯水c(H+)=c(OH-)稀的电解质水溶液水的离子积常数Kwc(H+)=c(OH-)中性c(H+)≠c(OH-)酸性或碱性pH(表示溶液的酸碱性) 中和滴定(酸或碱浓度的测定)盐类的水解盐类水解的原理影响盐类水解的主要因素盐类水解的应用沉淀溶解平衡沉淀溶解平衡的原理沉淀溶解平衡的应用沉淀的生成沉淀的溶解沉淀的转化 模块二 教学目标、教学重难点 教学目标模块三 教学策略、学生活动第一节 电离平衡1.利用“POE”(预测、观察、解释)教学策略,自主建构强、弱电解质的概念环节三、利用“POE”教学策略灵活运用概念。环节一、从分类的角度得出概念。环节二、初步运用概念解决简单问题。2.从化学平衡出发学习电离平衡(1)建构电离平衡(2)认识电离平衡的移动教学策略第二节 水的电离和溶液的pH1.运用弱电解质电离模型分析水的电离 水是弱电解质。教学中可以结合CH3COOH的电离,对水的电离进行讨论。可围绕几组问题展开教学。2.利用学生的认知冲突,重新建构溶液酸碱性与pH的关系 学生已经习惯用比较pH与7大小的方法判断溶液的酸碱性,教师可以利用这一点设置教学情境,使学生产生认知冲突,并重新建构溶液的酸碱性与pH的关系。第二节 水的电离和溶液的pH3.理解滴定本质,重视滴定实验操作 酸碱中和滴定实验是中学化学中为数不多的定量实验,教学中如果简单处理为给出实验步骤,让学生练习滴定实验操作,就会成为以锻炼实验技能为主的课堂教学。酸碱中和滴定实验是其他滴定实验的基础,教学中要以滴定目的为出发点,紧紧围绕准确测定溶液中溶质的浓度这一根本任务,在实验前引导学生围绕滴定的原理、如何找到滴定终点、指示剂的作用、可能产生误差的实验操作等问题进行思考。第三节 盐类的水解 1.宏观与微观相结合,探究盐溶液呈现不同酸碱性的原因教学中可以 直接通过“探究”栏目人入手,让学生用pH计(或pH传感器)测定并记录不同排溶液的pH,再对盐的类型进行分析,结合实验结果, 归纳出盐溶液的酸碱性与盐的类型之间的关系2.通过实验探究影响盐类水解的因素研究盐类的水解应该从内因与外因两个角度入手。第三节 盐类的水解 3.利用盐类水解的原理解决实际问题(1)热的纯碱溶液去除油污的原理;(2)氯化铵溶液可以除铁锈的原理;(3)配制氯化铁溶液时,要先将氯化铁晶体溶解在浓盐酸中的原因;(4)制备氢氧化铁胶体的原理;(5)明矾作为净水剂的原理;(6)草木灰不能与铵态氦肥混合使用的原因;(7)干灼烧氧化钳溶液,最终得到氧化铝的原因;(8)制备无水氧化镁时,要在氧化氢气流中加热氧化镁晶体(MgCl2·6H2O)的原因。第四节 沉淀溶解平衡1.运用可溶电解质的溶解平衡建构难溶电解质的沉淀溶解平衡2.运用化学平衡移动原理理解沉淀的生成、溶解及转化(1)沉淀的生成和溶解(2)沉淀的转化活动一:取少量Mg于试管中,向其中加入少量的蒸馏水并加热,冷却后向其中滴加酚酞溶液,可观察到溶液变红。活动二:利用教材中的表3-3,计算20℃时,AgCl、AgS饱和溶液中溶质的物质的量浓度(溶液的密度近似看作1g/cm3)。 强酸与强碱的中和滴定活动建议学生活动课时建议课程结束
相关资料
更多









