


新教材2023高中化学第四章化学反应与电能章末整合提升新人教版选择性必修1 试卷
展开第四章 化学反应与电能
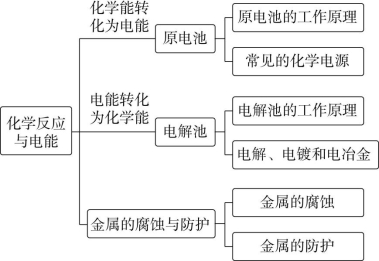
章末整合提升
![]()
![]()
专题1 二次电池
1.二次电池的思维模型
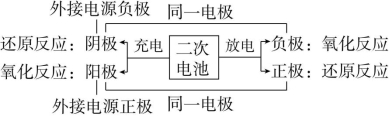
因此,充电时电极的连接可简记为“负接负后作阴极,正接正后作阳极”。
2.二次电池的分析流程
(1)二次电池有充电和放电两个过程,放电时是原电池反应,充电时是电解池反应。
(2)放电时的负极反应和充电时的阴极反应互为逆反应,放电时的正极反应和充电时的阳极反应互为逆反应。将负(正)极反应式变换方向并
将电子移项即可得出阴(阳)极反应式。
(3)充电、放电时电解质溶液中离子移动方向的判断。
分析电池工作过程中电解质溶液的变化时,要结合电池总反应进行分析。
①首先应分清电池是放电还是充电。
②再判断出正极、负极或阴极、阳极。
放电 | 阳离子 |
充电 | 阳离子 |
总之:阳离子 | |
(4)“加减法”书写新型二次电池放电的电极反应式。
若已知电池放电时的总反应式,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,由总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
【例1】某电动汽车配载一种可充放电的锂离子电池,电池总反应为L![]() CoO2+LixC6
CoO2+LixC6![]() LiCoO2+C6(x<1)。下列关于该电池的说法中不正确的是 ( )
LiCoO2+C6(x<1)。下列关于该电池的说法中不正确的是 ( )
A.放电时,Li+在电解质溶液中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-![]() xLi++C6
xLi++C6
C.充电时,若转移1 mol e-,石墨(C6)电极质量将增加7x g
D.充电时,阳极的电极反应式为LiCoO2-xe-![]() L
L![]() CoO2+xLi+
CoO2+xLi+
【思维提示】放电时为原电池原理,充电时为电解池原理。 A项,原电池中阳离子由负极向正极迁移,正确;B项,放电时,负极发生氧化反应,电极反应式为LixC6-xe-![]() xLi++C6,正确;C项错误;D项,充电时,阳极发生氧化反应,电极反应式为LiCoO2-xe-
xLi++C6,正确;C项错误;D项,充电时,阳极发生氧化反应,电极反应式为LiCoO2-xe-![]() L
L![]() CoO2+xLi+,正确。
CoO2+xLi+,正确。
答案:C
专题2 串联电池
1.有外接电源电池类型的判断方法
有外接电源的各电池均为电解池,若电解质溶液中含有与阳极材料相同的金属阳离子,则该电池为电镀池。如图所示,甲为电镀池,乙、丙均为电解池。
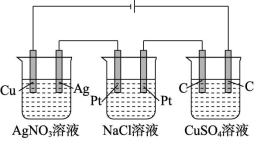
甲 乙 丙
2.无外接电源电池类型的判断方法
(1)直接判断。
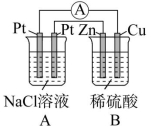
若有非常直观明显的装置,如燃料电池、铅酸蓄电池等在电路中,则其他装置为电解池。如图所示,A为原电池,B为电解池。
(2)根据电池中的电极材料和电解质溶液判断。
原电池一般是两种活泼性不同的金属或一种金属和一种导电非金属作电极;而电解池则一般都是两个惰性电极,如两个铂电极或两个石墨棒。原电池中的电极材料与电解质溶液之间能发生自发的氧化还原反应,电解池的电极材料一般不能与电解质溶液自发反应。如图所示,B为原电池,A为电解池。
(3)根据电极反应现象判断。
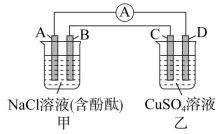
在某些装置中根据电极反应或反应现象可判断电极,并由此判断电池类型。如图所示,若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池,D是正极,C是负极;甲是电解池,A是阳极,B是阴极。B极、D极发生还原反应,A极、C极发生氧化反应。
【例2】如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近溶液呈红色。
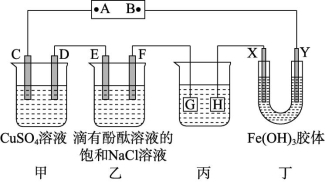
请回答:
(1)B极是电源的 极,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙中溶液体积为500 mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”“变小”或“不变”)。
(4)若将C电极换为银,其他装置都不变,则甲中初始发生总反应的离子方程式是 。
(5)若开始时把电源去掉换成导线,C电极换为Zn,则甲装置为 (填“原电池”“电解池”或“电镀池”,下空同),乙装置为 。
【思维提示】首先要根据F电极附近的现象,判断出电源的正极、负极,然后依次判断。
(1)F极附近溶液呈红色,说明F极是阴极,E极是阳极,则电源A极为正极,B极为负极。甲中因Cu2+放电使溶液颜色变浅。丁中Y极附近颜色变深,说明Fe(OH)3胶体粒子向阴极移动,即Fe(OH)3胶体粒子带正电荷。(2)C、D、E、F的电极反应生成的单质分别为O2、Cu、Cl2、H2,由于电路中通过的电量相等,所以其物质的量之比为1∶2∶2∶2。(3)乙中溶液pH=13,生成n(NaOH)=0.1 mol/L×0.5 L=0.05 mol,电路中通过电子的物质的量为0.05 mol,所以丙中镀件上析出银的质量为0.05 mol×108 g/mol=
5.4 g。(4)当金属作阳极时,金属先于溶液中的阴离子放电而溶解,故甲中发生反应的离子方程式为2Ag+Cu2+![]() 2Ag++Cu。(5)把电源去掉换成导线,C电极换为Zn时,甲装置为原电池,乙装置为电解池。
2Ag++Cu。(5)把电源去掉换成导线,C电极换为Zn时,甲装置为原电池,乙装置为电解池。
答案:(1)负 逐渐变浅 氢氧化铁胶体粒子带正电荷 (2)1∶2∶2∶2 (3)镀件 AgNO3 5.4 g 变小 (4)2Ag+Cu2+![]() 2Ag++Cu (5)原电池 电解池
2Ag++Cu (5)原电池 电解池
专题3 有关电化学的计算
1.原电池和电解池的计算常涉及的问题
(1)两极产物的定量计算。
(2)溶液pH的计算。
(3)相对原子质量的计算和阿伏加德罗常数的值的测定。
(4)根据转移电子的量求产物的量或根据产物的量求转移电子的量。
2.常用的三种方法
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等。
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
(3)根据关系式计算:借助得失电子守恒的关系建立已知量与未知量之间的桥梁,列出计算所需的关系式。如串联电路中各电极得失电子数相等,即电路中通过的电量(电子总数)相等。通常存在下列物质的量关系:H2~Cl2~![]() O2~Cu~2Ag~2H+~2OH-。
O2~Cu~2Ag~2H+~2OH-。
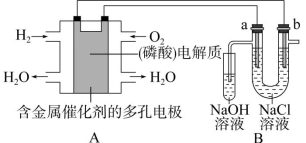
【例3】甲烷作为一种新能源在化学领域应用广泛,如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
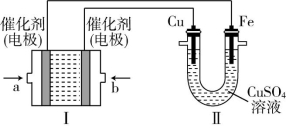
请回答下列问题:
(1)a处应通入 (填“CH4”或“O2”),b处电极上发生的电极反应式是 。
(2)电镀结束后,装置Ⅰ中溶液的pH (填“增大”“减小”或“不变”,下空同),装置Ⅱ中Cu2+的物质的量浓度 。
(3)电镀结束后,装置Ⅰ溶液中的阴离子除了OH-外还含有 (忽略水解)。
(4)在此过程中若完全反应,装置 Ⅱ 中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
【思维提示】(1)装置 Ⅱ 要实现铁棒上镀铜,则Cu作阳极,Fe作阴极,则装置 Ⅰ 中a处电极为负极,b处电极为正极,负极上通入燃料,正极上通入氧化剂,所以a处通入的气体是CH4,电极反应式为CH4+10OH--8e-![]() C
C![]() +7H2O,b处通入O2,电极反应式为O2+2H2O+4e-
+7H2O,b处通入O2,电极反应式为O2+2H2O+4e-![]() 4OH-。(2)根据装置Ⅰ中电池总反应CH4+2O2+2KOH
4OH-。(2)根据装置Ⅰ中电池总反应CH4+2O2+2KOH![]() K2CO3 +3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;装置 Ⅱ 中发生电镀,阳极上溶解铜的质量等于阴极上析出铜的质量,则溶液中Cu2+的物质的量浓度不变。(3)装置 Ⅰ 溶液中的阴离子除了OH-外还含有C
K2CO3 +3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;装置 Ⅱ 中发生电镀,阳极上溶解铜的质量等于阴极上析出铜的质量,则溶液中Cu2+的物质的量浓度不变。(3)装置 Ⅰ 溶液中的阴离子除了OH-外还含有C![]() 。(4)装置 Ⅱ 中阴极质量变化12.8 g,n(Cu)=0.2 mol,则转移0.4 mol电子,串联电路中转移电子数相等,由CH4+10OH--8e-
。(4)装置 Ⅱ 中阴极质量变化12.8 g,n(Cu)=0.2 mol,则转移0.4 mol电子,串联电路中转移电子数相等,由CH4+10OH--8e-![]() C
C![]() +7H2O,可知消耗0.4 mol
+7H2O,可知消耗0.4 mol
×![]() =0.05 mol 甲烷,标准状况下体积为 0.05 mol×22.4 L/mol=1.12 L。
=0.05 mol 甲烷,标准状况下体积为 0.05 mol×22.4 L/mol=1.12 L。
答案:(1)CH4 O2+2H2O+4e-![]() 4OH- (2)减小 不变 (3)C
4OH- (2)减小 不变 (3)C![]() (4)1.12
(4)1.12










