






高中化学鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率第1节 化学反应的方向试讲课ppt课件
展开1、了解反应焓变与反应方向有关,但不是唯一的影响因素。2、知道化学反应存在熵变,了解反应熵变与反应方向有关,但也不是唯一的影响因素。3、了解焓变与熵变对反应方向的共同影响,并能通过关系式:△H-T△S由给定的数据定量判断反应的方向。4、通过关系式能够根据反应焓变的吸热或放热、反应熵变的熵增或熵减来定性分析反应焓变和反应熵变对反应方向的影响。
我们生活中越来越多的汽车带来的大气污染,有人设想让CO与NO反应产生两种无毒的气体,其中一种是空气的主要成分之一,写出此反应的化学方程式
2CO+2NO=2CO2+N2
自然界中有许多自然而然发生的现象,那么是否所有的化学反应都能够自发进行呢?
1、自发过程 在温度和压强一定的条件下,不借助光、电等外部力量就能自动进行的过程。
【探究】 探究以下自发过程中有哪些共同的变化趋势(1)自然界中水总是从高处往低处流;(2)电流总是从电位高的地方向电位低的地方流动;(3)水蒸气冷凝成水
共同点:高能向低能转化
下列自发进行的反应,有什么共同点?
2H2(g)+O2(g)= 2H2O(l) △H=-572kJ/mlH2(g)+Cl2(g)=2HCl(g) △H=-184kJ/ml2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) △H=-368kJ/ml2Fe(s)+3/2O2(g)= Fe2O3(s) △H=-824kJ/mlNaOH(aq)+HCl(aq)=NaCl(aq)+ H2O(l) △H=-56kJ/ml
共同点: △H<0 焓减小 放热反应
焓减小有利于反应自发进行
思考:很多放热反应有自发进行的倾向, 是不是吸热反应就不能自发进行呢?
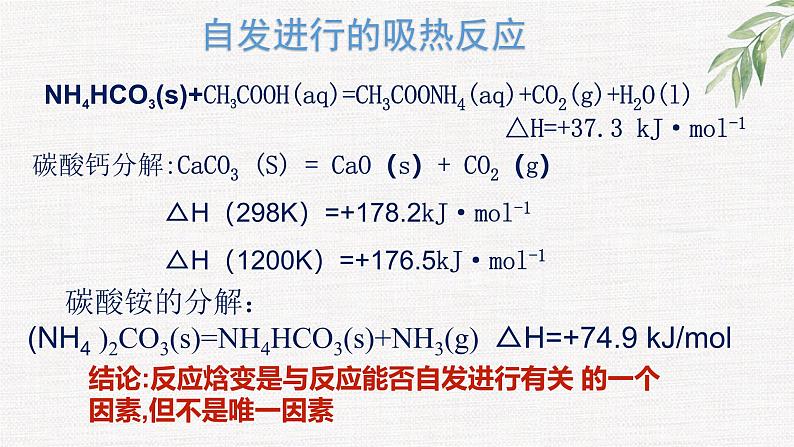
有些自发反应却是吸热的,如:氯化铵与氢氧化钡的反应。
碳酸铵的分解:(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9 kJ/ml
结论:反应焓变是与反应能否自发进行有关 的一个因素,但不是唯一因素
NH4HCO3(s)+CH3COOH(aq)=CH3COONH4(aq)+CO2(g)+H2O(l) △H=+37.3 kJ·ml-1
碳酸钙分解:CaCO3 (S) = CaO(s)+ CO2(g) △H(298K)=+178.2kJ·ml-1 △H(1200K)=+176.5kJ·ml-1
气态物质能通过分子的扩散自发地形成均匀的混合物。
火柴散落有趋向于最大混乱度的倾向
结论:密闭条件下,体系从有序→无序是自发的。与能量状态的高低无关
克劳修斯 (德国)
(1)熵:描述体系混乱度的物理量, 符号:S 单位:J·ml-1·K-1
体系有向混乱度增加(即熵增)的方向变化的倾向,这是自然界的规律。
(混乱度:微粒间无规则排列程度)
体系混乱度越大,熵值越大,即S值越大。
【结论】同一物质的熵值:气态>液态>固态
(1)同一种物质的熵值
69.9J·ml-1K-1
47.9J·ml-1K-1
188.7J·ml-1K-1
冰 水 水蒸气
与物质的分子结构有关
S(CH4) < S(C2H6) < S(C3H8) < S(C4H10)
物质熵值的特点
物质的组成越复杂其熵值越大
与物质的物质的量有关
物质的量越大,分子数越多,熵值越大。例如:2N2O5(g)=4NO2(g)+O2(g) ΔS>0
判断化学反应方向的依据 熵判据:S>0 的反应有自发进行的倾向.ΔS越大,越有利于反应的自发进行。
自发反应一定是熵增加的反应吗?
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △S=-39.4J•ml-1•K-1
熵变是反应能否自发进行一个因素, 但也不是唯一因素。
化学反应的最终判据到底是什么呢?
三、焓变与熵变对反应方向的共同影响
1.判据:△H-T△S △H-T△S < 0 反应正向自发 △H-T△S = 0 达平衡状态 △H-T△S > 0 反应正向不能自发
∆H>0 ∆S>0高温下反应自发进行
∆H<0 ∆S<0所有温度下反应不能自发进行
∆H<0 ∆S>0所有温度下反应自发进行
∆H<0 ∆S<0低温下反应自发进行
A、相同条件下,自发变化的逆过程是非自发过程; B、自发变化或非自发变化是在给定条件下而言的,C、减焓、增熵有利于反应的进行。
焓减小有利于反应自发,熵增大有利于反应自发
1 下列过程是非自发的是∶( )A、水由高处向低处流; B、天然气的燃烧;C、铁在潮湿空气中生锈; D、室温下水结成冰。2 碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法中正确的是∶( )A、其分解是因为生成了易挥发的气体,使体系的熵增大;B、其分解是因为外界给予了能量;C、其分解是吸热反应,据能量判据不能自发分解;D、碳酸盐都不稳定,都能自发分解。
3、下列说法正确的是∶( )A、凡是放热反应都是自发的,由于吸热反应都是非自发的;B、自发反应一定是熵增大,非自发反应一定是熵减少或不变;C、自发反应在恰当条件下才能实现;D、自发反应在任何条件下都能实现。
4、250C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g); △H=+56.76kJ/ml,自发进行的原因是∶( )A、是吸热反应; B、是放热反应;C、是熵减少的反应;D、熵增大效应大于能量效应。
5、下列说法不正确的是( )A. 焓变是一个与反应能否自发进行有关的因素,多数的能自发进行的反应都是放热反应。B. 在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大。C. 一个反应能否自发进行取决于该反应放热还是吸热D. 一个反应能否自发进行,与焓变和熵变的共同影响有关
化学选择性必修1化学反应的方向精品ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4036427_t3/?tag_id=26" target="_blank">化学反应的方向精品ppt课件</a>,文件包含21化学反应的方向同步课件pptx、21化学反应的方向分层练习原卷版docx、21化学反应的方向分层练习解析版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向课文ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002580_t3/?tag_id=26" target="_blank">第1节 化学反应的方向课文ppt课件</a>,共23页。PPT课件主要包含了理解应用,练一练等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向教课内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向教课内容课件ppt,共28页。PPT课件主要包含了目录索引,必备知识,自我检测等内容,欢迎下载使用。













