



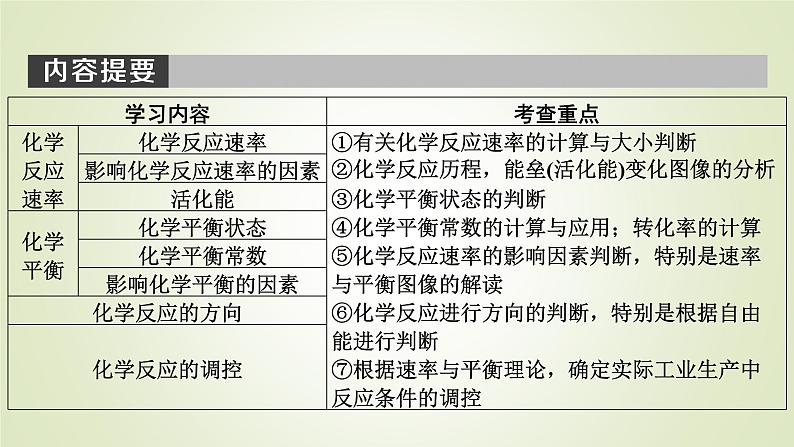

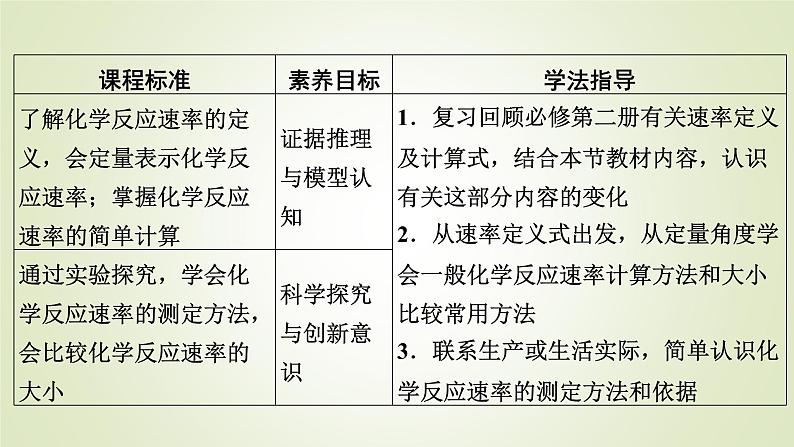

化学选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教学ppt课件
展开①了解化学反应速率的概念,会定量表示化学反应速率。②掌握化学反应速率的简单计算,学会化学反应速率的测定方法,会比较化学反应速率的快慢。③了解活化能的含义,会用活化能理论解释化学反应速率的影响因素。④掌握外界条件(浓度、压强、温度、催化剂)对化学反应速率的影响规律及实质,并会用相应规律解决有关问题。
⑤通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判断化学平衡状态的标志。⑥认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义。了解浓度商和化学平衡常数的相对大小与反应方向间的联系。⑦通过实验探究,了解温度、浓度、压强和催化剂对化学平衡状态的影响。学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向。
⑧了解自发过程和化学反应的自发性。知道化学反应是有方向的,知道化学反应的方向与反应的焓变和熵变有关。⑨认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用。知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义。
第1课时 化学反应速率
化学反应速率1.化学反应速率的含义
(1)式中v表示______________(取正值)。Δc表示______________________________;Δt表示________________。(2)反应速率的单位:__________或______________或____________等。
反应物浓度或生成物浓度的变化
ml·L-1·s-1
ml·L-1·min-1
ml·L-1·h-1
2.化学反应速率与化学计量数之间的关系
3.化学反应速率的测定(1)测定原理。任何一种与物质浓度有关的可观测量都可以加以利用。(2)可测定的具体物理量。气体的体积、__________、__________、光的吸收、________等。
【答案】一段时间内的平均速率。
正误判断。(对的画“√”,错的画“×”)(1)化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加。( )(2)对于任何化学反应来说,反应速率越大,反应现象就越明显。( )(3)化学反应速率为0.8 ml·L-1·s-1是指1 s时某物质的浓度为0.8 ml·L-1。( )
(5)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同。 ( )(6)根据反应速率的大小可以判断化学反应进行快慢。( )【答案】(1)× (2)× (3)× (4)× (5)√ (6)√
重难点一 化学反应速率的计算方法 1.化学反应速率的计算方法(2)利用速率之比=化学计量数之比=各物质浓度的变化量(Δc)之比=各物质物质的量的变化量(Δn)之比。
2.“三段式”法计算模板起始浓度/(ml·L-1) a b c计算中注意以下量的关系:①对反应物:c(起始)-c(转化)=c(某时刻)②对生成物:c(起始)+c(转化)=c(某时刻)
反应4A(s)+3B(g)===2C(g)+D(g),经2 min后,B的浓度减少了0.6 ml/L。下列反应速率的表示正确的是( )A.用A表示的反应速率是0.4 ml/(L·min)B.用B表示的反应速率是0.3 ml/(L·min)C.2 min末时的反应速率,用B表示为0.3 ml/(L·min)D.在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大【答案】 B
A.x=1B.B的转化率为20%C.平衡时A的浓度为1.50 ml/LD.B的平均反应速率为0.2 ml/(L·s)【答案】B
【解析】平衡时,n(D)=0.5 ml/L×4 L=2 ml。在相同时间内生成C和D的物质的量相等,因此x=2,A错误;列三段式:起始/ml:6 5 0 0转化/ml:3 1 2 2平衡/ml:3 4 2 2
重难点二 比较化学反应速率大小的方法 化学反应速率的比较对于同一化学反应,化学反应速率用不同物质表示的数值可能不同,但比较化学反应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方法如下:
(1)归一法:将不同物质的化学反应速率转化成同一物质的化学反应速率。(2)比值法:比较同一物质化学反应速率或化学反应速率除以化学计量数之后的数值。数值越大,化学反应速率越大。
A.v(A)=0.5 ml/(L·min)B.v(B)=1.2 ml/(L·s)C.v(D)=0.4 ml/(L·min)D.v(C)=0.1 ml/(L·s)【答案】D 【解析】本题可以采用归一法进行求解,将不同物质表示的反应速率折算成A表示的反应速率进行比较。B项中的B物质是固体,不能表示反应速率;C项中对应的v(A)=0.2 ml/(L·min);D项中对应的v(A)=3 ml/(L·min)。
①v(A)=0.15 ml·L-1·s-1 ②v(B)=0.6 ml·L-1·s-1③v(C)=0.4 ml·L-1·s-1 ④v(D)=0.45 ml·L-1·s-1该反应进行的快慢顺序为( )A.④>②=③>①B.④>②>③>①C.①>②=③>④D.①>②>③>④
【答案】A 【解析】将各项换算成用A表示的反应速率分别为①0.15 ml·L-1·s-1、②0.2 ml·L-1·s-1、③0.2 ml·L-1·s-1、④0.225 ml·L-1·s-1,故④>②=③>①。
1.下列说法正确的是( )A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示B.用不同物质的浓度变化表示同一时间内同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比C.化学反应速率的单位通常由时间单位和物质的量的单位决定D.在化学反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值【答案】B
①v(NH3)=0.6 ml·L-1·min-1 ②v(N2)=0.005 ml·L-1·s-1③v(H2)=0.9 ml·L-1·min-1 ④v(NH3)=0.02 ml·L-1·s-1⑤v(H2)=0.01 ml·L-1·s-1 ⑥v(N2)=0.03 ml·L-1·s-1A.①③⑥ B.②④⑤C.①②③ D.④⑤⑥【答案】C
【解析】已知半分钟末有0.6 ml NH3生成,可列式求算:v(NH3)=0.6 ml·L-1·min-1或0.01 ml·L-1·s-1,v(N2)=0.3 ml·L-1·min-1或0.005 ml·L-1·s-1,v(H2)=0.9 ml·L-1·min-1或0.015 ml·L-1·s-1。
其中反应速率最快的是( )A.(1)B.(2) C.(3)D.(4)
【答案】D (2)v(O2)=0.25 ml/(L·min);(4)v(O2)=0.3 ml/(L·min);单位相同,数值大者反应速率快。
( )A.用A表示的反应速率是0.8 ml·L-1·s-1B.分别用B、C、D表示该反应的速率,其比值是3∶2∶1C.在2 min末时的反应速率,用反应物B来表示是0.3 ml·L-1·min-1D.在这2 min内用B和C表示的反应速率的值是相同的
【答案】B 【解析】该速率是2 min内的平均反应速率,而不是2 min末时的反应速率,C错误;根据反应速率之比等于化学计量数之比可知,B正确,D错误;A是固体,不能用来表示反应速率,A错误。
5.某温度时,在2 L容器中,X、Y、Z三种气体物质的量的变化曲线如图所示。由图中数据分析该反应的化学方程式为____________________________________。反应开始至2 min末,Z的平均反应速率为__________。
6.对于反应:4FeS2+11O2===2Fe2O3+8SO2,试回答下列有关问题:(1)常选用哪些物质浓度的变化来表示该反应的反应速率:______________。(2)4 s内生成SO2的速率为0.4 ml/(L·s),则O2减少的速率是_______ ___________________________________。(3)测得4 s后O2的浓度为2.8 ml/L,则开始时O2的浓度为______。【答案】(1)O2或SO2 (2)0.55 ml/(L·s) (3)5 ml/L
7.某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下:[实验目的]测量锌和硫酸反应的速率。[实验用品]锥形瓶、双孔塞、分液漏斗、直角导管、50 mL注射器、铁架台、秒表、锌粒、1 ml·L-1的H2SO4溶液、4 ml·L-1的H2SO4溶液。
[实验步骤] ①甲同学取一套上图装置,加入40 mL 1 ml·L-1的H2SO4溶液,测量收集10 mL H2所需的时间。②乙同学取另一套同样的装置,加入40 mL 4 ml·L-1的H2SO4溶液,测量收集10 mL H2所需的时间。
回答下列问题:(1)Zn与硫酸反应的离子方程式为________________________。(2)收集10 mL H2所需时间:甲________乙(填“大于”“小于”或“等于”,下同),反应速率:甲________乙。(3)下列说法正确的是________(填字母)。A.本实验中甲、乙两同学所用锌粒的表面积要相同B.装置气密性要好C.40 mL的H2SO4溶液要迅速加入D.气体还可以用排水法收集E.若用98%的浓硫酸,则反应最快
高中化学人教版 (2019)选择性必修1第一节 化学反应速率说课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率说课课件ppt,共24页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池教学课件ppt,共37页。PPT课件主要包含了课前·新知导学,红色物质,析出金属铜,产生了氯气,定向运动,Cl-,Cu2+,电解质溶液,氧化还原,化学能等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教学ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教学ppt课件,共47页。PPT课件主要包含了课前·新知导学,能够发生化学反应,有效碰撞,平均能量之差,活化能,反应热,百分数,活化分子百分数,无催化剂,使用催化剂等内容,欢迎下载使用。













