




所属成套资源:【高中化学精品】高中化学新版必修一讲义(基础版+满分版+提升版)
高中化学人教版 (2019)必修 第一册第三节 物质的量同步练习题
展开
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量同步练习题,文件包含高中化学新版必修一第12讲气体摩尔体积教师满分版docx、高中化学新版必修一第12讲气体摩尔体积学生满分版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
第2课时 气体摩尔体积
一、气体摩尔体积
1.决定物质体积大小的因素
(1)物质体积大小的影响因素
(2)粒子数目相同物质的体积关系
2.气体摩尔体积[来源:学科网]
(1)标准状况下的气体摩尔体积Vm=22.4 L·mol-1,那么Vm=22.4 L·mol-1时一定是标准状况下吗?
提示 不一定,同时改变温度和压强,气体摩尔体积(Vm)仍可能保持不变,如升高温度的同时增加压强。
(2)标准状况下0.2 mol H2与0.8 mol O2的混合气体的体积也是22.4 L吗?
提示 是,气体摩尔体积适用范围是气体,可以是单一气体,也可以是混合气体。
标准状况下的气体摩尔体积
使用气体摩尔体积要特别注意:
①要看所处条件:必须为标准状况。非标准状况下,1 mol气体的体积不一定是22.4 L。
②要看物质状态:必须为气态。如标准状况下水、酒精、四氯化碳等为非气态物质。
3.标准状况下气体体积的计算
(1)计算关系
[来源:学科网ZXXK]
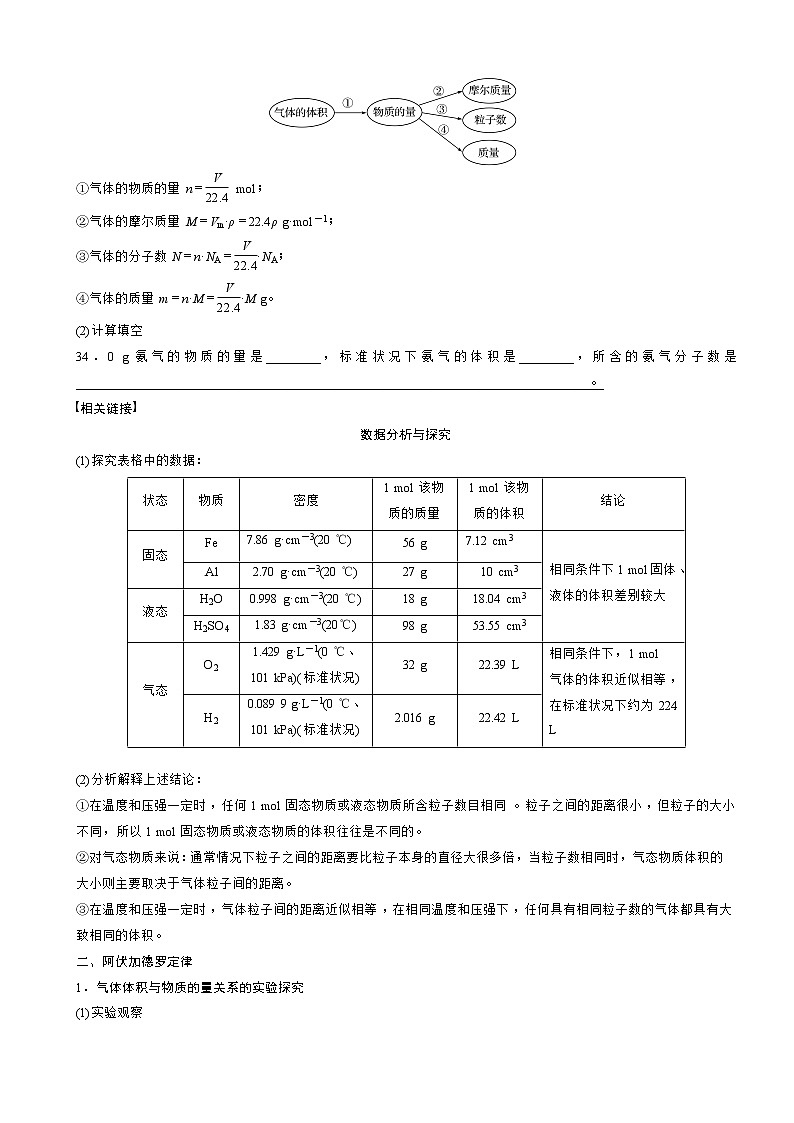
①气体的物质的量n= mol;
②气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
③气体的分子数N=n·NA=·NA;
④气体的质量m=n·M=·M g。
(2)计算填空
34.0 g氨气的物质的量是________,标准状况下氨气的体积是________,所含的氨气分子数是_____________________________________________________________________________。
答案 2.0 mol 44.8 L 1.204×1024
解析 根据气体相关计算公式n===(标准状况)可知:
n(NH3)==2.0 mol。V(NH3)=n(NH3)·Vm=2.0 mol×22.4 L·mol-1=44.8 L。N(NH3)=n(NH3)·NA=2.0 mol×6.02×1023 mol-1=1.204×1024。
相关链接
数据分析与探究
(1)探究表格中的数据:
状态
物质
密度
1 mol该物质的质量
1 mol该物质的体积
结论
固态
Fe
7.86 g·cm-3(20 ℃)[来源:学科网]
56 g
7.12 cm3[来源:Z&xx&k.Com][来源:Z#xx#k.Com]
相同条件下1 mol固体、液体的体积差别较大
Al
2.70 g·cm-3(20 ℃)
27 g
10 cm3
液态
H2O
0.998 g·cm-3(20 ℃)
18 g
18.04 cm3
H2SO4
1.83 g·cm-3(20℃)
98 g
53.55 cm3
气态
O2
1.429 g·L-1(0 ℃、101 kPa)(标准状况)
32 g
22.39 L
相同条件下,1 mol
气体的体积近似相等,在标准状况下约为22.4 L
H2
0.089 9 g·L-1(0 ℃、101 kPa)(标准状况)
2.016 g
22.42 L
(2)分析解释上述结论:
①在温度和压强一定时,任何1 mol固态物质或液态物质所含粒子数目相同。粒子之间的距离很小,但粒子的大小不同,所以1 mol固态物质或液态物质的体积往往是不同的。
②对气态物质来说:通常情况下粒子之间的距离要比粒子本身的直径大很多倍,当粒子数相同时,气态物质体积的大小则主要取决于气体粒子间的距离。
③在温度和压强一定时,气体粒子间的距离近似相等,在相同温度和压强下,任何具有相同粒子数的气体都具有大致相同的体积。
二、阿伏加德罗定律
1.气体体积与物质的量关系的实验探究
(1)实验观察
电解水的实验装置如下图所示:
由图可知:A试管中收集到的气体是氢气,B试管中收集到的气体是氧气,二者的体积之比是2∶1。
(2)计算推理
若有1.8 g水电解,产生氢气的质量为0.2 g,物质的量为0.1 mol;产生氧气的质量为1.6 g,物质的量为0.05 mol;二者物质的量之比为2∶1。
(3)相关结论
①同温同压下,气体的物质的量之比等于体积之比。
②同温同压下,1 mol的不同气体,其体积相同。
2.阿伏加德罗定律
(1)定律内容:同温同压下,相同体积的任何气体都含有相同的分子数。
(2)特别提示:
①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体;
②同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”;
③标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例。
(3)有关推论:
①同温同压下,气体的体积之比等于其物质的量之比;
②同温同体积时,气体的压强之比等于其物质的量之比;
③同温同压下,气体的密度之比等于其摩尔质量之比;
④同温同压下,同体积的任何气体的质量之比等于其摩尔质量之比。
(1) 1 mol一氧化碳和1 mol氧气所含的分子数相同,体积也相同( )
(2)同温同压下,同体积的物质所含的分子数一定相等( )
(3)同温同压下,1 mol(或分子数相同的)任何气体的体积相同( )
(4)相同体积的密闭容器中,1 mol氮气比2 mol氧气产生的压强小( )
(5)标准状况下,16 g氧气与2 g氢气的体积比是1∶2( )
(6)标准状况下,1 g氢气的体积大于10 g氧气的体积( )
答案 (1)× (2)× (3)√ (4)× (5)√ (6)√
(1)同温同压下,相同体积的任何气体都含有相同数目的原子吗?
提示 不一定。同温同压下,相同体积的任何气体都含有相同数目的分子,但分子中所含有的原子数不一定相同,如稀有气体He、Ne等是单原子分子,H2是双原子分子,O3是多原子分子。
(2)结合气体体积的影响因素,思考分析“若两种气体体积相同,所含分子数也一定相同”的说法正确吗?
提示 不正确。因为气体体积受温度和压强的影响较大,当温度和压强不同时,体积相同的两气体的物质的量不一定相同,故所含的分子数也不一定相同。
(3)同温、同压下,向两密闭容器中分别充满等质量的O2和O3气体,则
①两容器的体积比为________。
②两种气体的密度比为________。
答案 ①3∶2 ②2∶3
解析 ①同温、同压下,气体的体积之比等于其物质的量之比,即48∶32=3∶2。
②同温、同压下,气体的密度之比等于其摩尔质量之比,即32∶48=2∶3。
相关链接
(1)阿伏加德罗定律的推论
相同条件
结论
公式
语言叙述
同温同压
==
同温同压下,体积之比等于物质的量之比,等于分子数之比
同温同体积
==
同温同体积下,压强之比等于物质的量之比,等于分子数之比
同温同压
=
同温同压下,密度之比等于摩尔质量之比
同温同压同体积
=
同温同压下,体积相同的气体,其质量与摩尔质量成正比
(2)阿伏加德罗定律推论的理解
①气体的体积与温度、压强有关。相同温度下,单位物质的量的气体压强越小,气体体积越大;相同压强下,单位物质的量的气体温度越高,气体体积越大。
②气体的压强与气体分子数、温度有关。相同分子数时,相同体积中气体温度越高,气体压强越大;相同温度下,相同体积中气体分子数越多,气体压强越大。
随堂练习
1.下列有关气体体积的叙述中,正确的是( )
A.在一定的温度和压强下,各种气态物质体积的大小由气体分子的大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由物质的量的多少决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积,约为22.4 L
解析:决定物质体积的因素:①微粒数的多少,②微粒本身的大小,③微粒间的距离。对于气体物质,在一定温度和压强下,分子间的距离几乎相等,其体积的大小主要由分子数的多少来决定,A错误、B正确;气体的体积随温度和压强的变化而变化。体积不同的气体,在不同的条件下,其分子数可能相同,也可能不同,C错误;气体摩尔体积是指1 mol任何气体所占的体积,其大小是不确定的,会随着温度、压强的变化而变化,22.4 L·mol-1是标准状况下的气体摩尔体积,D错误。
答案:B
2.下列各气体:①含3.01×1023个O的CO2;②标准状况下6.72 L的HCl;③3.4 g的NH3;④0.5 mol He。四种物质所含的原子总数由少到多的正确顺序是( )
A.①
相关试卷
这是一份人教版 (2019)必修 第一册第三节 化学键课时练习,文件包含高中化学新版必修一第20讲离子键教师满分版docx、高中化学新版必修一第20讲离子键学生满分版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二节 金属材料课后测评,文件包含高中化学新版必修一第15讲常见的合金及应用教师满分版docx、高中化学新版必修一第15讲常见的合金及应用学生满分版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
这是一份化学必修 第一册第三节 物质的量达标测试,文件包含高中化学新版必修一第12讲气体摩尔体积教师提升版docx、高中化学新版必修一第12讲气体摩尔体积学生提升版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。











