

辽宁丹东市2020-2022三年中考化学真题知识点分类汇编-08盐和化肥
展开辽宁丹东市2020-2022三年中考化学真题知识点分类汇编-08盐和化肥
一、单选题
1.(2020·辽宁丹东·中考真题)下列各组物质除杂(括号内的物质为杂质)方法错误的是( )
选项
物质
方法
A
CaO(CaCO3)
高温煅烧
B
Na2SO4溶液(Na2CO3)
加入适量的稀盐酸
C
CO2(CO)
通过灼热的氧化铜
D
氯化钙溶液(盐酸)
加入过量的碳酸钙后过滤
A.A B.B C.C D.D
2.(2020·辽宁丹东·中考真题)下列各组物质的溶液混合后为无色透明溶液,且能在pH=1的溶液中大量共存的是( )
A.FeCl3、NH4Cl、K2SO4
B.KCl、Na2SO4、HCl
C.K2CO3、CaCl2、NaCl
D.Ba(NO3)2、Ca(OH)2、NaNO3
3.(2020·辽宁丹东·中考真题)化学广泛应用在工农业生产中,下列说法错误的是( )
A.焊接铁制品时,可用稀盐酸除去其表面的铁锈
B.烧碱易吸水,可以作为某些食品的干燥剂
C.大力推广使用脱硫煤,可减少酸雨的形成
D.磷酸二氢铵和硝酸钾都属于复合肥料
4.(2020·辽宁丹东·中考真题)下列各组物质需要借助其他试剂才可以鉴别的是( )
A.Na2CO3溶液、CaCl2溶液、稀盐酸
B.CuSO4溶液、NaOH溶液、NaCl溶液
C.Ca(OH)2溶液、稀盐酸、NaCl溶液
D.(NH4)2CO3溶液、Ca(OH)2溶液、稀盐酸
5.(2021·辽宁丹东·统考中考真题)下列物质性质和用途没有对应关系的是( )
A.氢气具有可燃性,可作燃料
B.氢氧化钠具有吸水性,可作食品干燥剂
C.铜具有良好的导电性,可作导线
D.小苏打可与盐酸反应,可用于治疗胃酸过多
6.(2021·辽宁丹东·统考中考真题)下列各组物质除杂方法正确的是( )
选项
实验目的
实验方法
A
除去KCl固体中混有的MnO2
加适量水溶解、过滤、洗涤、干燥
B
除去CO2中混有的CO
将混合气体点燃
C
除去N2中混有的O2
将混合气体通过炽热的炭层
D
除去铜粉中混有的铁粉
加过量稀盐酸、过滤、洗涤、干燥
A.A B.B C.C D.D
7.(2021·辽宁丹东·统考中考真题)鉴别下列各组物质所用试剂或操作不合理的是( )
选项
实验目的
所用试剂或操作
A
鉴别NH4NO3固体和NaCl固体
水
B
鉴别CH4和H2
点燃后罩上干冷的烧杯
C
鉴别棉花和羊毛
抽丝灼烧,闻气味
D
鉴别K2SO4固体和NH4Cl固体
加Ca(OH)2,研磨,闻气味
A.A B.B C.C D.D
8.(2022·辽宁丹东·中考真题)厨房中蕴含很多化学知识。下列做法不正确的是
A.用小苏打烘焙糕点
B.用活性炭除去冰箱中的异味
C.用食盐作调味剂
D.用纯碱除去水壶中的水垢
二、填空题
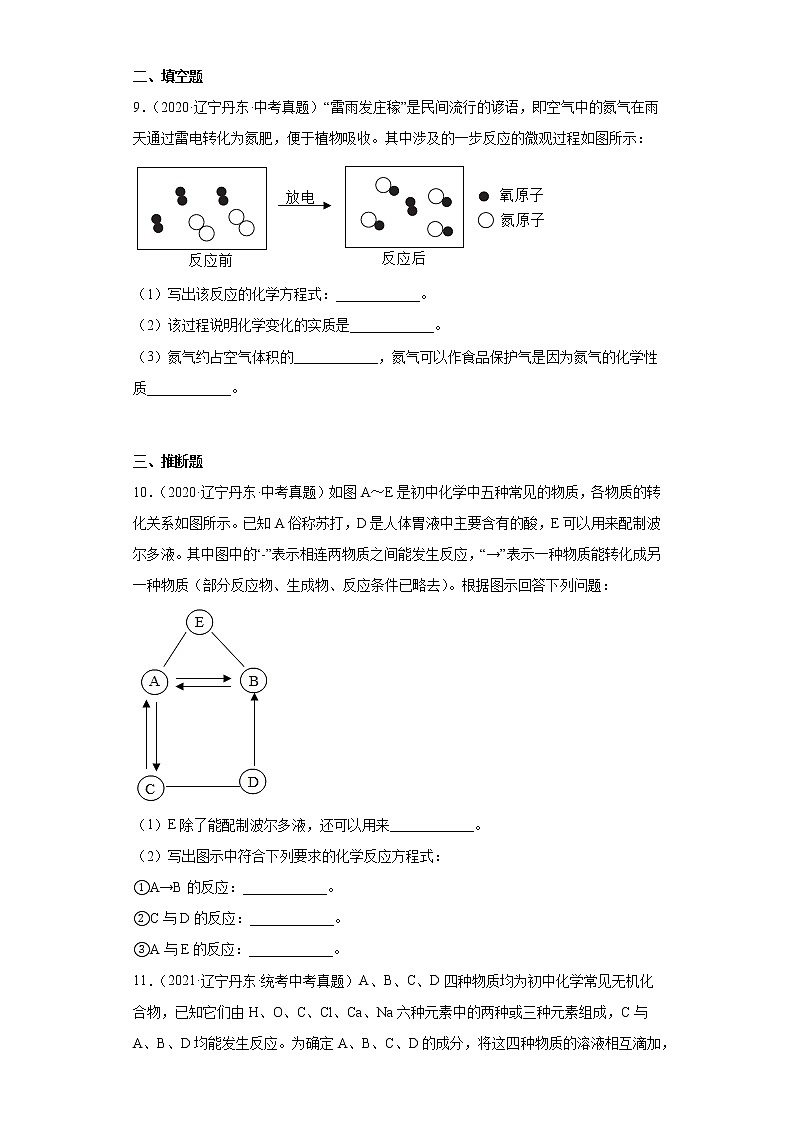
9.(2020·辽宁丹东·中考真题)“雷雨发庄稼”是民间流行的谚语,即空气中的氮气在雨天通过雷电转化为氮肥,便于植物吸收。其中涉及的一步反应的微观过程如图所示:
(1)写出该反应的化学方程式:____________。
(2)该过程说明化学变化的实质是____________。
(3)氮气约占空气体积的____________,氮气可以作食品保护气是因为氮气的化学性质____________。
三、推断题
10.(2020·辽宁丹东·中考真题)如图A~E是初中化学中五种常见的物质,各物质的转化关系如图所示。已知A俗称苏打,D是人体胃液中主要含有的酸,E可以用来配制波尔多液。其中图中的“-”表示相连两物质之间能发生反应,“→”表示一种物质能转化成另一种物质(部分反应物、生成物、反应条件已略去)。根据图示回答下列问题:
(1)E除了能配制波尔多液,还可以用来____________。
(2)写出图示中符合下列要求的化学反应方程式:
①A→B的反应:____________。
②C与D的反应:____________。
③A与E的反应:____________。
11.(2021·辽宁丹东·统考中考真题)A、B、C、D四种物质均为初中化学常见无机化合物,已知它们由H、O、C、Cl、Ca、Na六种元素中的两种或三种元素组成,C与A、B、D均能发生反应。为确定A、B、C、D的成分,将这四种物质的溶液相互滴加,其中有三支试管反应现象如图所示,甲试管中有气泡生成,乙试管中有白色沉淀生成,丙试管中无明显现象。请回答:
(1)甲试管中反应的化学方程式是 __________。
(2)乙试管中反应的化学方程式是 __________。
(3)向丙试管中滴加的 __________(填数字序号)。
①一定是B溶液
②一定是D溶液
③是B溶液或D溶液
(4)将反应后的三支试管中的物质全部倒入烧杯中,静置,烧杯底部有白色沉淀,则说明上层清液中一定不含的离子是 _________(填离子符号)。
(5)某同学取(4)中上层清液于试管中,滴加酚酞溶液,观察到溶液呈红色,再滴加过量氯化钡溶液(氯化钡溶液呈中性)观察到有沉淀生成,溶液仍然呈红色,则(4)的上层清液中一定含有的溶质是 _______(填化学式)。
四、科学探究题
12.(2020·辽宁丹东·中考真题)在化学反应中,由于参加化学反应物质的质量不同,产物可能有所不同。
【已有知识】碳与氧气发生化学反应,当氧气充足时,产物是____________;当氧气不充足时,则能产生有毒气体____________。
【查阅资料】澄清石灰水与碳酸氢钠溶液反应时,由于参加化学反应的物质化学计量数之比不同,生成的产物可能不同。请完成下列空格中的化学方程式。
Ca(OH)2与NaHCO3化学计量数之比
产物
化学反应方程式
反应一
1:1
CaCO3、NaOH、H2O
反应二
1:2
CaCO3、Na2CO3、H2O
反应三
1:1.5
CaCO3、NaOH、Na2CO3、H2O
____________
【产物探究】某兴趣小组在老师的指导下欲对上述反应三得到的相关产物进行探究,请帮助完成下列问题。
可选试剂:稀盐酸、Ba(OH)2溶液、BaCl2溶液、无色酚酞溶液。
信息资料:BaCl2溶液呈中性、碳酸钡为白色不溶物。
实验步骤
实验现象
实验结论
步骤l:将Ca(OH)2与NaHCO3按化学计量数1:1.5 混合,在水溶液中使其充分反应
产生白色沉淀
产物中有碳酸钙
步骤2:将步骤1所得混合物静置,取少量上层清液于试管中,向其中加入____________。
____________
产物中有碳酸钠
步骤3:将步骤2所得混合物静置,取少量上层清液于试管中,向其中滴加____________。
____________
产物中有氢氧化钠
【深入思考】有的同学认为在上述步骤2中也可以加入氯化钙溶液来证明产物中有碳酸钠,请说出你的观点并解释:____________。
13.(2022·辽宁丹东·中考真题)某活动小组对教材中关于钟乳石形成过程的介绍产生了浓厚的兴趣,设计并进行了下列实验,请你帮助完成相关问题。
【探究活动一】钟乳石形成过程中物质的变化
查阅资料:(1)CaCO3与CO2、H2O以发生化合反应,生成可溶于水的Ca(HCO3)2。
(2)溶有Ca(HCO3)2的水遇热或当压强突然变小时,溶解在水里的Ca(HCO3)2就会重新生成碳酸钙沉积下来,同时放出二氧化碳。
实验过程:
实验步骤与方法
实验现象
分析与结论
步骤1:取一定量澄清石灰水于试管中,通入CO2.
溶液变浑浊
生成的沉淀物是___________
步骤2:向步骤1所得混合物中继续通入CO2
浑浊液又变澄清
化学方程式为___________
步骤3:加热步骤2所得溶液
溶液又变浑浊
溶洞中能通过___________个反应把CaCO3从一个地方“转移”到另一个地方,从而形成奇妙的、形态各异的钟乳石。
交流讨论:同学们认为NaOH和Ca(OH)2溶液中都含有___________,所以具有相似的化学性质。那么NaOH溶液是否也能与CO2反应生成NaHCO3?
【探究活动二】CO2通入NaOH溶液中,产物中是否有NaHCO3?
实验过程:
实验步骤与方法
实验现象
分析与结论
步骤1:取一定量NaOH溶液于试管中,通入一段时间CO2
无明显现象
一定发生的反应化学方程式是___________
步骤2:向步骤1所得溶液中加入过量Ca(NO3)2溶液
澄清溶液变浑浊
加入过量Ca(NO3)2溶液的目的是检验并除去___________
步骤3:过滤步骤2所得混合物,向滤液中加入___________。
有气体生成
通入NaOH溶液中的CO2足够多时,___________(填“有”或“没有”)NaHCO3生成。
反思提升:(1)若要用CO2与Ca(OH)2溶液反应获得CaCO3,实验中应该注意的问题是___________。
(2)通过上述实验探究活动,你对化学反应的新认识是___________。
14.(2022·辽宁丹东·中考真题)下列是化学兴趣小组的同学进行粗盐提纯的实验,请你帮助回答相关问题。
【实验一】除去粗盐中难溶性杂质
溶解:在溶解过程中,用玻璃棒不断搅拌的目的是___________。
过滤:漏斗下端管口应紧靠___________;若滤纸未紧贴漏斗壁,会导致___________。
得到的滤液M中还含有可溶性杂质CaCl2和MgCl2。
【实验二】除去滤液M中的可溶性杂质CaCl2和MgCl2(温馨提示:氢氧化镁不溶于水)
步骤1:向滤液M中加入过量的NaOH溶液,充分反应后过滤。该反应的基本反应类型是___________,所得溶液A中含有的金属离子有___________。
步骤2:向溶液A中加入过量某溶液,充分反应后过滤。发生反应的化学方程式为___________。
步骤3:___________。
参考答案:
1.B
【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】A、CaCO3固体高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
B、Na2CO3能与适量的稀盐酸反应生成氯化钠、水和二氧化碳,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项所采取的方法错误;
C、CO能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
D、HCl能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:B。
2.B
【分析】pH为1的水溶液显酸性,水溶液中含有大量的H+,根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存;本题还要注意能得到无色溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等。
【详解】pH为1的水溶液显酸性,水溶液中含有大量的。
A、三者之间不反应,且能在酸性溶液中共存,但FeCl3溶于水呈黄色,故选项错误。
B、三者之间不反应,能在酸性溶液中共存,且不存在有色离子,故选项正确。
C.中的碳酸根离子和在溶液中能结合生成水和二氧化碳,不能在酸性溶液中大量共存,故选项错误。
D、Ca(OH)2中的氢氧根离子和在溶液中能结合生成水,不能在酸性溶液中大量共存,故选项错误。
故选:B。
3.B
【详解】A、稀盐酸能与金属氧化物反应生成盐和水,铁锈的主要成分是氧化铁,所以可用稀盐酸除去其表面的铁锈,故A说法正确;
B、烧碱具有很强的腐蚀性,不能用烧碱作为某些食品的干燥剂,故B说法错误;
C、形成酸雨的主要物质是二氧化硫和氮的氧化物,大力推广使用脱硫煤,可减少二氧化硫的排放,从而减少酸雨的形成,故C说法正确;
D、磷酸二氢铵中含有磷元素和氮元素,属于复合肥;硝酸钾中含有氮元素和钾元素,属于复合肥,所以都属于复合肥料,故D说法正确。
故选:B。
4.C
【分析】在不另加试剂就能鉴别的题目中,首先观察有无有特殊颜色的物质,若有,将有颜色的溶液鉴别出来,然后再借用这种溶液鉴别其它溶液;若都没有颜色就将溶液两两混合,根据混合后的现象进行分析鉴别。
【详解】A、组内三种物质的溶液两两混合时,其中有一种溶液与其它两种溶液混合时出现一次白色沉淀和一次放出气体,该溶液为碳酸钠溶液;与碳酸钠溶液产生气体的溶液为盐酸,产生白色沉淀的为氯化钙;故不加其它试剂可以鉴别;
B、CuSO4溶液是蓝色的,首先鉴别出蓝色的CuSO4溶液,能与CuSO4溶液反应产生蓝色沉淀的是NaOH溶液,无明显变化的是氯化钠溶液,故不加其它试剂可以鉴别;
C、Ca(OH)2溶液、稀盐酸反应生成氯化钙和水,但无明显现象,其余两两混合均没有明显现象,故不加其它试剂无法鉴别;
D、组内三种物质的溶液两两混合时,其中有一种溶液与其它两种溶液混合时出现一次白色沉淀和一次放出气体,该溶液为(NH4)2CO3溶液;与(NH4)2CO3溶液产生气体的溶液为稀盐酸,产生白色沉淀和有刺激性气味气体的为Ca(OH)2溶液;故不加其它试剂可以鉴别。
故选:C。
5.B
【详解】A、氢气具有可燃性,可作燃料,故A正确;
B、氢氧化钠固体虽然具有吸水性,但因为其腐蚀性较强,所以不能用作食品干燥剂,故B错误;
C、铜具有良好的导电性,可作导线,故C正确;
D、小苏打碳酸氢钠可与盐酸反应,可用于治疗胃酸过多,故D正确。
故选:B。
6.D
【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】A、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤除去固体、蒸发结晶得到氯化钾的方法进行分离除杂,故选项所采取的方法错误。
B、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误。
C、炽热的炭层能与O2反应生成二氧化碳气体,能除去杂质但引入了新的杂质二氧化碳,不符合除杂原则,故选项所采取的方法错误。
D、铁粉能与过量稀盐酸反应生成氯化亚铁溶液和氢气,铜不与过量稀盐酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选D。
7.B
【详解】A、NH4NO3固体溶于水吸热,使温度降低,NaCl固体溶于水温度几乎无变化,能出现两种明显不同的现象,可以鉴别,故选项错误。
B、CH4和H2燃烧均能生成水,点燃后罩上干冷的烧杯,烧杯内壁均会出现水雾,不能鉴别,故选项正确。
C、抽丝灼烧,闻气味,产生烧纸气味的是棉花,产生烧焦羽毛气味的是羊毛,可以鉴别,故选项错误。
D、加Ca(OH)2,研磨,闻气味,产生刺激性气味的是NH4Cl固体,无明显气味的是K2SO4固体,可以鉴别,故选项错误。
故选B。
8.D
【详解】A、小苏打是碳酸氢钠的俗称,受热时会分解产生二氧化碳气体,因此可用小苏打烘焙糕点,故A正确;
B、活性炭具有吸附性,可用活性炭除去冰箱中的异味,故B正确;
C、食盐具有咸味,主要成分是氯化钠,在生活中常用食盐作调味剂,故C正确;
D、纯碱是碳酸钠的俗称,碳酸钠与水垢不反应,因此不能用纯碱除去水壶中的水垢,故D不正确。故选D。
9. 分子分成原子,原子再重新组合成新的分子 78% 不活泼
【详解】(1)由微观反应示意图可知,氮气和氧气在放电的条件下反应生成一氧化氮,化学方程式为;
(2)由微观反应示意图可知,化学变化的实质是分子分成原子,原子再重新组合成新的分子;故填:分子分成原子,原子再重新组合成新的分子;
(3)氮气约占空气体积的78%;氮气的化学性质不活泼,所以可以作食品保护气;故填:78%;不活泼。
10. 改良酸性土壤
【分析】根据题干提供的信息进行分析解答,A俗称苏打,故A是碳酸钠,D是人体胃液中主要含有的酸,故D是盐酸,E可以用来配制波尔多液,能与A、B反应,且A、B能相互转化,D能生成B,故B是二氧化碳,E是氢氧化钙,C能与碳酸钠相互转化,能与盐酸反应,故C是氢氧化钠,代入框图,推断合理。
【详解】(1)E是氢氧化钙,除了能配制波尔多液,还可以用来改良酸性土壤,故填:改良酸性土壤;
(2)①A→B的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳的反应,故填:;
②C与D的反应是氢氧化钠和盐酸的反应,二者反应生成氯化钠和水,故填:。
③A与E的反应是氢氧化钙和碳酸钠反应生成生成碳酸钙沉淀和氢氧化钠,故填:。
11.(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)Na2CO3+CaCl2═CaCO3↓+2NaCl
(3)③
(4)H+
(5)NaCl、Na2CO3、NaOH
【分析】解:A、B、C、D四种物质均为初中化学常见无机化合物,已知它们由H、O、C、Cl、Ca、Na六种元素中的两种或三种元素组成,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,和氢氧化钠反应生成氯化钠和水,碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,C与A、B、D均能发生反应,将这四种物质的溶液相互滴加,甲试管中有气泡生成,是因为盐酸和碳酸钠反应生成二氧化碳,乙试管中有白色沉淀生成,是因为碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,说明C是盐酸,A是碳酸钠,B是氯化钙,D是氢氧化钠;
【详解】(1)甲试管中盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式是:Na2CO3+2HCl═2NaCl+H2O+CO2↑。故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
(2)乙试管中碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式是:Na2CO3+CaCl2═CaCO3↓+2NaCl。故填:Na2CO3+CaCl2═CaCO3↓+2NaCl。
(3)向丙试管中滴加的是B溶液或D溶液,是因为氯化钙不能和盐酸反应,无明显现象,氢氧化钠和盐酸反应生成氯化钠和水,无明显现象。故填:③。
(4)将反应后的三支试管中的物质全部倒入烧杯中,静置,烧杯底部有白色沉淀,则说明上层清液中一定不含的离子是氢离子。故填:H+。
(5)某同学取(4)中上层清液于试管中,滴加酚酞溶液,观察到溶液呈红色,说明溶液显碱性,再滴加过量氯化钡溶液(氯化钡溶液呈中性)观察到有沉淀生成,是因为碳酸钠和氯化钡反应生成白色沉淀碳酸钡,说明溶液中含有碳酸钠,溶液仍然呈红色,说明溶液中含有氢氧化钠,则(4)的上层清液中一定含有的溶质是反应生成的NaCl、过量的Na2CO3、NaOH。故填:NaCl、Na2CO3、NaOH。
12. 二氧化碳 一氧化碳 足量氯化钡溶液 产生白色沉淀 酚酞试液 酚酞试液变红色 不可以。氢氧化钙微溶于水,氯化钙可能和氢氧化钠结合形成氢氧化钙沉淀,影响实验结果
【分析】已有知识:根据碳在氧气不充分燃烧和充分燃烧的原理分析;
查阅资料:根据反应一和反应二写出Ca(OH)2与NaHCO3化学计量数之比是1:1.5时的化学方程式;
产物探究:根据碳酸钠和氯化钡反应分析;根据氢氧化钠溶液显碱性,能使酚酞试液变红色分析;
深入思考:氢氧化钙微溶于水,氯化钙能和氢氧化钠反应生成氢氧化钙沉淀。
【详解】已有知识:碳与氧气发生化学反应,当氧气充足时,产物是二氧化碳;当氧气不充足时,则能产生有毒气体一氧化碳。
查阅资料:Ca(OH)2与NaHCO3化学计量数之比是1:1.5时,即氢氧化钙与碳酸氢钠系数比为2:3时,氢氧化钙提供4个氢氧根离子,和3个碳酸氢根离子反应,其中3个氢氧根离子和3个碳酸氢根离子反应生成3个碳酸根离子,剩下1个氢氧根离子不反应,2个钙离子结合2个碳酸根生成碳酸钙沉淀,也可以从另一个角度分析,将前面的反应一和反应二的方程式加起来,左边反应物相加,右边生成物相加,故反应的化学方程式:;
产物探究:步骤2:将步骤1所得混合物静置,取少量上层清液于试管中,向其中加入足量氯化钡溶液,产生白色沉淀,是因为碳酸钠和氯化钡反应生成白色沉淀碳酸钡和氯化钠,说明产物中含有碳酸钠。
步骤3:将步骤2所得混合物静置,取少量上层清液于试管中,向其中滴加酚酞试液,酚酞试液变红色,说明溶液中含有氢氧化钠。
深入思考:在上述步骤2中不可以加入氯化钙溶液来证明产物中有碳酸钠,是因为氢氧化钙微溶于水,氯化钙可能和氢氧化钠结合形成氢氧化钙沉淀,影响实验结果。
13. 碳酸钙##CaCO3
2 OH﹣##氢氧根
碳酸钠##Na2CO3 稀盐酸 有 控制二氧化碳的量(合理即可) 反应物的量不同,得到的生成物可能不一样(合理即可)
【详解】探究活动一:
实验过程:
步骤1:由于二氧化碳能与石灰水中的氢氧化钙反应会生成碳酸钙沉淀和水,则生成的沉淀物是碳酸钙;
步骤2:继续向浑浊的溶液中通入二氧化碳,溶液变澄清是因为CaCO3与CO2、H2O可以发生化合反应,生成可溶于水的Ca(HCO3)2,该反应的化学方程式为:;
步骤3:CaCO3与CO2、H2O以发生化合反应,生成可溶于水的Ca(HCO3)2,溶有Ca(HCO3)2的水遇热就会重新生成碳酸钙沉积下来,同时放出二氧化碳,所以溶洞中能通过2个反应把CaCO3从一个地方“转移”到另一个地方,从而形成奇妙的、形态各异的钟乳石;
交流讨论:NaOH和Ca(OH)2溶液中都含有OH﹣,所以具有相似的化学性质。
探究活动二:
实验过程:
步骤1:取一定量NaOH溶液于试管中,通入一段时间CO2,二氧化碳与氢氧化钠反应生成碳酸钠和水,该反应的化学方程式为:;
步骤2:碳酸钠能与硝酸钙反应生成碳酸钙沉淀和硝酸钠,则加入过量Ca(NO3)2溶液的目的是检验并除去碳酸钠;
步骤3:碳酸氢钙与稀盐酸反应生成氯化钙、水和二氧化碳,过滤步骤2所得混合物,向滤液中加入稀盐酸,有气体生成,则说明通入NaOH溶液中的CO2足够多时,有NaHCO3生成;
反思提升:
(1)若要用CO2与Ca(OH)2溶液反应获得CaCO3,实验中应该注意的问题是控制二氧化碳的量,否则可能生成碳酸氢钙影响产生碳酸钙的质量;
(2)通过上述实验探究活动,可得知反应物的量不同,得到的生成物可能不一样。
14. 加快粗盐的溶解速率 烧杯内壁 过滤速度慢(合理即可) 复分解反应 Ca2+、Na+ 向溶液B中加入适量的稀盐酸,后蒸发结晶
【详解】[实验一]溶解:溶解需要用玻璃棒不断搅拌,加快溶解速率,故在溶解过程中,用玻璃棒不断搅拌的目的是加快粗盐的溶解速率。
过滤:漏斗下端管口应紧靠烧杯内壁,让溶液沿着烧杯壁流下,若滤纸未紧贴漏斗壁,中间留有气泡,会导致过滤速度慢,故漏斗下端管口应紧靠烧杯内壁;若滤纸未紧贴漏斗壁,会导致过滤速度慢(合理即可)。
[实验二]
步骤1:向滤液M中加入过量的NaOH溶液,氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,该反应是两种化合物相互交换成分,生成另外两种新的化合物的反应,故该反应的基本反应类型是复分解反应;所得溶液A的溶质为氯化钠、氯化钙、氢氧化钠,故所得溶液A中含有的金属离子有Ca2+、Na+。
步骤2:步骤2需要除去氯化钙,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,则向溶液A中加入过量碳酸钠溶液,故发生反应的化学方程式为。
步骤3:溶液B中的溶质为过量的氢氧化钠,氯化钠,过量碳酸钠,向溶液B中加入适量的稀盐酸,均能转化成氯化钠,后蒸发结晶,得到氯化钠晶体,故步骤3:向溶液B中加入适量的稀盐酸,后蒸发结晶。
西藏2020-2022三年中考化学真题知识点分类汇编-06盐和化肥: 这是一份西藏2020-2022三年中考化学真题知识点分类汇编-06盐和化肥,共14页。试卷主要包含了单选题,科学探究题,计算题,填空题,推断题等内容,欢迎下载使用。
辽宁锦州市2020-2022三年中考化学真题知识点分类汇编-08盐和化肥: 这是一份辽宁锦州市2020-2022三年中考化学真题知识点分类汇编-08盐和化肥,共12页。试卷主要包含了单选题,推断题,科学探究题,计算题等内容,欢迎下载使用。
辽宁沈阳市2020-2022三年中考化学真题知识点分类汇编-08盐和化肥: 这是一份辽宁沈阳市2020-2022三年中考化学真题知识点分类汇编-08盐和化肥,共12页。试卷主要包含了单选题,填空题,实验题,科学探究题等内容,欢迎下载使用。












