






还剩33页未读,
继续阅读
所属成套资源:苏教版化学选择性必修2课件PPT全册
成套系列资料,整套一键下载
高中化学苏教版选择性必修2 专题3 阶段重点突破练课件PPT
展开
这是一份高中化学苏教版选择性必修2 专题3 阶段重点突破练课件PPT,共41页。
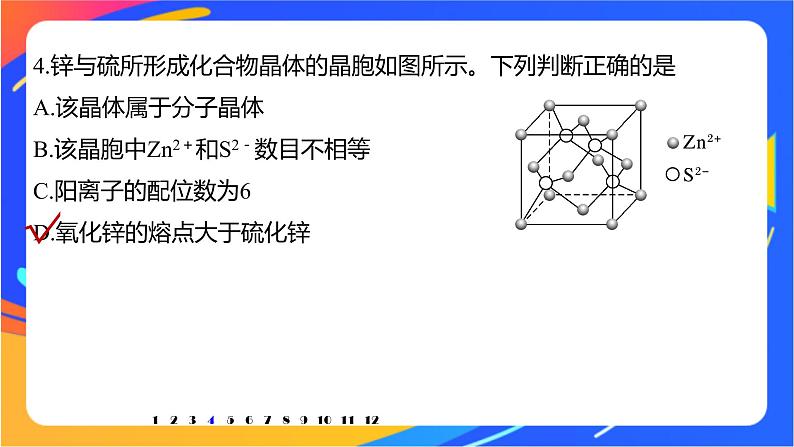
阶段重点突破练(二)1.下面有关离子晶体的叙述中,不正确的是A.1 mol氯化钠中有NA个NaCl分子B.氯化钠晶体中,每个Na+周围紧邻6个Cl-C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.平均每个NaCl晶胞中有4个Na+、4个Cl-√123456789101112一、晶体类型与结构解析 氯化钠为离子晶体,不存在单个的分子,故A错误;在氯化钠的晶胞中,钠离子在棱心和体心时,顶点和面心为氯离子,则每个Na+周围距离相等的Cl-共有6个,故B正确;氯化铯晶体的晶胞中,铯离子在体心,氯离子在顶点,每个Cs+周围紧邻8个Cl-,故C正确;1234567891011122.下列关于CaF2的表述正确的是A.Ca2+与F-间仅存在静电吸引作用B.F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2C.阴、阳离子个数比为2∶1的物质,均与CaF2晶体结构相同D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电√123456789101112解析 Ca2+与F-之间既有静电引力作用,也有静电排斥作用,A错误;离子所带电荷数相同,F-的离子半径小于Cl-,所以CaF2的熔点高,B错误;晶体结构还与离子的半径大小有关,所以阴、阳离子个数比为2∶1的物质,不一定与CaF2晶体结构相同,C错误;CaF2中的化学键为离子键,CaF2在熔融状态下能发生电离,因此CaF2在熔融状态下能导电,D正确。1234567891011123.经X射线研究证明:PCl5在固态时,由空间结构分别是正四面体和正八面体的两种离子构成,下列关于PCl5的推断正确的是A.PCl5固体是分子晶体B.PCl5晶体具有良好的导电性C.PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1D.PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1√123456789101112解析 根据题意知,PCl5固体由两种离子构成,PCl5固体属于离子晶体,A项错误;PCl5晶体属于离子晶体,离子晶体中阴、阳离子不能自由移动,故PCl5晶体没有良好的导电性,B项错误;两种离子分别是正四面体和正八面体,正四面体为AB4型,正八面体为AB6型,根据PCl5的化学式,正四面体型的为[PCl4]+,正八面体型的为[PCl6]-,且两种离子数目之比为1∶1,C项正确、D项错误。1234567891011124.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是A.该晶体属于分子晶体B.该晶胞中Zn2+和S2-数目不相等C.阳离子的配位数为6D.氧化锌的熔点大于硫化锌√123456789101112解析 A项,该晶体属于离子晶体,错误;123456789101112C项,在ZnS晶胞中,1个S2-周围距离最近的Zn2+有4个,1个Zn2+周围距离最近的S2-有4个,则S2-的配位数为4,Zn2+的配位数也为4,错误;D项,ZnO和ZnS中,O2-的半径小于S2-的半径,离子所带的电荷数相等,所以ZnO的离子键键能大于ZnS,ZnO的熔点大于ZnS,正确。123456789101112√晶体中每个K+距离最近的K+有12个;设晶体中0价氧原子和-2价氧原子的个数分别为x、y,则有x+y=8,x×0+y×(-2)=-4,得x∶y=3∶1。1234567891011126.具有下列性质的物质可能属于离子晶体的是A.熔点113 ℃,能溶于CS2 B.熔点44 ℃,液态不导电C.熔点1 124 ℃,易溶于水 D.熔点180 ℃,固态能导电二、晶体类型与性质√解析 熔点113 ℃,能溶于CS2,这是分子晶体的性质,故A错误;熔点低,液态不导电,这是分子晶体的性质,故B错误;熔点较高,多数离子晶体易溶于水,此性质为离子晶体的性质,故C正确;离子晶体在固态时不导电,故D错误。1234567891011127.(2020·济南高二检测)离子晶体熔点的高低决定于阴、阳离子间离子键的强弱,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是A.KCl>NaCl>BaO>CaOB.NaCl>KCl>CaO>BaOC.CaO>BaO>KCl>NaClD.CaO>BaO>NaCl>KCl√123456789101112解析 对于离子晶体来说,离子所带电荷数越多,阴、阳离子间的核间距离越小,离子键越强,熔点越高。一般在阴、阳离子的核间距离相当时首先看离子所带电荷数,CaO、BaO所带电荷数都大于KCl、NaCl,所以CaO、BaO的熔点大于KCl、NaCl;其次在电荷数相当时,看阴、阳离子的核间距离,r(Ba2+)>r(Ca2+),熔点:CaO>BaO,r(K+)>r(Na+),熔点:NaCl>KCl。1234567891011128.下列比较正确的是A.化学键的键能由大到小:金刚石>碳化硅>硅B.熔、沸点由高到低:氯化钠>氧化镁>金刚石>二氧化碳C.硬度由大到小:C60>碳化硅>铁>氯化钠D.共价键的极性由强到弱:H—I键>H—Br键>H—Cl键√123456789101112解析 原子半径:C<Si,则化学键的键能由大到小:金刚石>碳化硅>硅,A正确;金刚石是共价晶体,氯化钠和氧化镁是离子晶体,二氧化碳是分子晶体,则熔、沸点由高到低:金刚石>氧化镁>氯化钠>二氧化碳,B错误;碳化硅是共价晶体,铁是金属晶体,氯化钠是离子晶体,C60是分子晶体,则硬度由大到小:碳化硅>铁>氯化钠>C60,C错误;非金属性:I<Br<Cl,则共价键的极性由弱到强:H—I键<H—Br键<H—Cl键,D错误。1234567891011129.(1)在①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石、⑦(NH4)2SO4、⑧乙醇中,由极性键形成的非极性分子有______(填序号,下同),含有金属离子的物质是______,分子间可形成氢键的物质是____,属于离子晶体的是_____,属于共价晶体的是_____,①~⑤五种物质的熔点由高到低的顺序是____________________。123456789101112①⑤②③⑧②⑦④⑥④>②>③>⑤>①解析 ①CO2、⑤CS2中只含有极性键,分子都是直线形分子,正负电荷中心重合,属于非极性分子;②NaCl由钠离子和氯离子构成;③Na由钠离子和自由电子构成,都含有金属离子;⑧乙醇中羟基氢与其他羟基上的氧原子能形成氢键;⑦(NH4)2SO4由铵根离子和硫酸根离子构成,属于离子化合物;离子化合物在固态时均为离子晶体;④Si、⑥金刚石都是由原子构成的共价晶体;123456789101112晶体的熔点:共价晶体>离子晶体>金属晶体>分子晶体,Si是共价晶体,熔点最高,CO2和CS2都是分子晶体,相对分子质量越大熔点越高,Na的熔点低于100 ℃,所以熔点由高到低的顺序为④>②>③>⑤>①。123456789101112(2)A、B、C、D为四种晶体,性质如下:A.固态时能导电,能溶于盐酸B.能溶于CS2,不溶于水C.固态时不导电,液态时能导电,可溶于水D.固态、液态时均不导电,熔点为3 500 ℃试推断它们的晶体类型:A.__________;B.__________;C._________;D._________。123456789101112金属晶体分子晶体离子晶体共价晶体解析 A固态时能导电,能溶于盐酸,应为活泼金属,属于金属晶体;B能溶于CS2,不溶于水,属于分子晶体;C固态时不导电,液态时能导电,可溶于水,属于离子晶体;D固态、液态时均不导电,熔点为3 500 ℃,属于共价晶体。123456789101112(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.________;B._______;C.________;D.__________________。123456789101112氯化铯氯化钠二氧化硅金刚石(或晶体硅)解析 由晶胞结构模型可知:在氯化铯晶体中,每个Cs+同时吸引8个Cl-,每个Cl-同时吸引8个Cs+,氯离子与铯离子数目之比为1∶1,故A为氯化铯;在氯化钠晶体中,每个Na+同时吸引着6个Cl-,每个Cl-同时吸引着6个Na+,氯离子与钠离子的数目之比为1∶1,故B为氯化钠晶体;123456789101112在二氧化硅晶体中,每个Si原子与4个O原子结合,每个O原子与2个Si原子结合,硅原子与氧原子的个数之比为1∶2,故C为SiO2;在金刚石晶体中,每个碳原子周围紧邻4个碳原子,最小碳环由6个碳原子组成,故D为金刚石(晶体硅的结构和金刚石相似)。123456789101112三、晶体结构的综合分析10.硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1 520 ℃。硒化锌晶体材料对热冲击具有很高的承受能力,使它成为高功率CO2激光器系统中的最佳光学材料。硒化锌的晶胞结构如图所示:(1)图中x和y点所堆积的原子均为____(填元素符号)。Zn123456789101112(2)若该晶胞密度为ρ g·cm-3,硒化锌的摩尔质量为M g·mol-1。用NA代表阿伏加德罗常数的值,则晶胞参数a=___________nm。解析 该晶胞中含有4个Zn2+、4个Se2-,12345678910111211.砷化镓是第二代半导体,熔点为1 238 ℃,具有空间网状结构,性能比硅更优良。砷化镓半导体材料的一个重要特性就是光电特性。由于它具有直接带隙以及宽禁带等结构,它的光发射效率比硅、锗等半导体材料高,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术。砷化镓晶体晶胞结构如图所示:(1)砷化镓属于_____晶体。(2)砷化镓与氮化硼属于同种晶体类型。则两种晶体熔点较高的是____,其理由是___________________________________________________________。共价BN二者均为共价晶体,B—N键的键长比Ga—As键的键长短,键能大123456789101112(3)Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________________________。123456789101112解析 该晶胞中含有4个Ga、4个As,则晶胞中原子的体积则GaAs晶胞中原子的体积占晶胞体积的百分率为12345678910111212.按要求回答下列问题。(1)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示,其中最小的环为____元环,每个环平均含有___个P原子。六2123456789101112(2)磷烯是新型二维半导体材料,具有类似石墨一样的片层结构(如图),层与层之间以________结合。从结构上看,单层磷烯导电性优于石墨烯的原因是_______________________________________________________________________________________________________________________________________________。范德华力 石墨烯同层碳原子中,1个碳原子和周围3个碳原子结合后,还剩1个外围电子,单层磷烯同层磷原子中,1个磷原子和周围3个磷原子结合后,还剩2个外围电子123456789101112(3)阳离子[(CH3)3NH]+和阴离子A按个数比4∶1组成化合物,阴离子A的结构如图所示,阴离子A的化学式为__________。[Ge4S10]4-解析 阴离子A中含有4个Ge和10个S,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,则A离子带有4个负电荷,即离子的化学式为[Ge4S10]4-。123456789101112(4)如图为钛酸钡晶体的晶胞结构,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。①写出该晶体的化学式:________。123456789101112BaTiO3②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的_____位置。123456789101112面心解析 根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上。③Ti4+的氧配位数和Ba2+的氧配位数分别为________。1234567891011126、12解析 根据晶胞的结构可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为6;立方晶胞12条棱上的12个O原子均与体心Ba2+等距,所以Ba2+的氧配位数为12。(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588 pm。①S2-的配位数为____。8解析 以最右面中心S2-分析,连接左边有4个锂离子,右边的晶胞中也应该有4个锂离子,因此配位数为8。123456789101112②设NA为阿伏加德罗常数的值,Li2S的晶胞密度为________________(列出计算式)g·cm-3。解析 设NA为阿伏加德罗常数的值,根据晶胞结构计算出锂离子有8个,硫离子有4个,123456789101112(6)A、B、C 为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A 单质晶体的晶胞结构如图1所示。B的外围电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的ds区,其基态原子不存在不成对电子。B与C所形成化合物晶体的晶胞如图2所示。①A 单质晶体属于_____(填晶体类型)晶体。共价123456789101112解析 A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图1所示,可知A为硅形成的晶体,属于共价晶体。123456789101112②B与C所形成化合物晶体的化学式为_____。ZnS解析 B的外围电子排布为(n+1)sn(n+1)pn+2,有三个电子层,最外层有6个电子,B为S原子,C位于元素周期表的ds区,其基态原子不存在不成对电子,为Zn原子,由晶胞图知B与C所形成化合物晶体的化学式为ZnS。123456789101112本课结束
阶段重点突破练(二)1.下面有关离子晶体的叙述中,不正确的是A.1 mol氯化钠中有NA个NaCl分子B.氯化钠晶体中,每个Na+周围紧邻6个Cl-C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.平均每个NaCl晶胞中有4个Na+、4个Cl-√123456789101112一、晶体类型与结构解析 氯化钠为离子晶体,不存在单个的分子,故A错误;在氯化钠的晶胞中,钠离子在棱心和体心时,顶点和面心为氯离子,则每个Na+周围距离相等的Cl-共有6个,故B正确;氯化铯晶体的晶胞中,铯离子在体心,氯离子在顶点,每个Cs+周围紧邻8个Cl-,故C正确;1234567891011122.下列关于CaF2的表述正确的是A.Ca2+与F-间仅存在静电吸引作用B.F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2C.阴、阳离子个数比为2∶1的物质,均与CaF2晶体结构相同D.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电√123456789101112解析 Ca2+与F-之间既有静电引力作用,也有静电排斥作用,A错误;离子所带电荷数相同,F-的离子半径小于Cl-,所以CaF2的熔点高,B错误;晶体结构还与离子的半径大小有关,所以阴、阳离子个数比为2∶1的物质,不一定与CaF2晶体结构相同,C错误;CaF2中的化学键为离子键,CaF2在熔融状态下能发生电离,因此CaF2在熔融状态下能导电,D正确。1234567891011123.经X射线研究证明:PCl5在固态时,由空间结构分别是正四面体和正八面体的两种离子构成,下列关于PCl5的推断正确的是A.PCl5固体是分子晶体B.PCl5晶体具有良好的导电性C.PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1D.PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1√123456789101112解析 根据题意知,PCl5固体由两种离子构成,PCl5固体属于离子晶体,A项错误;PCl5晶体属于离子晶体,离子晶体中阴、阳离子不能自由移动,故PCl5晶体没有良好的导电性,B项错误;两种离子分别是正四面体和正八面体,正四面体为AB4型,正八面体为AB6型,根据PCl5的化学式,正四面体型的为[PCl4]+,正八面体型的为[PCl6]-,且两种离子数目之比为1∶1,C项正确、D项错误。1234567891011124.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是A.该晶体属于分子晶体B.该晶胞中Zn2+和S2-数目不相等C.阳离子的配位数为6D.氧化锌的熔点大于硫化锌√123456789101112解析 A项,该晶体属于离子晶体,错误;123456789101112C项,在ZnS晶胞中,1个S2-周围距离最近的Zn2+有4个,1个Zn2+周围距离最近的S2-有4个,则S2-的配位数为4,Zn2+的配位数也为4,错误;D项,ZnO和ZnS中,O2-的半径小于S2-的半径,离子所带的电荷数相等,所以ZnO的离子键键能大于ZnS,ZnO的熔点大于ZnS,正确。123456789101112√晶体中每个K+距离最近的K+有12个;设晶体中0价氧原子和-2价氧原子的个数分别为x、y,则有x+y=8,x×0+y×(-2)=-4,得x∶y=3∶1。1234567891011126.具有下列性质的物质可能属于离子晶体的是A.熔点113 ℃,能溶于CS2 B.熔点44 ℃,液态不导电C.熔点1 124 ℃,易溶于水 D.熔点180 ℃,固态能导电二、晶体类型与性质√解析 熔点113 ℃,能溶于CS2,这是分子晶体的性质,故A错误;熔点低,液态不导电,这是分子晶体的性质,故B错误;熔点较高,多数离子晶体易溶于水,此性质为离子晶体的性质,故C正确;离子晶体在固态时不导电,故D错误。1234567891011127.(2020·济南高二检测)离子晶体熔点的高低决定于阴、阳离子间离子键的强弱,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是A.KCl>NaCl>BaO>CaOB.NaCl>KCl>CaO>BaOC.CaO>BaO>KCl>NaClD.CaO>BaO>NaCl>KCl√123456789101112解析 对于离子晶体来说,离子所带电荷数越多,阴、阳离子间的核间距离越小,离子键越强,熔点越高。一般在阴、阳离子的核间距离相当时首先看离子所带电荷数,CaO、BaO所带电荷数都大于KCl、NaCl,所以CaO、BaO的熔点大于KCl、NaCl;其次在电荷数相当时,看阴、阳离子的核间距离,r(Ba2+)>r(Ca2+),熔点:CaO>BaO,r(K+)>r(Na+),熔点:NaCl>KCl。1234567891011128.下列比较正确的是A.化学键的键能由大到小:金刚石>碳化硅>硅B.熔、沸点由高到低:氯化钠>氧化镁>金刚石>二氧化碳C.硬度由大到小:C60>碳化硅>铁>氯化钠D.共价键的极性由强到弱:H—I键>H—Br键>H—Cl键√123456789101112解析 原子半径:C<Si,则化学键的键能由大到小:金刚石>碳化硅>硅,A正确;金刚石是共价晶体,氯化钠和氧化镁是离子晶体,二氧化碳是分子晶体,则熔、沸点由高到低:金刚石>氧化镁>氯化钠>二氧化碳,B错误;碳化硅是共价晶体,铁是金属晶体,氯化钠是离子晶体,C60是分子晶体,则硬度由大到小:碳化硅>铁>氯化钠>C60,C错误;非金属性:I<Br<Cl,则共价键的极性由弱到强:H—I键<H—Br键<H—Cl键,D错误。1234567891011129.(1)在①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石、⑦(NH4)2SO4、⑧乙醇中,由极性键形成的非极性分子有______(填序号,下同),含有金属离子的物质是______,分子间可形成氢键的物质是____,属于离子晶体的是_____,属于共价晶体的是_____,①~⑤五种物质的熔点由高到低的顺序是____________________。123456789101112①⑤②③⑧②⑦④⑥④>②>③>⑤>①解析 ①CO2、⑤CS2中只含有极性键,分子都是直线形分子,正负电荷中心重合,属于非极性分子;②NaCl由钠离子和氯离子构成;③Na由钠离子和自由电子构成,都含有金属离子;⑧乙醇中羟基氢与其他羟基上的氧原子能形成氢键;⑦(NH4)2SO4由铵根离子和硫酸根离子构成,属于离子化合物;离子化合物在固态时均为离子晶体;④Si、⑥金刚石都是由原子构成的共价晶体;123456789101112晶体的熔点:共价晶体>离子晶体>金属晶体>分子晶体,Si是共价晶体,熔点最高,CO2和CS2都是分子晶体,相对分子质量越大熔点越高,Na的熔点低于100 ℃,所以熔点由高到低的顺序为④>②>③>⑤>①。123456789101112(2)A、B、C、D为四种晶体,性质如下:A.固态时能导电,能溶于盐酸B.能溶于CS2,不溶于水C.固态时不导电,液态时能导电,可溶于水D.固态、液态时均不导电,熔点为3 500 ℃试推断它们的晶体类型:A.__________;B.__________;C._________;D._________。123456789101112金属晶体分子晶体离子晶体共价晶体解析 A固态时能导电,能溶于盐酸,应为活泼金属,属于金属晶体;B能溶于CS2,不溶于水,属于分子晶体;C固态时不导电,液态时能导电,可溶于水,属于离子晶体;D固态、液态时均不导电,熔点为3 500 ℃,属于共价晶体。123456789101112(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.________;B._______;C.________;D.__________________。123456789101112氯化铯氯化钠二氧化硅金刚石(或晶体硅)解析 由晶胞结构模型可知:在氯化铯晶体中,每个Cs+同时吸引8个Cl-,每个Cl-同时吸引8个Cs+,氯离子与铯离子数目之比为1∶1,故A为氯化铯;在氯化钠晶体中,每个Na+同时吸引着6个Cl-,每个Cl-同时吸引着6个Na+,氯离子与钠离子的数目之比为1∶1,故B为氯化钠晶体;123456789101112在二氧化硅晶体中,每个Si原子与4个O原子结合,每个O原子与2个Si原子结合,硅原子与氧原子的个数之比为1∶2,故C为SiO2;在金刚石晶体中,每个碳原子周围紧邻4个碳原子,最小碳环由6个碳原子组成,故D为金刚石(晶体硅的结构和金刚石相似)。123456789101112三、晶体结构的综合分析10.硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1 520 ℃。硒化锌晶体材料对热冲击具有很高的承受能力,使它成为高功率CO2激光器系统中的最佳光学材料。硒化锌的晶胞结构如图所示:(1)图中x和y点所堆积的原子均为____(填元素符号)。Zn123456789101112(2)若该晶胞密度为ρ g·cm-3,硒化锌的摩尔质量为M g·mol-1。用NA代表阿伏加德罗常数的值,则晶胞参数a=___________nm。解析 该晶胞中含有4个Zn2+、4个Se2-,12345678910111211.砷化镓是第二代半导体,熔点为1 238 ℃,具有空间网状结构,性能比硅更优良。砷化镓半导体材料的一个重要特性就是光电特性。由于它具有直接带隙以及宽禁带等结构,它的光发射效率比硅、锗等半导体材料高,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术。砷化镓晶体晶胞结构如图所示:(1)砷化镓属于_____晶体。(2)砷化镓与氮化硼属于同种晶体类型。则两种晶体熔点较高的是____,其理由是___________________________________________________________。共价BN二者均为共价晶体,B—N键的键长比Ga—As键的键长短,键能大123456789101112(3)Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________________________。123456789101112解析 该晶胞中含有4个Ga、4个As,则晶胞中原子的体积则GaAs晶胞中原子的体积占晶胞体积的百分率为12345678910111212.按要求回答下列问题。(1)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示,其中最小的环为____元环,每个环平均含有___个P原子。六2123456789101112(2)磷烯是新型二维半导体材料,具有类似石墨一样的片层结构(如图),层与层之间以________结合。从结构上看,单层磷烯导电性优于石墨烯的原因是_______________________________________________________________________________________________________________________________________________。范德华力 石墨烯同层碳原子中,1个碳原子和周围3个碳原子结合后,还剩1个外围电子,单层磷烯同层磷原子中,1个磷原子和周围3个磷原子结合后,还剩2个外围电子123456789101112(3)阳离子[(CH3)3NH]+和阴离子A按个数比4∶1组成化合物,阴离子A的结构如图所示,阴离子A的化学式为__________。[Ge4S10]4-解析 阴离子A中含有4个Ge和10个S,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,则A离子带有4个负电荷,即离子的化学式为[Ge4S10]4-。123456789101112(4)如图为钛酸钡晶体的晶胞结构,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。①写出该晶体的化学式:________。123456789101112BaTiO3②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的_____位置。123456789101112面心解析 根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上。③Ti4+的氧配位数和Ba2+的氧配位数分别为________。1234567891011126、12解析 根据晶胞的结构可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为6;立方晶胞12条棱上的12个O原子均与体心Ba2+等距,所以Ba2+的氧配位数为12。(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588 pm。①S2-的配位数为____。8解析 以最右面中心S2-分析,连接左边有4个锂离子,右边的晶胞中也应该有4个锂离子,因此配位数为8。123456789101112②设NA为阿伏加德罗常数的值,Li2S的晶胞密度为________________(列出计算式)g·cm-3。解析 设NA为阿伏加德罗常数的值,根据晶胞结构计算出锂离子有8个,硫离子有4个,123456789101112(6)A、B、C 为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A 单质晶体的晶胞结构如图1所示。B的外围电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的ds区,其基态原子不存在不成对电子。B与C所形成化合物晶体的晶胞如图2所示。①A 单质晶体属于_____(填晶体类型)晶体。共价123456789101112解析 A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图1所示,可知A为硅形成的晶体,属于共价晶体。123456789101112②B与C所形成化合物晶体的化学式为_____。ZnS解析 B的外围电子排布为(n+1)sn(n+1)pn+2,有三个电子层,最外层有6个电子,B为S原子,C位于元素周期表的ds区,其基态原子不存在不成对电子,为Zn原子,由晶胞图知B与C所形成化合物晶体的化学式为ZnS。123456789101112本课结束
相关资料
更多









