高中化学苏教版(2021) 选择性必修2 专题3 第四单元 微专题3 常见晶体结构的比较与分析-同步学案
展开微专题3 常见晶体结构的比较与分析
1.常见共价晶体结构的分析
晶体 | 晶体结构 | 结构分析 |
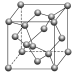
金刚石 |
| (1)每个C与相邻4个C以共价键结合,形成正四面体结构 (2)键角均为109°28′ (3)最小碳环由6个C组成且6个C不在同一平面内 (4)每个C参与4个C—C键的形成,C原子数与C—C键数之比为1∶2 (5)ρ= g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值) |
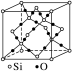
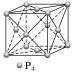
SiO2 |
| (1)每个Si与4个O以共价键结合,形成正四面体结构 (2)每个正四面体占有1个Si,4个“O”,因此二氧化硅晶体中Si与O的个数比为1∶2 (3)最小环上有12个原子,即6个O,6个Si (4)ρ= g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值) |
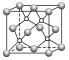
SiC、BP、AlN |
| (1)每个原子与另外4个不同种类的原子形成正四面体结构 (2)密度:ρ(SiC)= g· cm-3; ρ(BP)= g·cm-3; ρ(AlN)= g· cm-3(a为晶胞边长,NA为阿伏加德罗常数的值) |
2.常见分子晶体结构的分析
晶体 | 晶体结构 | 结构分析 |
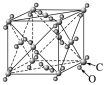
干冰 |
| (1)8个CO2分子占据立方体顶角且在6个面的面心又各有1个CO2分子 (2)每个CO2分子周围紧邻的CO2分子有12个 (3)ρ= g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值) |
白磷 |
| ρ= g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值) |
3.常见离子晶体结构的分析
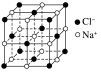
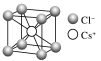
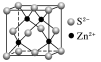
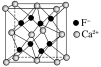
| NaCl型 | CsCl型 | ZnS型 | CaF2型 |
晶胞 |
|
|
|
|
配位数 | 6 | 8 | 4 | F-:4;Ca2+:8 |
密度的计算(a为晶胞边长,NA为阿伏加德罗常数的值) | g·cm-3 | g·cm-3 | g·cm-3 | g·cm-3 |
![]()
1.AB型化合物形成的晶体结构多种多样。下图所示的几种结构所表示的物质最有可能是分子晶体的是( )

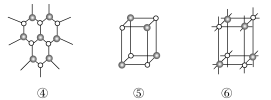
A.①③ B.②⑤
C.⑤⑥ D.③④⑤⑥
答案 B
解析 从各图中可以看出②⑤都不能再以化学键与其他原子结合,所以最有可能是分子晶体。
2.下列关于晶体的说法中,不正确的是( )
①含有金属阳离子的晶体一定是离子晶体;
②共价键可决定分子晶体的熔、沸点;
③MgO和NaCl两种晶体中,MgO的离子键键能较小,所以其熔点比较低;
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列;
⑤晶体中的晶胞尽可能采取紧密堆积方式,以使其变得比较稳定;
⑥干冰晶体中,一个CO2分子周围有12个CO2分子紧邻
A.①②③ B.②③⑥
C.④⑤⑥ D.②③④
答案 A
解析 ①含有金属阳离子的晶体不一定是离子晶体,如金属晶体中含有金属阳离子,错误;②共价键可决定共价晶体的熔、沸点,分子晶体的熔、沸点的高低是由分子间作用力的大小决定的,错误;③MgO和NaCl两种晶体中,MgO的离子键键能较大,所以其熔点比较高,错误;④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,正确;⑤晶体中的晶胞是无隙并置排列的,尽可能采取紧密堆积方式,以使其变得比较稳定,正确;⑥干冰晶体中,一个CO2分子周围有12个CO2分子紧邻,正确。
3.如图所示是从NaCl或CsCl的晶胞结构中分割出来的部分结构图,其中属于从NaCl晶胞中分割出来的结构图是( )
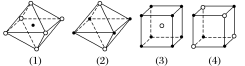
A.图(1)和(3) B.图(2)和(3)
C.图(1)和(4) D.只有图(4)
答案 C
解析 NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体,同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图,C项正确。
4.有关晶体(或晶胞)的结构如图所示,下列说法不正确的是( )
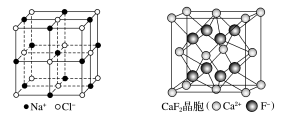
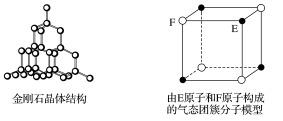
A.在NaCl晶体中,距Na+最近的Cl-有6个
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数之比为1∶2
D.该气态团簇分子的分子式为EF或FE
答案 D
解析 在NaCl晶体中,距Na+最近的Cl-有6个,故A正确;在CaF2晶胞中,Ca2+位于晶胞的顶点和面心,晶胞中含有Ca2+的个数为8×+6×=4,故B正确;在金刚石晶体中,每个碳原子连接4个共价键,每两个碳原子形成一个共价键,则每个碳原子连接的共价键平均为4×=2,所以在金刚石晶体中,碳原子与碳碳键个数之比为1∶2,故C正确;气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D错误。
5.如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体(或晶胞)的结构示意图,请回答下列问题:

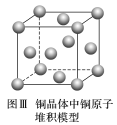
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________,图Ⅲ中一个铜原子周围紧邻的铜原子数为________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数之比为________。
(3)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为________________。
答案 (1)8 12 (2)O 1∶6 (3)H3BO3 分子间作用力
解析 (1)从图Ⅰ面心上的一个Ca2+可看出连接四个F-,若将旁边的晶胞画出,也应连四个F-,则一个Ca2+连有8个F-。(2)H原子是两电子,B原子从图Ⅱ看,只形成三个共价键,应为6个电子,只有O原子为8电子。H3BO3属于分子晶体,一个B连有三个O原子,三个O原子又连有三个H原子,所以一个B原子对应6个极性键。(3)熔点大小一般规律:共价晶体>离子晶体>分子晶体,金属晶体看具体情况,此题H3BO3为分子晶体,熔点最低,熔化时破坏分子间作用力。