
北京市丰台区2022-2023学年高三下学期一模考试化学试卷(word版,含答案)
展开北京市丰台区2022-2023学年高三下学期一模考试
化 学
2023.03
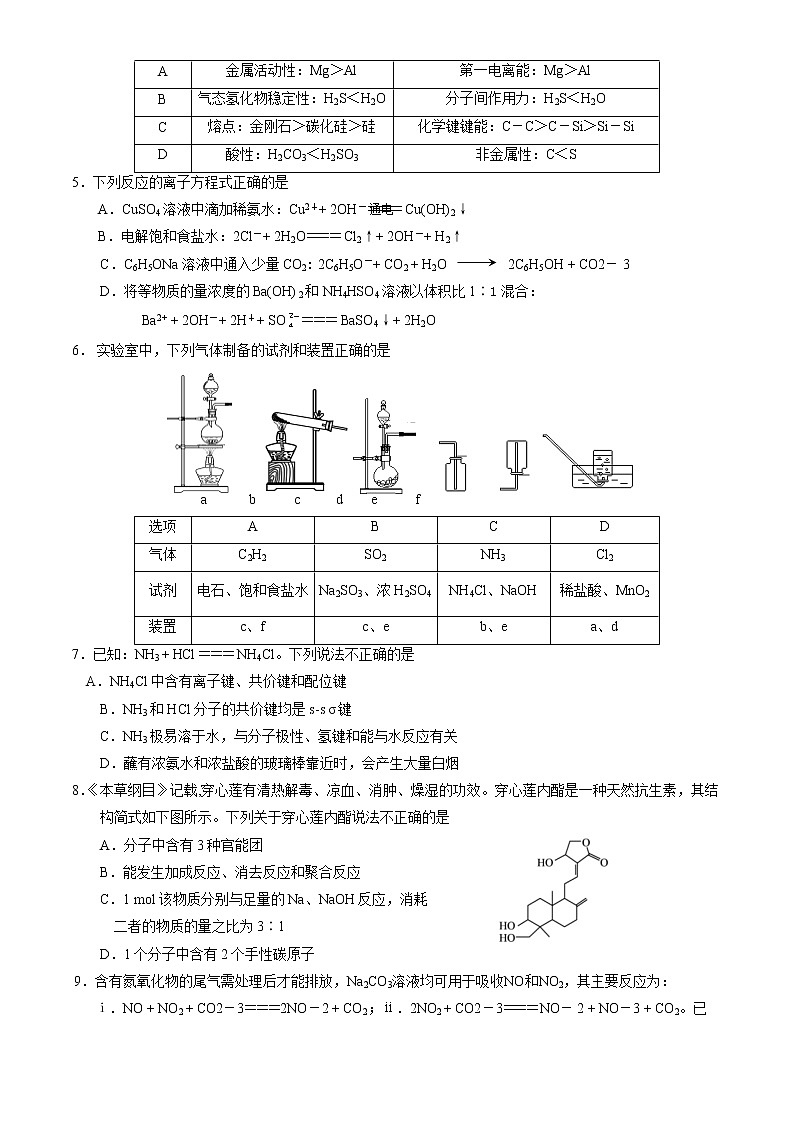
本试卷共9页,100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Fe 56 Ni 59 Zn 65
第一部分(选择题 共42分)
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.下列用途与所述的化学知识没有关联的是
选项
用途
化学知识
A
用小苏打作发泡剂烘焙面包
Na2CO3可与酸反应
B
电热水器用镁棒防止内胆腐蚀
牺牲阳极(原电池的负极反应物)保护法
C
用84消毒液对图书馆桌椅消毒
含氯消毒剂具有强氧化性
D
用Na2O2作呼吸面具中的制氧剂
Na2O2能与H2O和CO2反应
2.下列化学用语或图示表达正确的是
A.Cr元素基态原子的价电子排布式:3d44s2
B. NaOH的电子式:
C.葡萄糖的结构简式:C6H12O6
D.乙烯分子中的π键:
3.导航卫星的原子钟被称为卫星的“心脏”,目前我国使用的是铷原子钟。已知,自然界存在两种铷原子85Rb和87Rb, 87Rb具有放射性。下列说法不正确的是
A.Rb位于元素周期表中第六周期、第ⅠA族
B.可用质谱法区分85 Rb和87 Rb
C.85 Rb和87 Rb是两种不同的核素
D.87Rb的化合物也具有放射性
4.下列原因分析能正确解释性质差异的是
选项
性质差异
原因分析
A
金属活动性:Mg>Al
第一电离能:Mg>Al
B
气态氢化物稳定性:H2S<H2O
分子间作用力:H2S<H2O
C
熔点:金刚石>碳化硅>硅
化学键键能:C-C>C-Si>Si-Si
D
酸性:H2CO3<H2SO3
非金属性:C<S
5.下列反应的离子方程式正确的是
通电
A.CuSO4溶液中滴加稀氨水:Cu2++ 2OH-=== Cu(OH)2↓
B.电解饱和食盐水:2Cl-+ 2H2O=== Cl2↑+ 2OH-+ H2↑
C.C6H5ONa溶液中通入少量CO2: 2C6H5O-+ CO2 + H2O 2C6H5OH + CO2- 3
D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶1混合:
Ba2+ + 2OH-+ 2H++ SO=== BaSO4↓+ 2H2O
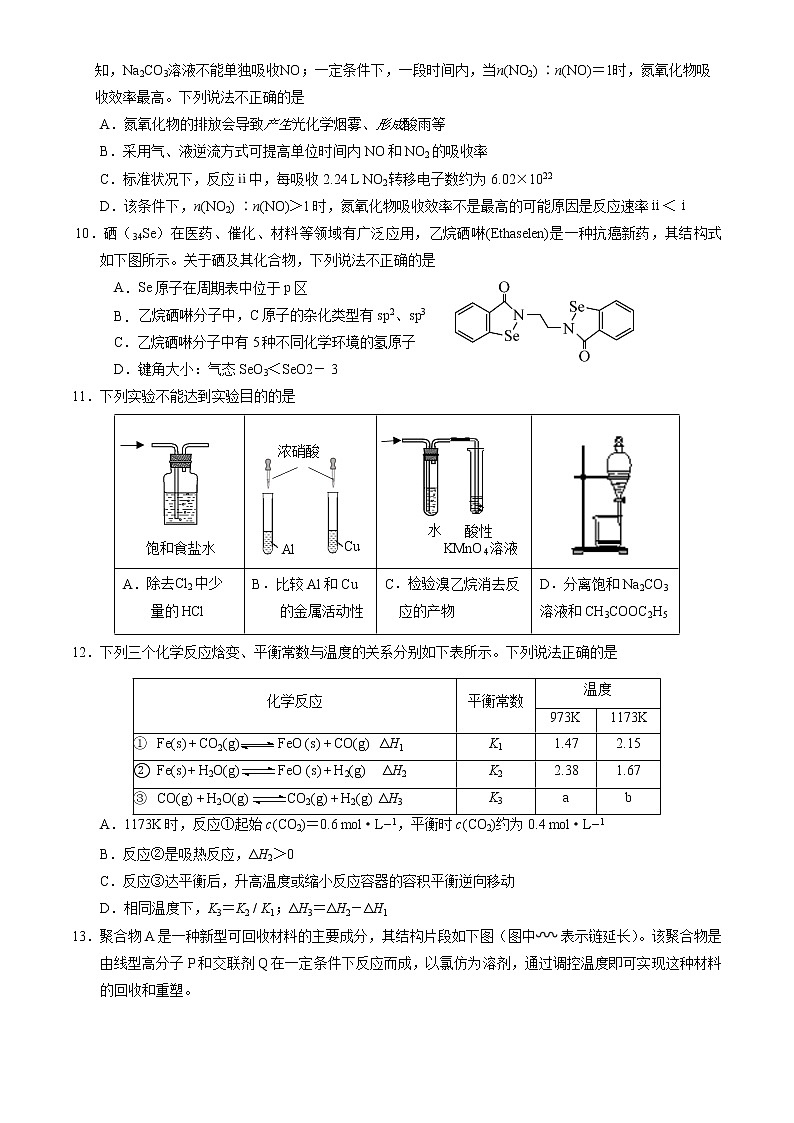
6. 实验室中,下列气体制备的试剂和装置正确的是
a b c d e f
选项
A
B
C
D
气体
C2H2
SO2
NH3
Cl2
试剂
电石、饱和食盐水
Na2SO3、浓H2SO4
NH4Cl、NaOH
稀盐酸、MnO2
装置
c、f
c、e
b、e
a、d
7.已知:NH3 + HCl === NH4Cl。下列说法不正确的是
A.NH4Cl中含有离子键、共价键和配位键
B.NH3和HCl分子的共价键均是s-s σ键
C.NH3极易溶于水,与分子极性、氢键和能与水反应有关
D.蘸有浓氨水和浓盐酸的玻璃棒靠近时,会产生大量白烟
8.《本草纲目》记载,穿心莲有清热解毒、凉血、消肿、燥湿的功效。穿心莲内酯是一种天然抗生素,其结构简式如下图所示。下列关于穿心莲内酯说法不正确的是
A.分子中含有3种官能团
B.能发生加成反应、消去反应和聚合反应
C.1 mol 该物质分别与足量的Na、NaOH反应,消耗
二者的物质的量之比为3∶1
D.1个分子中含有2个手性碳原子
9.含有氮氧化物的尾气需处理后才能排放,Na2CO3溶液均可用于吸收NO和NO2,其主要反应为:ⅰ.NO + NO2 + CO2-3=== 2NO-2 + CO2;ⅱ.2NO2 + CO2-3=== NO- 2 + NO-3 + CO2。已知,Na2CO3溶液不能单独吸收NO;一定条件下,一段时间内,当n(NO2) ∶n(NO)=1时,氮氧化物吸收效率最高。下列说法不正确的是
A.氮氧化物的排放会导致产生光化学烟雾、形成酸雨等
B.采用气、液逆流方式可提高单位时间内NO和NO2的吸收率
C.标准状况下,反应ⅱ中,每吸收2.24 L NO2转移电子数约为6.02×1022
D.该条件下,n(NO2) ∶n(NO)>1时,氮氧化物吸收效率不是最高的可能原因是反应速率ⅱ<ⅰ
10.硒(34Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下图所示。关于硒及其化合物,下列说法不正确的是
A.Se原子在周期表中位于p区
B. 乙烷硒啉分子中,C原子的杂化类型有sp2、sp3
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:气态SeO3<SeO2- 3
11.下列实验不能达到实验目的的是
饱和食盐水
浓硝酸
Al
Cu
水
酸性
KMnO4溶液
A.除去 Cl2 中少量的HCl
B.比较Al和Cu的金属活动性
C.检验溴乙烷消去反应的产物
D.分离饱和Na2CO3溶液和CH3COOC2H5
12.下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是
化学反应
平衡常数
温度
973K
1173K
① Fe(s) + CO2(g) FeO (s) + CO(g) ΔH1
K1
1.47
2.15
② Fe(s) + H2O(g) FeO (s) + H2(g) ΔH2
K2
2.38
1.67
③ CO(g) + H2O(g) CO2(g) + H2(g) ΔH3
K3
a
b
A.1173K时,反应①起始c(CO2)=0.6 mol·L-1,平衡时c(CO2)约为 0.4 mol·L-1
B.反应②是吸热反应,ΔH2>0
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,K3=K2 / K1;ΔH3=ΔH2-ΔH1
13.聚合物A是一种新型可回收材料的主要成分,其结构片段如下图(图中表示链延长)。该聚合物是由线型高分子P和交联剂Q在一定条件下反应而成,以氯仿为溶剂,通过调控温度即可实现这种材料的回收和重塑。
已知:ⅰ.n +nM P+xH2O
+
∆H<0
ⅱ.
下列说法不正确的是
A.M为1,4-丁二酸
B.交联剂Q的结构简式为
C.合成高分子化合物P的反应属于缩聚反应,其中x=n-1
D.通过先升温后降温可实现这种材料的回收和重塑
14.某小组研究SCN-分别与Cu2+和Fe3+的反应。
编号
1
2
3
实验
2 mL 0.5 mol·L-1
CuSO4溶液
2 mL 0.1 mol·L-1
KSCN溶液
2 mL 0.25 mol·L-1
Fe2(SO4)3溶液
2 mL 0.1 mol·L-1
KSCN溶液
盐桥
石墨
石墨
0.125 mol·L-1
Fe2(SO4)3溶液
0.05 mol·L-1
KSCN溶液
V
现象
溶液变为黄绿色,产生白色沉淀(白色沉淀为CuSCN)
溶液变红,向反应后的溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,且沉淀量逐渐增多
接通电路后,电压表指针不偏转。一段时间后,取出左侧烧杯中少量溶液,滴加K3[Fe(CN)6]溶液,没有观察到蓝色沉淀
下列说法不正确的是
A.实验1中发生了氧化还原反应,KSCN为还原剂
B.实验2中“溶液变红”是Fe3+与SCN-结合形成了配合物
C.若将实验3中Fe2(SO4)3溶液替换为0. 25 mol·L-1 CuSO4溶液,接通电路后,可推测出电压表指针会发生偏转
D.综合实验1~3,微粒的氧化性与还原产物的价态和状态有关
第二部分(非选择题 共58分)
本部分共5题,共58分。
15.(11分)含氮化合物具有非常广泛的应用。
(1)基态氮原子的电子有 种空间运动状态。
(2)很多有机化合物中含有氮元素。
物质
A(对氨基苯甲酸)
B(邻氨基苯甲酸)
结构简式
熔点
188℃
145℃
作用
防晒剂
制造药物及香料
① 组成物质A的4种元素的电负性由大到小的顺序是 。
② A的熔点高于B的原因是 。
③ A可以与多种过渡金属元素形成不同结构的配合物。其中A和Ag+可形成链状结构,在下图虚线内画出A的结构简式。
Ag
Ag
(3)氮元素可以与短周期金属元素形成化合物。Mg3N2是离子化合物,比较两种微粒的半径:Mg2+ N3-(填“>”、“<”或“=”)。
(4)氮元素可以与过渡金属元素形成化合物,其具备高硬度、高化学稳定性和优越的催化活性等性质。某三元氮化物是良好的超导材料,其晶胞结构如图所示。
① 基态Ni原子价层电子的轨道表示式为 。
② 与Zn原子距离最近且相等的Ni原子有________个。
③ NA表示阿伏伽德罗常数的值。若此晶体的密度为ρ g·cm-3,则晶胞的边长为
nm。(1 nm=10-7 cm)
16.(10分)煤化学链技术具有成本低、能耗低的CO2捕集特性。以铁矿石(主要含铁物质为Fe2O3)为载氧体的煤化学链制氢工艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
空气反应器
煤
燃烧反应器
蒸汽反应器
H2
铁矿石
还原产物
制氢产物
空气
氧化产物
H2O(g)
H2O(g)
CO2
(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是 。
(2)分离燃烧反应器中产生的H2O(g)和CO2,可进行CO2高纯捕集和封存,其分离方法是 。
(3)测定铁矿石中全部铁元素含量。
ⅰ.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡(SnCl2)溶液。
ⅱ.用重铬酸钾(K2Cr2O7)标准液滴定可测定样品中全部铁元素含量。
配制铁矿石待测液时SnCl2溶液过量会对测定结果产生影响,分析影响结果及其原因 _____ 。
(4)测定燃烧反应后产物中单质铁含量:取a g样品,用FeCl3溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b mol·mol-1 K2Cr2O7溶标准液,消耗K2Cr2O7标准液V mL。已知K2Cr2O7被还原为Cr3+,样品中单质铁的质量分数为 。
(5)工艺中不同价态铁元素含量测定结果如下。
① 制氢产物主要为Fe3O4,写出蒸汽反应器中发生反应的化学方程式 。
② 工艺中可循环使用的物质是 (填化学式)。
17.(14分)依匹哌唑M( )是一种多巴胺活性调节剂,其合成路线如下:
P2O5
H
C7H9NO
一定
条件
CH3I
试剂a
K2CO3
CH3OH
催化剂
-H2O
试剂b
K2CO3,DMF
E
C6H12O4
B
K
CH3OH
Et3N
-HCl
加成
C
C5H7O2Cl
D
C5H8O3
G
C6H7NO2
F
C6H6O2
L
NH3
△
A
C4H8O
HCl
DMSO
I
M
J
已知:ⅰ. CH3OH,Et3N
ⅱ. R1—X + R2—NH2K2CO3,DMF
R1—NH—R2(R表示H或烃基)
ⅲ. 试剂b的结构简式为
(1)A分子中含有的官能团名称是__________。
(2)C为反式结构,其结构简式是__________。
(3)D→E的化学方程式是__________。
(4)G的结构简式是__________;G→H的反应类型为__________。
(5)K转化为L的过程中,K2CO3可吸收生成的HBr,则试剂a的结构简式是__________。
(6)X是E的同分异构体,写出满足下列条件的X的结构简式__________。
a.1 mol X 与足量的Na反应可产生2 mol H2
b.核磁共振氢谱显示有3组峰
(7)由化合物N( )经过多步反应可制备试剂b,其中Q→W过程中有CH3OH生成,写出P、W的结构简式__________、__________。
P2O5
+
Q
P
-H2O
-HBr
HCl
DMSO
试剂b
N
W
18.(11分)赤泥硫酸铵焙烧浸出液水解制备偏钛酸[TiO(OH)2]可回收钛。
已知:ⅰ.一定条件下,Ti4+水解方程式:Ti4++3H2O TiO(OH)2 +4H+
ⅱ.一定温度下:Ksp[Fe(OH)2]=4.9´10-17; Ksp[Fe(OH)3]=2.6´10-39
I.赤泥与硫酸铵混合制取浸出液。
(1)用化学用语表示(NH4)2SO4溶液呈酸性的原因________。
II. 水解制备偏钛酸:浸出液中含Fe3+、Ti4+等,先向其中加入还原铁粉,然后控制水解条件实现Ti4+水解制备偏钛酸。
(2)浸出液(pH=2)中含有大量Fe3+,若杂质离子沉淀会降低钛水解率。从定量角度解释加入还原铁粉的目的 。
(3)一定条件下,还原铁粉添加比对钛水解率的影响如图1所示。当还原铁粉添加比大于1时,钛水解率急剧下降,解释其原因________。
备注:还原铁粉添加比=n铁粉/ n理论;n铁粉为还原铁粉添加量,n理论为浸出液中 Fe3+全部还原为Fe2+所需的还原铁粉理论量。
(4)一定条件下,温度对钛水解率的影响如图2所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因________。
III.电解制备钛:偏钛酸煅烧得到二氧化钛(TiO2),运用电化学原理在无水CaCl2熔盐电解质中电解TiO2得到海绵钛,装置如图3所示。
图3
(5)电极X连接电源______(填“正”或“负”)极。
(6)写出电极Y上发生的电极反应式________。
19.(12分)某小组实验探究不同条件下KMnO4溶液与Na2SO3溶液的反应。
已知:ⅰ.MnO- 4在一定条件下可被还原为:MnO2-4(绿色)、Mn2+(无色)、MnO2(棕黑色)。
ⅱ.MnO2- 4在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
实验
序号
物质a
实验现象
4 滴物质a
6滴(约0.3 mL)0.1 mol·L-1 Na2SO3溶液
2 mL 0.01 mol·L-1KMnO4溶液
Ⅰ
3 mol·L-1 H2SO4溶液
紫色溶液变浅至几乎无色
Ⅱ
H2O
紫色褪去,产生棕黑色沉淀
Ⅲ
6 mol·L-1 NaOH溶液
溶液变绿,一段时间后绿色消失,产生棕黑色沉淀
(1)实验Ⅰ~Ⅲ的操作过程中,加入Na2SO3溶液和物质a时,应先加 。
(2)实验Ⅰ中,MnO- 4的还原产物为________。
(3)实验Ⅱ中发生反应的离子方程式为________。
(4)已知:可从电极反应角度分析物质氧化性和还原性的变化。用电极反应式表示实验Ⅲ中溶液变绿时发生的氧化反应________。
(5)解释实验Ⅲ中“一段时间后绿色消失,产生棕黑色沉淀”的原因________。
(6)若想观察KMnO4溶液与Na2SO3溶液反应后溶液为持续稳定的绿色,设计实验方案。
(7)改用0.1 mol·L-1KMnO4溶液重复实验Ⅰ,发现紫色溶液变浅并产生棕黑色沉淀,写出产生棕黑色沉淀的离子方程式 。
参考答案
第一部分(选择题 共42分)
1
2
3
4
5
6
7
A
D
A
C
B
A
B
8
9
10
11
12
13
14
D
C
D
B
D
C
C
第二部分(非选择题 共58分)
15.(11分)(1)5 (1分)
(2)①O>N>C>H(1分)
②B易形成分子内氢键,A只存在分子间氢键,影响物质熔点的是分子间氢键,所以A的熔点高于B。(2分)
③(2分,合理给分)
Ag
Ag
(3)<(1分)
↑↓
↑↓
↑↓
↑
↑
↑↓
(4)①
3d 4s
(1分)
② 12 (1分) ③3256/ NAρ ×107 (2分)
16.(10分)(1)增大接触面积,升高温度,提高化学反应速率(2分)
(2)冷凝(1分)
(3)过量的SnCl2能与K2Cr2O7反应,导致测定结果(铁元素含量)偏高(2分)
高温
高温
(4)0.112bV/a (2分)
(5)①3Fe+4H2O=== Fe3O4+4H2; 3FeO+H2O=== Fe3O4+H2(2分)
②Fe2O3(H2O)(1分)
17.(14分)(1)碳碳双键 醚键(2分) (2) (2分)
催化剂
(3) (2分)
(4) OH
(2分) 取代 (1分) (5) (2分)
(6) (1分)
(7)P: (1分) W: (1分)
18.(11分)(1)NH4+ + H2O NH3·H2O + H+(2分)
(2)pH=2时,Fe2+转化为Fe(OH)2沉淀需要的浓度为8×108 mol·L-1 ;Fe3+转化为Fe(OH)3沉淀需要的浓度为2.8×10﹣3 mol·L-1,加铁粉将Fe3+还原为Fe2+,防止Fe3+优先发生水解生成氢氧化铁沉淀,阻碍Ti4+的水解反应,导致钛水解率下降。 (2分)
(3)还原铁粉添加比过大时,过量的还原铁粉将浸出液中的Ti(Ⅳ)还原为Ti(Ⅲ),从而造成钛水解率降低。(2分)
(4)浸出液存在Ti4+水解平衡:Ti4+ + 3H2O TiO(OH)2 + 4H+ ,水解吸热,升高温度时,水解平衡正移,钛水解率升高。(2分)
(5)正(1分)
(6)TiO2+4e﹣=== Ti + 2O2﹣(2分)
19.(12分)
(1)物质a(1分)(2)Mn2+(1分)
(3)2MnO﹣ 4+3SO2﹣ 3+ H2O=== 2MnO2 + 3SO2﹣4+2OH-(2分)
(4)SO2﹣ 3-2e-+2OH-=== SO2﹣4+ H2O(2分)
(5)生成的MnO2﹣ 4继续氧化未反应完的SO2- 3导致绿色消失,产生棕黑色沉淀,MnO2﹣ 4+ SO2- 3+H2O=== MnO2 + SO2﹣4+2OH-。(2分)
(6)向2 mL 0.01 mol·L-1KMnO4溶液滴加4滴6 mol·L-1 NaOH溶液,再滴加2滴(约0.1 mL)0.1 mol·L-1 Na2SO3溶液。(合理给分)(2分)
(7)2MnO﹣ 4+3Mn2++ 2H2O === 5 MnO2 +4H+(2分)
北京市丰台区2023届高三化学二模试题(Word版附解析): 这是一份北京市丰台区2023届高三化学二模试题(Word版附解析),共25页。试卷主要包含了5 Mn, 下列离子方程式书写正确的是, 电化学的应用领域非常广泛等内容,欢迎下载使用。
北京市西城区2022-2023学年高三下学期一模考试化学试卷(word版,含答案): 这是一份北京市西城区2022-2023学年高三下学期一模考试化学试卷(word版,含答案),共10页。试卷主要包含了6×10−12 Ksp=1,3,不同温度下反应的结果如图等内容,欢迎下载使用。
北京市朝阳区2022-2023学年高三下学期一模考试化学试卷(word版,含答案): 这是一份北京市朝阳区2022-2023学年高三下学期一模考试化学试卷(word版,含答案),共11页。试卷主要包含了5 Fe 56,0×10−12,Ksp=1,2 ml·L−1,21等内容,欢迎下载使用。












