






还剩15页未读,
继续阅读
第四章第四节 玻尔的原子模型课件 高二下学期物理人教版(2019)选择性必修第三册
展开
这是一份第四章第四节 玻尔的原子模型课件 高二下学期物理人教版(2019)选择性必修第三册,共23页。
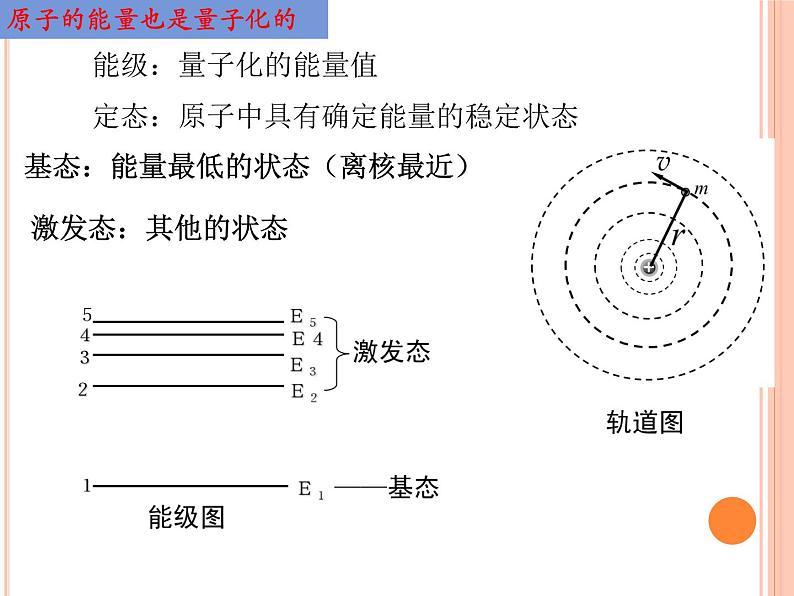
波尔的原子模型正课讲授小题练习本科总结内容索引1885 年,玻尔出生于丹麦哥本哈根。他的父亲是哥本哈根大学一名杰出的生理学教授,母亲出生于一个在银行、政治和教育各界中均很活跃的富有犹太人家庭。父母从小便很关心玻尔,使他的天赋得以充分发挥。 1903 年,玻尔入读哥本哈根大学,主修物理学。玻尔尚未毕业时,便巳经锋芒毕露,他通过观察喷射的水流就能精密测量出水的表面张力。 1909 年,玻尔获理科硕士学位,1911 年获哲学博士学位。他的博士论文《金属电子论的研究》定性地说明了金属的各种性质。他察觉到经典理论的缺陷,并证明了金属的磁性决不能用这些原理解释。结束在哥本哈根大学的学习后,玻尔前往英国剑桥大学,想在汤姆孙的指导下继续研究电子论,但是汤姆孙巳经对这个问题失去了兴趣。于是玻尔随即转往曼彻斯特大学,在卢瑟福的实验室工作。1913 年,他发表了三篇论文,把当时的原子结构模型与量子论结合起来,揭开了物理学崭新的一页。 认识波尔玻尔原子理论假设的基础1.普朗克黑体辐射的量子论 2.爱因斯坦的光量子论经典物理学无法解释原子的稳定性,也无法解释光谱的分立特性。 为了解决这个矛盾,1913年丹麦物理学家N.玻尔在卢瑟福学说的基础上,把普朗克的量子理论运用到原子系统上,提出了玻尔理论。 1.围绕原子核运动的电子轨道半径只能是某些分立的数值,这些现象叫做轨道量子化; 2.不同的轨道对应着不同的状态,在这些状态中,尽管电子在做变速运动,却不辐射能量,因此这些状态是稳定的; 3.原子在不同的状态之中具有不同的能量,所以原子的能量也是量子化的。玻尔提出的原子结构假设 玻尔认为,原子中电子在库仑引力的作用下,绕原子核做圆周运动。但电子运行轨道的半径不是任意的,只有当半径大小符合一定条件时,这样轨道才是可能的。电子在轨道上绕核的转动是稳定的,不产生电磁辐射。假说1:轨道量子化(1)围绕原子核运动的电子轨道半径只能是某些分立的数值,这些现象叫做轨道量子化;(2)不同的轨道对应着不同的状态,在这些状态中,尽管电子在做变速运动,却不辐射能量,因此这些状态是稳定的;玻尔原子理论的基本假设 当电子在不同的轨道上运动时,原子处于不同的状态中,具有不同的能量,这些量子化的能量值叫做能级。 原子中这些具有确定能量的稳定状态,称为定态。 能量最低的状态叫做基态,其他的状态叫做激发态。 原子处于基态是最稳定的。假说2:能量量子化能级:量子化的能量值定态:原子中具有确定能量的稳定状态基态:能量最低的状态(离核最近)激发态:其他的状态原子的能量也是量子化的假说3:频率条件(跃迁假说) 电子从能量较高的定态轨道Em跃迁到能量较低的定态轨道En(m>n)时,会放出能量为hν的光子,hν=Em-En ; 反之,电子从较低的能量态En跃迁到较高的能量态Em,吸收能量为hν的光子,光子的hν=Em-En 。 电子从一种定态轨道(设能量为Em)跃迁到另一种定态(设能量为En)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即: 吸收光子辐射光子玻尔理论对氢光谱的解释r1 = 0.053 nm 1.轨道半径:2.能级公式:E1代表氢原子的基态能级,即电子在离核最近的轨道上运动时原子的能量值, E1=-13.6eV,n为正整数,叫做量子数。n越大,表示能级越高。(2)这里的电势能 Ep<0,原因是规定了无限远处的电势能为零。这样越是里面轨道电势能越少,负得越多。 TIPS(3)量子数 n = 1定态,能量值最小,电子动能最大,电势能最小;量子数越大,能量值越大,电子动能越小,电势能越大。3.频率条件(跃迁假说)轨道半径减小,库仑引力做正功,原子的电势能减小,电子动能增大,原子能量减小轨道半径增大,库仑引力做负功,原子电势能增大,电子动能减小,原子能量增大 电子从一种定态轨道(设能量为Em)跃迁到另一种定态(设能量为En)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即:hv=Em-En(1)从低能级向高能级跃迁:①吸收光子5.氢原子的两类能级跃迁:1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。电离条件:2)光子使原子跃迁光子的能量必须等于能级差,才能被吸收。跃迁条件:吸收能量hv≥E∞-Enhv=Em-En②吸收实物粒子能量 只要实物粒子能量足以使氢原子向高能级跃迁,就能被氢原子全部吸收或部分吸收而使氢原子向高能级跃迁,多余能量仍为实物粒子动能。2)实物粒子使原子跃迁:实物粒子的能量可以全部或部分被吸收,需要多少,吸收多少。多余的能量由实物粒子自己保留。1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。(2)从高能级向低能级跃迁(自发跃迁):放出能量 处于激发态的原子是不稳定的,电子可自发地经过一次或几次跃迁到达基态。跃迁时以发射光子的形式向外释放能量。现有大量氢原子处于n=3能级上,下列说法正确的是( C )A.这些原子跃迁过程中最多可辐射出2种频率的光子B.从n=3能级跃迁到n=1能级比跃迁到n=2能级辐射的光子频率低C.从n=3能级跃迁到n=4能级需吸收0.66 eV的能量D.n=3能级的氢原子电离至少需要吸收13.6 eV的能量氢原子能级示意图如图所示。光子能量在1.63 eV~3.10 eV的光为可见光。要使处于基态(n=1)的氢原子被激发后可辐射出可见光光子,最少应给氢原子提供的能量为( )A.12.09 eV B.10.20 eVC.1.89 eV D.1.51 eV光子能量为12.75 eV的一束光照射处于基态的大量氢原子,大量氢原子将发生能级跃迁,发出的光可能有几种频率 ( )A.3种 B.4种 C.5种 D.6种一群处于基态的氢原子吸收某种频率的光子后,向外辐射了ν1、ν2、ν3三种频率的光子,且ν1>ν2>ν3,则( )A.被氢原子吸收的光子的能量为hν1B.被氢原子吸收的光子的能量为hν2C.被氢原子吸收的光子的能量为hν3D.被氢原子吸收的光子的能量为hν1+hν2+hν3大量处于n=4激发态的氢原子向低能级跃迁时能辐射出多种不同频率的光,其中用从n=4能级向n=2能级跃迁时辐射的光照射如图乙所示光电管的阴极K时,电路中有光电流产生,则( )A.改用从n=4能级向n=1能级跃迁时辐射的光照射,一定能使阴极K发生光电效应B.改用从n=3能级向n=1能级跃迁时辐射的光照射,不能使阴极K发生光电效应C.改用从n=4能级向n=1能级跃迁时辐射的光照射,逸出光电子的最大初动能不变D.入射光的强度增大,逸出光电子的最大初动能也增大1.定态:原子只能处于一系列 的能量状态中,在这些能量状态中原子是 的,电子虽然绕核运动,但并不向外辐射能量。 2.跃迁:原子从一种定态跃迁到另一种定态时,它 或 一定频率的光子,光子的能量由这两个定态的能量差决定,即hν= 。(h是普朗克常量,h=6.626×10-34 J·s) 3.轨道:原子的不同能量状态跟电子在不同的圆周轨道绕核运动相对应。原子的定态是不连续的,因此电子的可能轨道也是 的。 4.氢原子的能级、能级公式(1)氢原子的能级图(如图所示)(2)氢原子的能级和轨道半径①氢原子的能级公式:En= E1(n=1,2,3,…),其中E1为基态能量,其数值为E1=-13.6 eV。②氢原子的轨道半径公式:rn=n2r1(n=1,2,3,…),其中r1为基态半径,又称玻尔半径,其数值为r1=0.53×10-10 m。O(∩_∩)O谢谢
波尔的原子模型正课讲授小题练习本科总结内容索引1885 年,玻尔出生于丹麦哥本哈根。他的父亲是哥本哈根大学一名杰出的生理学教授,母亲出生于一个在银行、政治和教育各界中均很活跃的富有犹太人家庭。父母从小便很关心玻尔,使他的天赋得以充分发挥。 1903 年,玻尔入读哥本哈根大学,主修物理学。玻尔尚未毕业时,便巳经锋芒毕露,他通过观察喷射的水流就能精密测量出水的表面张力。 1909 年,玻尔获理科硕士学位,1911 年获哲学博士学位。他的博士论文《金属电子论的研究》定性地说明了金属的各种性质。他察觉到经典理论的缺陷,并证明了金属的磁性决不能用这些原理解释。结束在哥本哈根大学的学习后,玻尔前往英国剑桥大学,想在汤姆孙的指导下继续研究电子论,但是汤姆孙巳经对这个问题失去了兴趣。于是玻尔随即转往曼彻斯特大学,在卢瑟福的实验室工作。1913 年,他发表了三篇论文,把当时的原子结构模型与量子论结合起来,揭开了物理学崭新的一页。 认识波尔玻尔原子理论假设的基础1.普朗克黑体辐射的量子论 2.爱因斯坦的光量子论经典物理学无法解释原子的稳定性,也无法解释光谱的分立特性。 为了解决这个矛盾,1913年丹麦物理学家N.玻尔在卢瑟福学说的基础上,把普朗克的量子理论运用到原子系统上,提出了玻尔理论。 1.围绕原子核运动的电子轨道半径只能是某些分立的数值,这些现象叫做轨道量子化; 2.不同的轨道对应着不同的状态,在这些状态中,尽管电子在做变速运动,却不辐射能量,因此这些状态是稳定的; 3.原子在不同的状态之中具有不同的能量,所以原子的能量也是量子化的。玻尔提出的原子结构假设 玻尔认为,原子中电子在库仑引力的作用下,绕原子核做圆周运动。但电子运行轨道的半径不是任意的,只有当半径大小符合一定条件时,这样轨道才是可能的。电子在轨道上绕核的转动是稳定的,不产生电磁辐射。假说1:轨道量子化(1)围绕原子核运动的电子轨道半径只能是某些分立的数值,这些现象叫做轨道量子化;(2)不同的轨道对应着不同的状态,在这些状态中,尽管电子在做变速运动,却不辐射能量,因此这些状态是稳定的;玻尔原子理论的基本假设 当电子在不同的轨道上运动时,原子处于不同的状态中,具有不同的能量,这些量子化的能量值叫做能级。 原子中这些具有确定能量的稳定状态,称为定态。 能量最低的状态叫做基态,其他的状态叫做激发态。 原子处于基态是最稳定的。假说2:能量量子化能级:量子化的能量值定态:原子中具有确定能量的稳定状态基态:能量最低的状态(离核最近)激发态:其他的状态原子的能量也是量子化的假说3:频率条件(跃迁假说) 电子从能量较高的定态轨道Em跃迁到能量较低的定态轨道En(m>n)时,会放出能量为hν的光子,hν=Em-En ; 反之,电子从较低的能量态En跃迁到较高的能量态Em,吸收能量为hν的光子,光子的hν=Em-En 。 电子从一种定态轨道(设能量为Em)跃迁到另一种定态(设能量为En)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即: 吸收光子辐射光子玻尔理论对氢光谱的解释r1 = 0.053 nm 1.轨道半径:2.能级公式:E1代表氢原子的基态能级,即电子在离核最近的轨道上运动时原子的能量值, E1=-13.6eV,n为正整数,叫做量子数。n越大,表示能级越高。(2)这里的电势能 Ep<0,原因是规定了无限远处的电势能为零。这样越是里面轨道电势能越少,负得越多。 TIPS(3)量子数 n = 1定态,能量值最小,电子动能最大,电势能最小;量子数越大,能量值越大,电子动能越小,电势能越大。3.频率条件(跃迁假说)轨道半径减小,库仑引力做正功,原子的电势能减小,电子动能增大,原子能量减小轨道半径增大,库仑引力做负功,原子电势能增大,电子动能减小,原子能量增大 电子从一种定态轨道(设能量为Em)跃迁到另一种定态(设能量为En)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即:hv=Em-En(1)从低能级向高能级跃迁:①吸收光子5.氢原子的两类能级跃迁:1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。电离条件:2)光子使原子跃迁光子的能量必须等于能级差,才能被吸收。跃迁条件:吸收能量hv≥E∞-Enhv=Em-En②吸收实物粒子能量 只要实物粒子能量足以使氢原子向高能级跃迁,就能被氢原子全部吸收或部分吸收而使氢原子向高能级跃迁,多余能量仍为实物粒子动能。2)实物粒子使原子跃迁:实物粒子的能量可以全部或部分被吸收,需要多少,吸收多少。多余的能量由实物粒子自己保留。1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。(2)从高能级向低能级跃迁(自发跃迁):放出能量 处于激发态的原子是不稳定的,电子可自发地经过一次或几次跃迁到达基态。跃迁时以发射光子的形式向外释放能量。现有大量氢原子处于n=3能级上,下列说法正确的是( C )A.这些原子跃迁过程中最多可辐射出2种频率的光子B.从n=3能级跃迁到n=1能级比跃迁到n=2能级辐射的光子频率低C.从n=3能级跃迁到n=4能级需吸收0.66 eV的能量D.n=3能级的氢原子电离至少需要吸收13.6 eV的能量氢原子能级示意图如图所示。光子能量在1.63 eV~3.10 eV的光为可见光。要使处于基态(n=1)的氢原子被激发后可辐射出可见光光子,最少应给氢原子提供的能量为( )A.12.09 eV B.10.20 eVC.1.89 eV D.1.51 eV光子能量为12.75 eV的一束光照射处于基态的大量氢原子,大量氢原子将发生能级跃迁,发出的光可能有几种频率 ( )A.3种 B.4种 C.5种 D.6种一群处于基态的氢原子吸收某种频率的光子后,向外辐射了ν1、ν2、ν3三种频率的光子,且ν1>ν2>ν3,则( )A.被氢原子吸收的光子的能量为hν1B.被氢原子吸收的光子的能量为hν2C.被氢原子吸收的光子的能量为hν3D.被氢原子吸收的光子的能量为hν1+hν2+hν3大量处于n=4激发态的氢原子向低能级跃迁时能辐射出多种不同频率的光,其中用从n=4能级向n=2能级跃迁时辐射的光照射如图乙所示光电管的阴极K时,电路中有光电流产生,则( )A.改用从n=4能级向n=1能级跃迁时辐射的光照射,一定能使阴极K发生光电效应B.改用从n=3能级向n=1能级跃迁时辐射的光照射,不能使阴极K发生光电效应C.改用从n=4能级向n=1能级跃迁时辐射的光照射,逸出光电子的最大初动能不变D.入射光的强度增大,逸出光电子的最大初动能也增大1.定态:原子只能处于一系列 的能量状态中,在这些能量状态中原子是 的,电子虽然绕核运动,但并不向外辐射能量。 2.跃迁:原子从一种定态跃迁到另一种定态时,它 或 一定频率的光子,光子的能量由这两个定态的能量差决定,即hν= 。(h是普朗克常量,h=6.626×10-34 J·s) 3.轨道:原子的不同能量状态跟电子在不同的圆周轨道绕核运动相对应。原子的定态是不连续的,因此电子的可能轨道也是 的。 4.氢原子的能级、能级公式(1)氢原子的能级图(如图所示)(2)氢原子的能级和轨道半径①氢原子的能级公式:En= E1(n=1,2,3,…),其中E1为基态能量,其数值为E1=-13.6 eV。②氢原子的轨道半径公式:rn=n2r1(n=1,2,3,…),其中r1为基态半径,又称玻尔半径,其数值为r1=0.53×10-10 m。O(∩_∩)O谢谢
相关资料
更多









