






人教版 (五四制)八年级全册第五单元 化学方程式课题1 质量守恒定律教学课件ppt
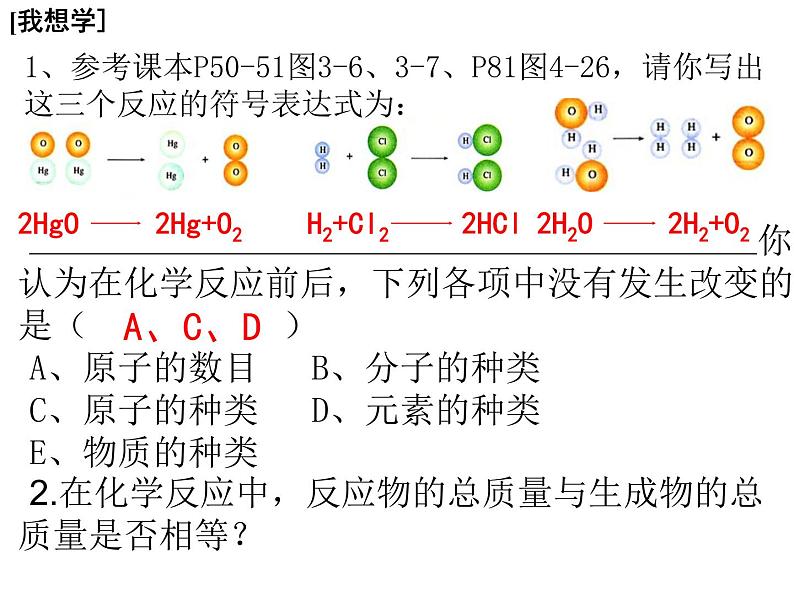
展开1、参考课本P50-51图3-6、3-7、P81图4-26,请你写出这三个反应的符号表达式为:
[探究与突破] 1.活动与探究1 白磷燃烧
[温馨提示]白磷燃烧的温度很低,易自燃,且有剧毒,故实验室中白磷保存在水中,取用白磷时要用镊子夹取,切不可用手直接取用。
白磷燃烧前后的对比思考:
白磷质量 + 氧气质量 = 五氧化二磷质量
反应前的总质量等于反应后的总质量
铁钉跟硫酸铜溶液反应前后质量总和的测定
化学反应前后物质的总质量是否相等?
2.活动与探究2 铁钉与硫酸铜溶液反应
通过分析上述两个实验的结果,你能得出什么结论?无数实验证明:参加化学反应的各物质的质量总和, 反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
3.质量守恒定律理解质量守恒定律——“参加” 的各物质的 等于反应后生成的各物质的 。那么,已知12克碳与32克氧气恰好完全反应,则生成CO2的质量为 克;若12克碳与64克氧气充分反应,生成CO2的质量为 克。若12克碳与640克或6400克氧气充分反应,生成CO2的质量为 克。[温馨提示]质量守恒定律指的是“参加”反应的各物质的质量总和,而不是有多少反应物,一定注意“参加”二字的真正含义。[大家都来动动脑2]100克水和100克酒精混合后总质量等于200克,所以这个过程符合质量守恒定律。你认为这种看法正确吗? ,原因是 。[温馨提示]质量守恒定律的前提是发生化学反应,对于 变化则不适用。
[大家都来动动脑3]根据质量守恒定律可知:“2升氢气在1升的氧气中燃烧可生成3升水蒸气”你认为这种看法正确吗? ,原因是 。 [温馨提示]化学反应遵守的是 定律, 不守恒。 [我乐学1] 1.已知24g木炭与64g氧气恰好完全反应,则生成二氧化碳的质量是( ) A.88g B.24g C.64g D.40g 2.在A+B=C+D的反应中,7gA和10gB恰好完全反应生成8gD,那么同时生成C的质量是( ) A.7g B.8g C.9g D.10g
是不是所有的化学反应都有这种规律呢?有没有特殊的情况?
质量守恒定律是否对任何化学反应都适用?
[探究与突破]4.活动与探究3 碳酸钠与盐酸反应
[大家都来动动脑4]造成天平不平衡的原因是 ,能否由此证明此反应不遵守质量守恒定律? 。本实验要在什么样的条件下进行反应,才能使天平保持平衡? 。
产生的气体扩散到空气里去了
固体粉末溶解,有大量的气泡产生;
天平指针向右倾斜(变轻)
碳酸钠与盐酸的反应前后的质量测定
如何证明稀盐酸和碳酸钠应前后物质的总质量相等呢?
稀盐酸和碳酸钠反应前后为什么天平不平衡呢?
该反应在密闭容器中进行
在开放容器中:盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳
M1 > M2
盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳 M1 = M2
5.活动与探究4 镁条燃烧
[大家都来动动脑5]造成天平不平衡的原因是 ,能否由此证明此反应不遵守质量守恒定律? 。本实验要在什么样的条件下进行反应,才能使天平保持平衡? 。
产生的固体粉末扩散到空气里去了
[我会学] 1、质量守恒定律——参加化学反应的各物质的“ ”,等于反应后生成的各物质的“ ”。若用有气体参加反应或有气体生成的化学反应来证明质量守恒定律,则反应一定要在 中进行。2、所有化学反应均遵守 ,但如木炭燃烧变成灰烬质量却变轻,钢铁生锈却变重,这是为什么?不遵守质量守恒定律吗?所以若有形式上不遵守质量守恒的情况,一定是有某些物质 。3、对质量守恒定律的理解中要注意:①只要是化学反应都遵守“ ”;②化学反应遵守的是“ ”守恒,“ ”不守恒;③反应物的总质量是指“ ”反应的;④反应物与生成物的质量总和,不能遗漏或少算,特别注意的是气体。4、为什么化学反应遵守质量守恒定律?请你从讲学稿的开头三个图加以说明,相信你能。教材P95页也说明了这个问题,请你阅读一遍。
把握质量守恒定律应注意几点
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!2、 “参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。3、“各物质” 即每一种反应物和生成物(不要因为状态而忽略) 4、质量守恒而不是体积守恒
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
为什么化学反应前后的各物质的质量总和相等呢?
在一切化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化。所以反应前后各物质的质量总和必然相等。
质量守恒定律的实质教材 P95
[复习导学]1、请回答质量守恒定律的内容并说明原因及化学反应前后的变与不变。内容: 。原因: 。不变的是: 、 、 、 、 。变的是: 、 。可能变的是: 。2、请写出下列两个反应的文字表达式和符号表达式。①木炭在氧气中燃烧:文字表达式: 符号表达式: ②硫磺燃烧:文字表达式: 符号表达式: ③请你将这两个表达式读出来。
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
反应前后原子的种类、原子的数目没有增减,原子的质量也没有变化
[深入学习]1、将上述反应的符号表达式中的箭头改写成等号就成了化学方程式,那什么是化学方程式?
2、从化学方程式A:“C+O2
CO2”和B:“S+O2
中你能获得的信息是:宏观上:A ,B , 微观上:A ,B , 由此可知化学方程式的意义有:①宏观上表示 ;②微观上表示 。于是,化学方程式的读法有:①宏观上(质读法)A ,B 。②微观上(微观读法)A ,B 。
用化学式来表示化学反应的式子
碳和氧气点燃生成二氧化碳
硫和氧气点燃生成二氧化硫
一个碳原子和一个氧分子点燃生成一个二氧化碳分子
一个硫原子和一个氧分子点燃生成一个二氧化硫分子
表示反应物、生成物及反应条件
表示反应物和生成物之间的微粒个数比
每一个碳原子和一个氧分子点燃生成一个二氧化碳分子
每一个硫原子和一个氧分子点燃生成一个二氧化硫分子
3、告诉你相对原子质量,C:12,O:16,S:32,请算出A:“C+O2 CO2”和B:“S+O2 SO2”中各物质的相对分子质量比,写在相应化学式的下方: C + O2 CO2 S + O2 SO2( ) :( ) :( ) ( ) :( ) :( )
以上是从化学方程式中获得的第三个方面的信息,也是第三个意义:③质量上表示: 。于是,化学方程式的第三种读法是:③质量上(量读法)A ,B 。
表示反应物和生成物之间的质量比
每12份质量的碳和32份质量的氧气点燃生成44份质量的二氧化碳
每32份质量的硫和32份质量的氧气点燃生成64份质量的二氧化硫
[当堂练习]1、请阅读教材P97页“讨论”,化学方程式:(1)铁与硫酸铜溶液的反应 Fe+CuSO4==Cu+ FeSO4,(Fe:56,Cu:64,S:32,O:16)①宏观上(质读法) ;②微观上(微观读法) ;③质量上(量读法) 。化学方程式:(2)粗铜丝表面的氧化铜与氢气在加热条件下反应:CuO+H2 Cu+ H2O, ,(H:1,Cu:64,O:16) ①宏观上(质读法) ;②微观上(微观读法) ;③质量上(量读法) 。
铁和硫酸铜反应生成铜和硫酸亚铁
每个铁原子和一个硫酸铜分子反应生成一个铜原子和一个硫酸亚铁分子
每56份质量的铁和160份质量的硫酸铜反应生成64份质量的铜和152份质量的硫酸亚铁
氧化铜和氢气加热生成铜和水
每个氧化铜分子和一个氢分子加热生成一个铜原子和一个水分子
每80份质量的氧化铜和2份质量的氢气加热生成64份质量的铜和18份质量的水
化学方程式:(3)实验室用加热氯酸钾来制氧气:2KClO3 2KCl+3O2↑,①宏观上(质读法) ;②微观上(微观读法) ;③质量上(量读法) 。2、下列说法中,符合质量守恒定律的是( )A.电解18g水可得9g氢气和9g氧气 B.12g的碳与12g氧气反应生成24g二氧化碳C.8g氧气与1g氢气化合生成9g水 D.16g氧气与12g碳反应生成28g二氧化碳3、30gA和30gB反应时,B完全反应,生成45gC,则A、B、C三种物质在上述反应中的质量比为( ) A.2:2:3 B.1:2:9 C 1:2:3 D.3:2:54、将a g一氧化碳和b g氧气通入密闭容器中点燃,充分反应后,生成二氧化碳的质量为( )A.一定为(a+b)g B.大于(a+b)g C.小于(a+b)g D.不大于(a+b)g
氯酸钾在二氧化锰催化和加热的共同作用下生成氯化钾和氧气
每2个氯酸钾分子在二氧化锰催化和加热的共同作用下,生成2个氯化钾分子和3个氧气分子。
每245份质量氯酸钾在二氧化锰催化和加热的共同作用下,生成149份质量氯化钾和96份质量氧气。
5、请写出下列反应的符号表达式:(1)、氢气在氯气中燃烧生成氯化氢(2)、水在通电的情况下分解(3)、氧化汞受热分解成汞和氧气若要将上述符号表达式写成化学方程式,你能行吗?是不是将“→”直接改成“==”就成了化学方程式?为什么?
参考课本P50-51图3-6、3-7、P81图4-26,相信你能写出这三个反应的化学方程式:
以上化学方程式中“2HCl”、“2H2O”、“ 2H2”、“2HgO”、“ 2Hg”的“2”是如何写出来的?为什么要有“2”?依据是什么?且听下个课题分解。
内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
原因:反应前后原子的种类、数目、质量都没有改变
信息:反应物、反应条件、生成物;参加反应的各粒子的相对数量;反应前后质量守恒等等。
初中化学第二节 元素多媒体教学课件ppt: 这是一份初中化学第二节 元素多媒体教学课件ppt,共20页。PPT课件主要包含了考考你,谈一谈,反馈练习等内容,欢迎下载使用。
八年级全册课题1 空气评课课件ppt: 这是一份八年级全册课题1 空气评课课件ppt,共24页。PPT课件主要包含了空气成分,纯净物和混合物,氧气的用途,氮气的用途,稀有气体的用途,火力发电厂,保护空气等内容,欢迎下载使用。
初中化学鲁教版 (五四制)八年级全册第四单元 我们周围的空气第二节 氧气教课课件ppt: 这是一份初中化学鲁教版 (五四制)八年级全册第四单元 我们周围的空气第二节 氧气教课课件ppt,共21页。PPT课件主要包含了氧气的物理性质,-183℃,-218℃,液态氧,固态氧,淡蓝色液体,淡蓝色,炭与氧气的反应,变浑浊,实验结论等内容,欢迎下载使用。













