





还剩7页未读,
继续阅读
所属成套资源:新鲁科版高中化学必修第二册课件PPT+同步练习全册
成套系列资料,整套一键下载
第2章 第2节 第1课时 化学反应中的能量变化的本质及转化形式(课件PPT)
展开
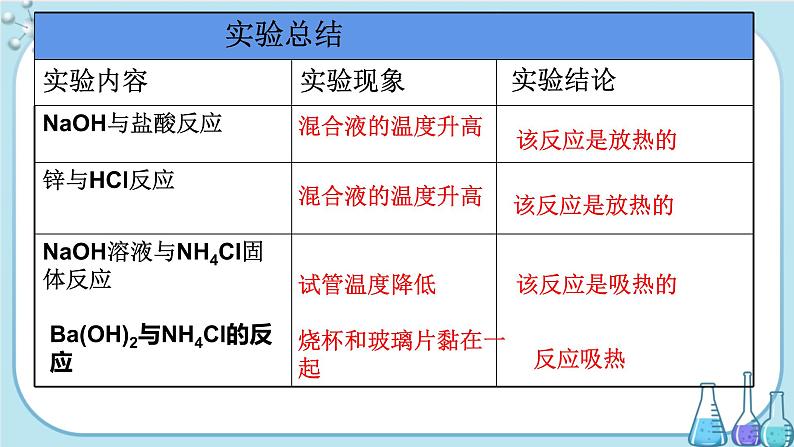
第1课时 化学反应中的能量变化的本质及转化形式化学反应与能量转化第2章第节 2学习目标1.了解化学反应中存在的能量变化及实质。2.知道常见的吸热反应与放热反应。实验一 NaOH与盐酸反应 依次取NaOH溶液与盐酸各2 mL于试管中,振荡试管,立即用手感受温度的变化。利用下列实验来感受化学反应中的 能量变化实验二 锌粉与盐酸反应 取2-3颗锌粒放入试管中,再量取约3mL盐酸倒入试管,感受温度的变化。实验三 NaOH溶液与NH4Cl固体的反应 取一匙的氯化铵固体于试管中,再加约 2mL的NaOH溶液,振荡,感受温度的变化。实验 Ba(OH)2晶体与NH4Cl晶体的反应 在玻璃片上加少量的水,将一个小烧杯放在玻璃片上。称取Ba(OH)2晶体18 g、NH4Cl晶体6 g都倒入烧杯中。用玻璃棒将Ba(OH)2晶体与NH4Cl晶体搅拌使之混合均匀。约3 min~5 min后,用手小心地提起烧杯,看烧杯与玻璃片是否黏在一起。混合液的温度升高该反应是放热的混合液的温度升高该反应是放热的试管温度降低该反应是吸热的Ba(OH)2与NH4Cl的反应烧杯和玻璃片黏在一起反应吸热一、化学反应的又一种分类方法分类依据:能量变化放热反应:吸热反应:释放能量的化学反应吸收能量的化学反应为什么会有能量的变化?!E吸 > E放 反应吸收能量E吸 < E放 反应释放能量化学键是原子之间的强烈的相互作用,形成时会放出一定的能量,破坏时需要吸收一定的能量。二、能量变化的原因E1>E2时,反应 能量E1<E2时,反应 能量吸收放出 注意:任何化学反应均伴随能量变化,要么吸收能量要么放出能量。吸热反应放热反应从能量储存角度:E总(反)> E总(生)时, 能量E总(反)<E总(生)时, 能量放出吸收反应物反应物生成物生成物常见的放热反应:常见的吸热反应:反应吸热还是放热与反应条件无关!大多数化合反应燃烧反应 金属与酸的反应中和反应铝热反应大多数分解反应;C和CO2,C和H2O的反应 ;铵盐和碱的反应!——化学反应的过程中伴随着能量变化,通常表现为热量的变化吸、放热反应热量的计算:例如: 断裂1molH2的共价键需要吸收436kJ能量,断裂1molO2的共价键需吸收498kJ能量,形成1molH2O时释放930kJ能量,问该反应为吸热反应还是放热反应?有多少热量放出或吸收? 交流、研讨2HO形成1mol H2O的共价键释放930KJ能量吸收能量:放出能量:反应放出能量:436KJ+249KJ=685KJ930KJ245KJ小结多角度认识化学反应过程①从物质变化角度:_________________。 ②从原子与分子角度:________________。③从化学键的角度:化学反应是________________________。 ④从能量变化的角度:化学反应总是伴随着_________________ 。有新物质生成原子的重新组合旧化学键断裂,新化学键生成能量变化谢 谢!
相关资料
更多









