
2021-2022学年湖南省长郡中学高一(下)选考科目调研考试化学试卷(含答案解析)
展开2021-2022学年湖南省长郡中学高一(下)选考科目调研考试化学试卷
1. 2022北京冬奥会上各种新科技材料的使用是一大亮点,如含有石墨烯的智能服饰、芳纶战衣、“冰墩墩”制作材料和光导纤维等等。下列叙述错误的是( )
A. 火炬外壳的主要成分是碳纤维,碳纤维是有机高分子材料
B. 中国健儿将身披通过三维扫描技术定制的芳纶战衣出征:芳纶为有机高分子材料
C. 石墨烯是一种电阻率低、热导率高的具有优异性能的新型材料
D. “冰墩墩”总体的制作成分之一为PC聚碳酸酯,属于有机高分子材料
2. 下列有关化学用语表示正确的是( )
A. 羟基的电子式 B. 乙醇的结构式:
C. 丙烷分子的空间填充模型 D. 乙烯的结构简式CH2CH2
3. 宏观辨识与微观探析是化学学科核心素养之一。下列实验现象对应的离子方程式正确的是( )
A. 过量SO2通入滴有酚酞的NaOH溶液,溶液红色褪去:SO2+OH−=HSO 3−
B. 大理石与盐酸接触,产生无色气泡:CO 32−+2H+=CO2↑+H2O
C. CO2通入饱和Na2CO3溶液中出现浑浊现象:CO2+H2O+CO 32−=2HCO 3−
D. 铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体:2Fe+3Cu2+=3Cu+2Fe3+
4. 2021年10月16日,我国“长征二号F遥十三运载火箭”带着神舟十三号载人航天飞船成功发射,又一次将我们的航天员送入了天空。飞船的天线是用钛镍形状记忆合金制造的,工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:
反应①:2FeTiO3+6C+7Cl2高温2TiCl4+2FeCl3+6CO
反应②:在氩气环境中,2Mg+TiCl4高温Ti+2MgCl2
下列有关说法错误的是( )
A. 反应①中Cl2是氧化剂,C、FeTiO3是还原剂
B. 反应①中每生成标准状况下6.72L CO气体,转移0.7NA个电子
C. 反应②中Mg被氧化,TiCl4被还原
D. 反应①、②中钛元素的化合价都发生了变化
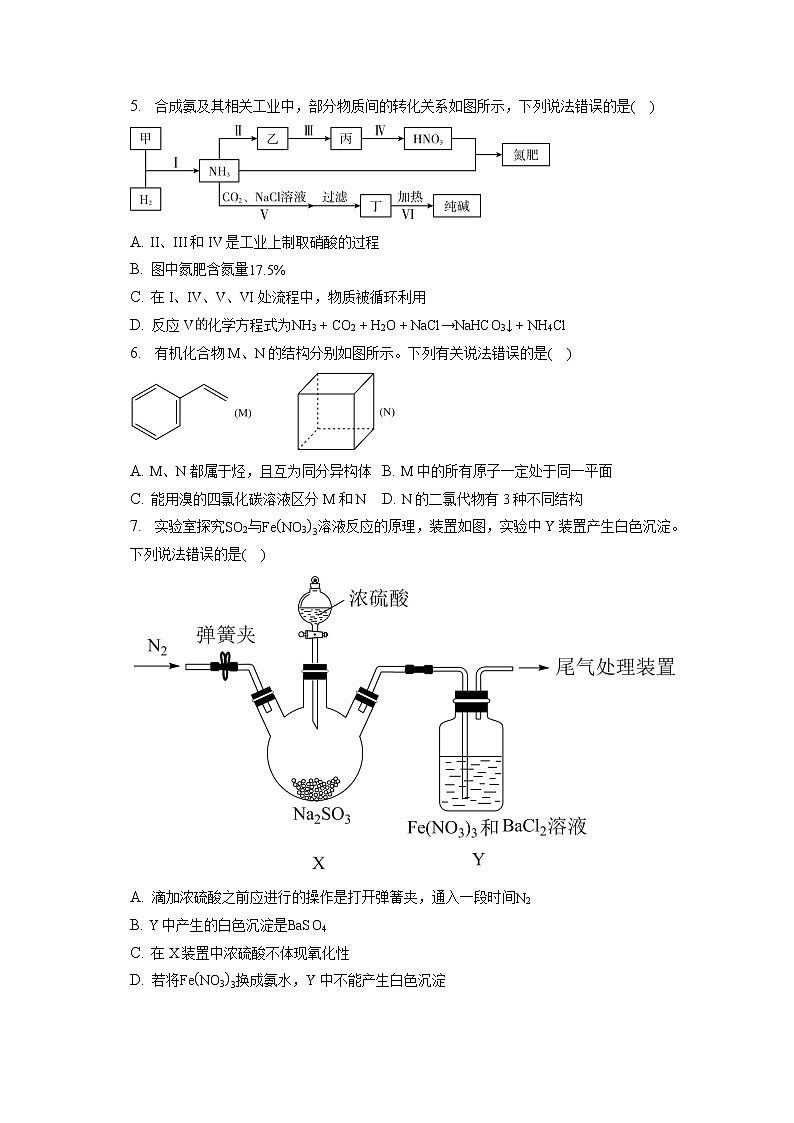
5. 合成氨及其相关工业中,部分物质间的转化关系如图所示,下列说法错误的是( )
A. II、III和IV是工业上制取硝酸的过程
B. 图中氮肥含氮量17.5%
C. 在I、IV、V、VI处流程中,物质被循环利用
D. 反应V化学方程式为NH3+CO2+H2O+NaCl→NaHCO3↓+NH4Cl
6. 有机化合物M、N的结构分别如图所示。下列有关说法错误的是( )
A. M、N都属于烃,且互为同分异构体 B. M中的所有原子一定处于同一平面
C. 能用溴的四氯化碳溶液区分M和N D. N的二氯代物有3种不同结构
7. 实验室探究SO2与FeNO33溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。下列说法错误的是( )
A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4
C. 在X装置中浓硫酸不体现氧化性
D. 若将FeNO33换成氨水,Y中不能产生白色沉淀
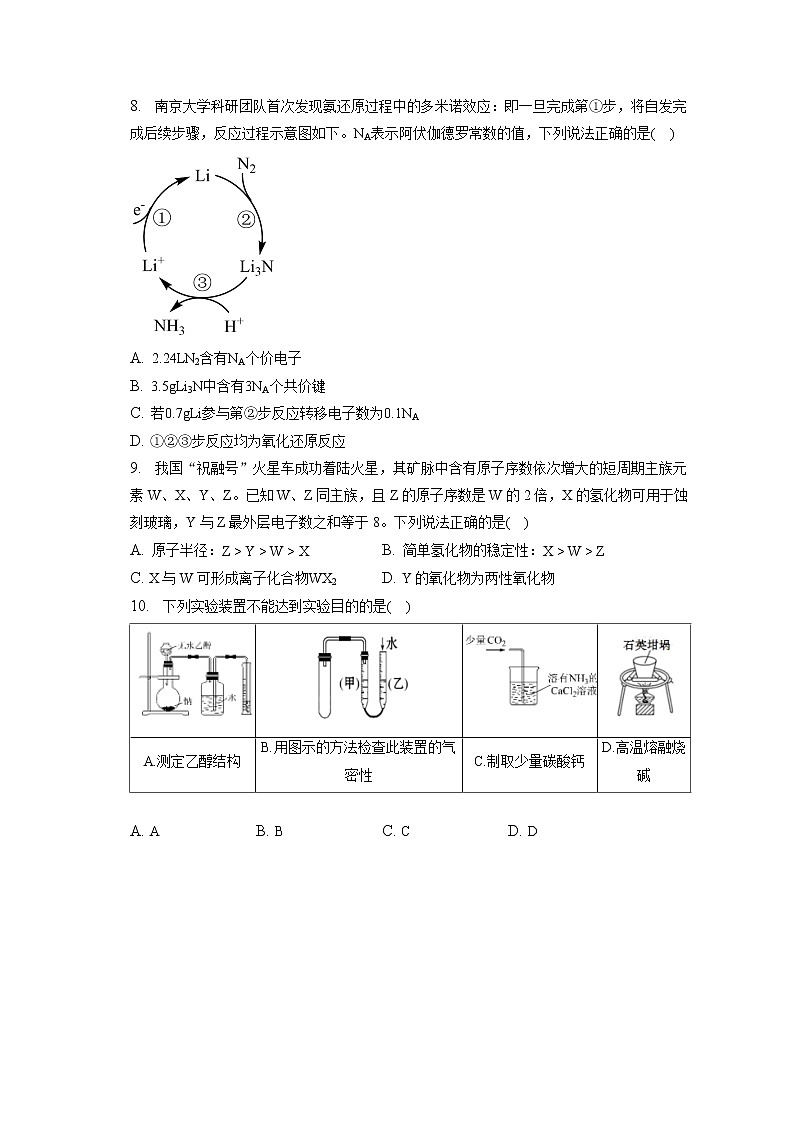
8. 南京大学科研团队首次发现氨还原过程中的多米诺效应:即一旦完成第①步,将自发完成后续步骤,反应过程示意图如下。NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 2.24LN2含有NA个价电子
B. 3.5gLi3N中含有3NA个共价键
C. 若0.7gLi参与第②步反应转移电子数为0.1NA
D. ①②③步反应均为氧化还原反应
9. 我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )
A. 原子半径:Z>Y>W>X B. 简单氢化物的稳定性:X>W>Z
C. X与W可形成离子化合物WX2 D. Y的氧化物为两性氧化物
10. 下列实验装置不能达到实验目的的是( )
A.测定乙醇结构
B.用图示的方法检查此装置的气密性
C.制取少量碳酸钙
D.高温熔融烧碱
A. A B. B C. C D. D
11. NO和O2混合后可发生反应:①2NO(g)+O2(g)=2NO2(g),②2NO2(g)⇌N2O4(g)反应体系中含氮物质的物质的量浓度(c)随着时间(t)的变化曲线如图。下列说法正确的是( )
A. c为c(NO2)随t的变化曲线
B. t1时,反应①达到化学平衡状态
C. t2时,c(NO)+c(NO2)+c(N2O4)=c0
D. t3后,NO2的消耗速率等于生成速率
12. 为实现“碳中和”,CO2的再利用非常关键,据文献报道CO2与H2可在Pd-Mg/SiO2催化下生成CH4,其反应机理如下图。下列说法正确的是( )
A. 过程中只涉及极性键的断开与形成
B. 反应过程中,既有氧化还原反应,又有非氧化还原反应
C. 图中涉及碳的价态没有发生变化
D. 总反应为CO2+4H2 Pd-Mg/SiO2 CH4+2H2O
13. 某新型纳米材料氧缺位铁酸盐ZnFe2Ox3
下列说法正确的是( )
A. 浸取时,为了提高酸浸效率,可以延长浸取时间或将稀硫酸换成浓硫酸
B. “除杂”过程中有加入足量锌粉等操作,与锌粉反应的离子只有Pb2+和Cu2+
C. 除去SO2时,ZnFe2Ox在反应中表现了还原性
D. ZnFe2O4与H2反应制得1molZnFe2Ox时转移电子(8−2x)mol
14. 在微生物参与下,采用惰性电极处理污水中有机物的某微生物燃料电池原理如图。下列说法错误的是( )
A. 有机物微生物作用下被氧化并释放质子
B. 升高温度可提高电池的能量转化效率
C. B极发生的电极反应为:O2+4H++4e−=2H2O、2NO3−+12H++10e−=N2↑+6H2O
D. 若该有机物为CH3OH,则反应32gCH3OH时转移5mole−
15. 冰雪天气中常使用融雪剂,某种融雪剂主要成分的化学式为XY2,X、Y为周期表1−20号内的元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54 mol电子。
(1)该融雪剂的化学式是_______;X与氢元素形成的化合物的电子式是_______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,D的单质易溶于D与E形成的一种液态化合物,该液态化合物分子的结构式为_______;D所在族元素的氢化物中,沸点最低的是_______。
(3)元素W与Y同周期,其单质晶体结构类似于金刚石;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是_______。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为_______。
16. 叠氮化钠(NaN3)是一种重要的化工产品,可用于合成抗生素头孢菌素药物和用作汽车安全气囊的气源。实验室可通过以下流程制备叠氮化钠并测定其纯度。请回答以下问题:
I.制备氨基钠(反应原理为: 2Na+2NH3加热2NaNH2+H2)实验装置如图甲。
已知:氨基钠极易与水剧烈反应生成氨气,且其易被空气氧化
(1)仪器a的名称为_______,实验开始时,应先打开分液漏斗使浓氨水流下,目的是_______。
(2)①B装置中的药品可选用_______。
A. P2O5 B.碱石灰 C.无水硫酸铜 D.无水氯化钙
②若无B装置,C中生成的氨基钠会发生的反应为_______(用化学方程式表示)。
(3)某同学认为上述实验设计有缺陷,请对装置提出改正措施_______。
II.制备NaN3
(4)将I中制备的NaNH2与N2O在210−220∘C的条件下反应生成NaN3、NaOH和氨气,反应容器不选用玻璃材质,请用化学方程式说明不选用玻璃材质的原因_______。
III.测定NaN3的纯度水
精确称量0.1500gNaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知: 2NaN3∼3N2(其他产物略),反应中放出大量的热。
(5)反应后对水量气管读数时,应注意
①_______
②调节水量气管和水准瓶中的液面相平
③视线平视凹液面
(6)常温下测得产生气体的体积为54.00mL(N2的密度为1.400g/L),计算NaN3样品的纯度为(质量分数)_______。
17. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:该工艺中,pH>6.0时,溶液中Mo元素以MoO42-的形态存在。
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为___________。
(2)“沉铝”中,生成的沉淀X的离子方程式___________。
(3)“沉钼”中,pH为7.0。生成BaMoO4的离子方程式为___________。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为___________(填化学式)。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量___________(填化学式)气体,再通入足量CO2,可析出Y。
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
①该氧化物为___________。
②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为___________。
18. 已知A是一种气态烃,其密度在标准状况下是H2的14倍。下列关系图中部分产物可能略去,试回答下列问题:
已知反应:R−X+NaOH→△R−OH+NaX(R代表烃基,X代表卤素原子)
(1)C分子的官能团的名称为_______。
(2)反应①∼⑦中属于取代反应的是_______。
(3)C与F以物质的量之比2:1反应生成G,反应④的化学方程式为_______。
(4)B物质可在催化剂作用下被空气中的氧气氧化为具有刺激性气味的物质,写出反应的化学方程式_______。
(5)聚苯乙烯的结构简式为_______。
(6)下列说法正确的是_______。
a.D在一定条件下可能会和水反应生成B和C
b.B和F属于同系物
c.A、B、F和I都能使酸性高锰酸钾溶液褪色
d.与E互为同分异构体的有机物只有1种
答案和解析
1.【答案】A
【解析】A.碳纤维是无机材料,不是有机高分子材料,A错误;
B.芳纶是芳香族聚酰胺纤维,属于有机高分子材料,B正确;
C.石墨烯是碳纳米材料,电阻率低、热导率高,是一种具有优异性能的新型材料,C正确;
D.“冰墩墩”的外套材料PC聚碳酸酯(聚合物)是高分子化合物,属于有机高分子材料,D正确;
答案选A。
2.【答案】B
【解析】A.羟基的电子式为,A错误;
B.乙醇的结构式为,B正确;
C.丙烷分子的球棍模型为,C错误;
D.乙烯的结构简式为CH2=CH2,D错误;
故答案选B。
3.【答案】A
【解析】A.二氧化硫为酸性氧化物,过量的SO2与NaOH溶液反应生成酸式盐和水,溶液红色褪去,其离子方程式为SO2 +OH− =HSO3−,故A正确;
B.大理石与盐酸接触,发生反应生成CaCl2、CO2和H2O,由于CaCO3难溶于水,在离子方程式中应保留化学式,其离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.CO2 通入饱和Na2CO3溶液中,二者发生反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则产生沉淀,即溶液出现浑浊,其离子方程式为CO2 +H2O+2Na++CO32−=2NaHCO3↓,故C错误;
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体,说明铁能与硫酸铜发生置换反应,即Fe与CuSO4发生反应,生成硫酸亚铁和Cu,其离子方程式为Fe+Cu2+=Fe2++Cu,故D错误;
答案为A。
4.【答案】D
【解析】A.FeTiO3中Fe显+2价,O显−2价,化合价的代数和为0,则Ti的价态为+4价,根据反应①,Cl2中Cl的化合价降低,Cl2为氧化剂,C的价态升高,C作还原剂,铁元素的价态升高,FeTiO3作还原剂,其余元素的化合价没发生变化,故A说法正确;
B.根据A选项分析,生成6molCO,转移电子物质的量为14mol,即每生成标准状况下6.72LCO气体,转移电子物质的量为6.72L22.4L/mol×146=0.7mol,故B说法正确;
C.反应②中Mg的化合价由0价升高为+2价,Mg为还原剂,TiCl4中Ti的化合价由+4价降低为0价,TiCl4为氧化剂,故C说法正确;
D.根据上述分析,反应①中Ti的价态没有发生变化,反应②中Ti的价态发生变化,故D说法错误;
5.【答案】B
【解析】氮气和氢气可以合成氨,所以甲是氮气,氨气和二氧化碳通入氯化钠溶液可以析出溶解度较小的碳酸氢钠晶体,加热分解可以得到碳酸钠纯碱;氨气和氧气反应,催化氧化得到NO,NO遇到氧气变为二氧化氮,二氧化氮和水之间反应生成硝酸,硝酸和氨气之间反应得到硝酸铵,属于一种氮肥,所以乙是NO,丙是NO2,丁是NaHCO3;
A、工业制硝酸是用氨气和氧气发生催化氧化反应生成NO,NO再与氧气反应生成NO2,二氧化氮和水之间反应生成硝酸,则II、III和IV是工业上制取硝酸的过程,故A正确;
B、图中氮肥是硝酸铵NH4NO3,含氮量14×214+1×4+14+16×3×100%=35%,故B错误;
C、反应I生成NH3循环利用,反应IV的NO2和水反应生成NO可进入III循环利用,反应V生成的NH4Cl受热分解NH3可循环利用,反应VI生成的碳酸氢钠受热分解生成纯碱、水和二氧化碳,二氧化碳在上述流程中能被再次利用,故C正确;
D、氨气和二氧化碳通入氯化钠溶液可以析出溶解度较小的碳酸氢钠晶体,发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故D正确。
故选B。
6.【答案】B
【解析】A.M、N的元素组成都是只有C、H两种元素,因此它们都属于烃,二者分子式都是C8H8,二者分子式相同,但结构不同,因此它们互为同分异构体,A正确;
B.苯环决定一个平面,乙烯分子决定一个平面,单键可以旋转,M的所有原子可能但不一定处于同一平面,B错误;
C.M分子中含有不饱和的碳碳双键,能够与溴发生加成反应而使溴的四氯化碳溶液褪色,而N分子中无不饱和键,因此不能使溴的四氯化碳溶液褪色,故可以用溴的四氯化碳溶液区分M和N,C正确;
D.N分子的二氯代物中两个Cl原子的位置:可以在相邻位置、面对角线位置和体对角线位置三种情况,因此其二氯代物有3种不同结构,D正确。
7.【答案】D
【解析】A.装置X的作用是产生SO2,为防止+4价S被氧化,需要先通入一段时间的N2,排除装置中的空气,故A说法正确;
B.酸性条件下,NO 3−能将SO2氧化成SO 42−,Fe3+也能将SO2氧化成SO 42−,SO 42−与Ba2+反应生成BaSO4沉淀,故B说法正确;
C.生成二氧化硫,体现浓硫酸的强酸性,浓硫酸遇水放出大量的热,有利于二氧化硫的逸出,故C说法正确;
D.换成氨水,SO2能与氨水反应生成SO 32−,SO 32−能与Ba2+反应生成BaSO3沉淀,故D说法错误;
答案为D。
8.【答案】C
【解析】A.2.24LN2的物质的量不确定,无法计算含有的价电子个数,A错误;
B.Li3N是离子化合物,只有离子键,B错误;
C.0.7gLi的物质的量是0.1mol,参与第②步反应时化合价从0价升高到+1价,则转移电子数为0.1NA,C正确;
D.第③步反应是氢离子和氨气反应生成铵根,是非氧化还原反应,D错误;
答案选C。
9.【答案】B
【解析】原子序数依次增大的短周期主族元素W、X、Y、Z,W、Z同主族,且Z的原子序数是W的2倍,则W为O,Z为S;X的氢化物可用于蚀刻玻璃,则X为F元素,Y与Z最外层电子数之和等于8,Y的最外层电子数为8−6=2,Z的原子序数大于Y,则Y为Mg元素,则W、X、Y、Z分别是O、F、Mg、S元素,以此来解析;
A.W、X、Y、Z分别是O、F、Mg、S元素,O、F的原子含有2个电子层,Y、Z的原子含有3个电子层,原子序数O
B.W、X、Z分别是O、F、S,非金属性越强对应的简单氢化物越稳定,非金属性F>O>S,简单氢化物的稳定性:HF>H2O>H2S,B正确;
C.W、X分别是O、F元素,形成OF2为共价化合物,C错误;
D.Y为Mg,Y的氧化物为MgO,MgO为碱性氧化物,不是两性氧化物,D错误;
故选:B。
10.【答案】D
【解析】A.一定体积的乙醇与足量钠反应,用排液法收集生成的H2,并将乙醇的体积、氢气的体积都转换成物质的量,从而得出1 mol乙醇生成氢气的物质的量,也就得出1个乙醇分子中所含活泼氢原子的数目,最终确定乙醇的结构,A能达到实验目的,A不符合题意;
B.向量气管中加入水,若装置不漏气,甲管和乙管中会形成稳定的液面差,B能达到实验目的,B不符合题意;
C.CO2通入溶有NH3的CaCl2溶液中,从而发生反应:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl,C能达到实验目的,C不符合题意;
D.氢氧化钠能与二氧化硅反应生成硅酸钠和水,所以不能用石英坩埚高温熔融烧碱,D不能达到实验目的,D符合题意。
故答案选D。
11.【答案】D
【解析】A.由题干信息可知,NO和O2混合后可发生反应:①2NO(g)+O2(g)=2NO2(g),②2NO2(g)⇌N2O4(g),则随着反应的进行NO2的浓度先增大后变小,最后达到平衡保持不变,故a为c(NO)、b为c(NO2),c为c(N2O4)随t的变化曲线,A错误;
B.t1时,只是c(NO)=c(NO2),故不能说明反应①达到化学平衡状态,B错误;
C.若容器的体积保持不变,则根据N原子守恒可知,t2时有c(NO)+c(NO2)+2c(N2O4)=c0,C错误;
D.由图像可知,t3后,NO2、N2O4的浓度不再发生改变说明反应达到平衡状态,故有NO2的消耗速率等于生成速率,D正确;
故答案为D。
12.【答案】BD
【解析】A.反应中还有氢气参与,因此还有非极性键的断开与形成,故A错误;
B.氧化镁和二氧化碳反应是非氧化还原反应,氢气参与的反应是氧化还原反应,因此反应过程中,既有氧化还原反应,又有非氧化还原反应,故B正确;
C.甲烷中碳元素为−4价,二氧化碳中碳元素为+4价,从MgOCO2开始连续得氢,碳元素的化合价降低,故C错误;
D.整个过程是CO2与H2在催化剂条件下生成CH4,同时有水生成,反应方程式表示为:CO2+4H2 Pd-Mg/SiO2 CH4+2H2O,故D正确。
故选BD。
13.【答案】CD
【解析】A.浸取时,若将稀硫酸换成浓硫酸将与Zn反应放出有毒有害的气体SO2,故为了提高酸浸效率,可以延长浸取时间,但不能将稀硫酸换成浓硫酸,A项错误;
B.已知Fe3+的氧化性强于Cu2+,故“除杂”过程中有加入足量锌粉等操作,与锌粉反应的离子不只有Pb2+和Cu2+,还有Fe3+,B项错误;
C.除去SO2时,SO2与ZnFe2O反应生成S单质,故SO2被还原,即SO2表现出氧化性,则ZnFe2O在反应中表现了还原性,C项正确;
D.已知ZnFe2O4中Zn为+2价,Fe为+3价,ZnFe2Ox中Zn为+2价,Fe为+(x−1)价,故ZnFe2O4与H2反应制得1molZnFe2Ox时转移电子为2×3−x−1=8−2x mol,D项正确。
14.【答案】BD
【解析】由图可知,A极为微生物燃料电池的负极,在微生物作用下有机物在负极失去电子发生氧化反应生成二氧化碳和氢离子,B极为正极,氧气和硝酸根离子在正极分别得到电子发生还原反应生成水和氮气。
A.由分析可知,A极为微生物燃料电池的负极,在微生物作用下有机物在负极失去电子发生氧化反应生成二氧化碳和氢离子,故A正确;
B.高温条件下微生物会发生蛋白质的变性,催化活性降低,电池的能量转化效率降低,故B错误;
C.由分析可知,B极为正极,氧气和硝酸根离子在正极分别得到电子发生还原反应生成水和氮气,电极反应式分别为O2+4H++4e−=2H2O、2NO3−+12H++10e−=N2↑+6H2O,故C正确;
D.若该有机物为甲醇,由化合价的变化可知,32g甲醇发生反应时,转移电子的物质的量为32g32g/mol×6=6mol,故D错误。
故选BD。
15.【答案】(1)CaCl2 ;
(2)S=C=S;H2S
(3)Si3N4
(4)2F2+2OH−=2F−+OF2+H2O
【解析】融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为543=18,则为Ca2+、Cl−,故XY2是CaCl2,X为Ca、Y为Cl;D与Cl相邻,D的最外层电子数是电子层数的三倍,所以D为S,E为C;W与Cl同周期,其单质是原子晶体,所以W为Si元素,Z的单质Z2有3个共价键,Si与Z能形成一种新型无机非金属材料,所以Z为N。据此分析解答。
(1)XY2是CaCl2;X与氢元素形成的化合物为CaH2,属于离子化合物,由钙离子与氢负离子构成,其电子式是,因此,本题正确答案是:CaCl2;;
(2)E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,氧族元素中氢化物为分子晶体(Po除外),而水分子之间存在氢键,沸点最高,硫化氢相对分子质量小于硒化氢、碲化氢,H2S分子间作用力较小,故H2S的沸点最低,因此,本题正确答案是:S=C=S;H2S;
(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素,元素Z的单质分子Z2中由3个共价键,则Z为氮元素,Si与N形成一种新型无机非金属材料为Si3N4,因此,本题正确答案是:Si3N4;
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,则R为F元素,F2与NaOH溶液反应的产物之一是OF2,OF2中氧元素为+2,F元素为−1价,反应中O元素化合价不变,故F元素化合价还降低,有NaF生成,根据元素守恒有水生成,反应离子方程式为:2F2+2OH−=2F−+OF2+H2O,因此,本题正确答案是:2F2+2OH−=2F−+OF2+H2O。
16.【答案】(1)圆底烧瓶;产生氨气,排出装置中的空气,防止氨基钠变质
(2)①B;②NaNH2+H2O=NaOH+NH3↑
(3)在CD之间再加一个B装置
(4)SiO2+2NaOH=Na2SiO3+H2O
(5)温度恢复到室温
(6)78.0%
【解析】装置A制备氨气,装置B干燥氨气,装置C制备氨基钠,装置D吸收氨气,装置E收集氢气,据此解答。
(1)根据仪器构造可判断仪器a的名称为圆底烧瓶;由于装置中含有空气,能氧化金属钠,则实验开始时,应先打开分液漏斗使浓氨水流下,目的是产生氨气,排出装置中的空气,防止氨基钠变质;
(2)①装置B用来干燥氨气,氨气是碱性气体,可以用碱性干燥剂碱石灰干燥;氨气能与中性干燥剂氯化钙反应,能与酸性干燥剂 P2O5 反应,故不选AD;无水硫酸铜用来检验水蒸气的存在,一般不作干燥剂,不选C;故答案选B;
②若无B装置,氨气中含有水蒸气,水蒸气能与NaNH2反应,则C中生成的氨基钠会发生的反应为NaNH2+H2O=NaOH+NH3↑;
(3)由于装置D中的水蒸气也可能进入装置C中,所以改正措施为在CD之间再加一个B装置;
(4)NaOH能和二氧化硅反应,所以反应容器不选用玻璃材质,反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O;
(5)由于气体的体积受温度和压强影响大,所以反应后对水量气管读数时,应注意①温度恢复到室温;
(6)生成氮气的质量为0.054L×1.40g/L=0.0756g,根据氮原子守恒可知NaN3样品的纯度为0.075628×2×13×650.15×100%=78%。
17.【答案】(1)+6
(2)AlO 2-+CO2+2H2O=Al(OH)3↓+HCO 3-
(3)MoO42-+Ba2+=BaMoO4↓
(4)①NaHCO3;②NH3
(5)①Al2O3 ;②4:1
【解析】废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,与氢氧化钠一起焙烧后,铝和钼都发生了反应分别转化为偏铝酸钠和钼酸钠,经水浸、过滤,分离出含镍的固体滤渣,滤液I中加入过量的二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,过滤得到的沉淀X为氢氧化铝,滤液II中加入适量的氯化钡溶液沉钼后,过滤得到钼酸钡。
(1)Na2MoO4中Na和O的化合价为+1和−2,根据化合价的代数和为0可知,Mo元素的化合价为+6。
(2)“沉铝”中,NaAlO2溶液与过量CO2反应可以生成Al(OH)3和碳酸氢钠,因此,生成沉淀X的离子方程式为AlO 2-+CO2+2H2O=Al(OH)3↓+HCO 3-。
(3)pH>6.0时,溶液中Mo元素以MoO42-的形态存在,“沉钼”中,pH为7.0,即:滤液II中含有钼酸钠,加入氯化钡溶液后生成BaMoO4沉淀,该反应的离子方程式为MoO42−+Ba2+=BaMoO4↓。
(4)①滤液I中加入过量的二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,同时生成碳酸氢钠,过滤得到的滤液II中含有碳酸氢钠和钼酸钠。滤液II中加入适量的氯化钡溶液沉钼后,因此,过滤得到的滤液Ⅲ中,主要存在的钠盐有NaCl和NaHCO3。
②根据侯氏制碱法的原理可知,往滤液Ⅲ中添加适量NaCl固体后,通入足量NH3,再通入足量CO2,可析出NaHCO3。
(5)①由题中信息可知,致密的保护膜为一种氧化物,是由H2O2与AlAs反应生成的,联想到金属铝表面容易形成致密的氧化膜可知,该氧化物为Al2O3。
②由Ga和Al同族、As和N同族可知,GaAs中显+3价(其最高价)、As显−3价。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,其化合价升高了8,As元素被氧化,则该反应的氧化剂为H2O2,还原剂为GaAs。H2O2中的O元素为−1价,其作为氧化剂时,O元素要被还原到−2价,每个H2O2参加反应会使化合价降低2,根据氧化还原反应中元素化合价升高的总数值等于化合价降低的总数值可知,该反应的氧化剂与还原剂物质的量之比为8:2=4:1。
18.【答案】 (1)羧基
(2)③④⑤
(3)HOCH2CH2OH+2CH3COOHCH3COOCH2CH2OOCCH3+2H2O
(4)2CH3CH2OH+O2→ΔCu2CH3CHO+2H2O
(5)
(6)acd
【解析】A是一种气态烃,其密度在标准状况下是H2的14倍,A的相对分子质量是28,因此A是乙烯;A和水发生加成反应生成B是乙醇,乙醇被酸性高锰酸钾溶液氧化生成C是乙酸,乙酸和乙醇发生酯化反应生成D是乙酸乙酯,乙烯和溴单质发生加成反应生成E是BrCH2CH2Br,根据已知信息E发生水解反应生成F是乙二醇,乙二醇和乙酸发生酯化反应生成G为CH3COOCH2CH2OOCCH3,E和苯发生取代反应生成H,H发生消去反应生成I,I分子中含有碳碳双键,可发生加聚反应生成聚苯乙烯,据此解答。
(1)C是乙酸,分子的官能团的名称为羧基。
(2)酯化反应和水解反应均属于取代反应,根据以上分析可知反应①∼⑦中属于取代反应的是③④⑤。
(3)C与F以物质的量之比2:1发生酯化反应生成G,反应④的化学方程式为HOCH2CH2OH+2CH3COOHCH3COOCH2CH2OOCCH3 +2H2O。
(4)乙醇可在催化剂作用下被空气中的氧气氧化为具有刺激性气味的物质乙醛,反应的化学方程式为2CH3CH2OH+O2→ΔCu2CH3CHO+2H2O。
(5)聚苯乙烯的结构简式为。
(6)a.D是乙酸乙酯,在一定条件下能和水发生水解反应生成乙醇和乙酸,a正确;
b.B和F含有的羟基个数不同,二者不属于同系物,b错误;
c.A和I都含有碳碳双键,B、F都含有羟基,因此都能使酸性高锰酸钾溶液褪色,c正确;
d.与E互为同分异构体的有机物只有1种,即CH3CHCl2,d正确;
答案选acd。
湖南省长郡中学2021-2022学年高一上学期期末考试化学试题(含答案解析): 这是一份湖南省长郡中学2021-2022学年高一上学期期末考试化学试题(含答案解析),文件包含精品解析湖南省长郡中学2021-2022学年高一上学期期末考试化学试题原卷版docx、精品解析湖南省长郡中学2021-2022学年高一上学期期末考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
精品解析:湖南省长郡中学2021-2022学年高一下学期选考科目调研考试化学试题: 这是一份精品解析:湖南省长郡中学2021-2022学年高一下学期选考科目调研考试化学试题,文件包含精品解析湖南省长郡中学2021-2022学年高一下学期选考科目调研考试化学试题解析版docx、精品解析湖南省长郡中学2021-2022学年高一下学期选考科目调研考试化学试题原卷版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
2021-2022学年湖南省长沙市长郡中学高二(下)月考化学试卷(第一次)(含答案解析): 这是一份2021-2022学年湖南省长沙市长郡中学高二(下)月考化学试卷(第一次)(含答案解析),共20页。试卷主要包含了 文献记载,8LSO3含分子数为2NA, 下列操作能达到实验目的的是, 我国科学家研究发现, 已知等内容,欢迎下载使用。












