





高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表一等奖课件ppt
展开Na、Mg、Al与水反应快慢不同,且化合价分别呈+1、+2、+3价,为什么?
Na与水反应室温、极快
Mg与水反应热水、较慢
Al与水反应沸水、缓慢
The arrangement f extranuclear electrns
第四章 第一节原子结构与元素周期表
知道核外电子排布三规律,能书写、判断常见元素的结构示意图
能书写常见的原子和简单离子的电子式
记住常见的2电子、10电子、18电子的微粒
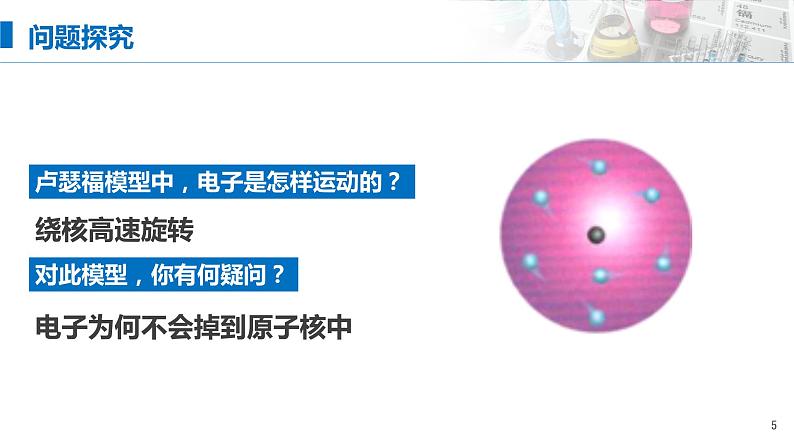
卢瑟福模型中,电子是怎样运动的?
对此模型,你有何疑问?
电子为何不会掉到原子核中
对比两模型,有何不同?(即哪里发生了变化?)
电子在某些特定的轨道上运动
不同轨道上的电子能量不同
钠原子核外有11个电子,其运动状态是否完全相同?
与水反应后化合价为+1
原子核外电子为何是分层排布的?
原子核外的电子排布有何规律?
分层(分类)思想很重要
老年、中年、青年、少年、儿童
小学、初中、高中、大学
核外电子运动的不同区域
1. 核外电子的分层排布
电子总是尽量先排在能量最低的电子层里,再排能量较高的电子层里。
请阅读教材87页中表格
2. 核外电子的排布规律
2.1 能量最低原理
电子是如何分配在每一电子层中的?
各电子层中最多可容纳多少个电子?
最外层,最多可容纳多少个电子?
次外层上,最多可容纳多少个电子?
各电子层最多容纳的电子数为2n2
2.2 电子排布三规律
最外层电子能量最高,也最活泼,最外层电子数主要决定元素的化学性质。
最外层电子数的排布有何特点?
稀有气体元素原子电子排布
最外层电子数最多为8个
次外层电子数最多为18个
用什么方式来表示核外电子的排布?
画出以下原子的结构示意图
在元素符号周围,用小黑点表示最外层上的电子。
先写元素符号,再画电子。
先分散(上、下、左、右)后集中(两两成对)
3. 核外电子排布的表示方法
请写出下列微粒的电子式
你见过哪些微粒具有相同的电子数吗?
2电子、10电子、18电子微粒
核电荷数1~20号元素中与He、Ne、Ar核外电子排布相同的简单离子有哪些?
电子数2=核电荷数1+得电子数
电子数2=核电荷数3-失电子数
电子数2=核电荷数4-失电子数
这节课我学到了什么?(用一句话表示)
核外电子总是尽先排在能量最低的电子层里,再排能量较高的电子层里
各电子层最多容纳电子数为2n2
(K层为最外电层时不超过2个)
次电子层最多容纳电子数为18个
离子:核电荷数加减1、2
离子:简单阴阳离子、复杂离子
1.氯离子(Cl-)的结构示意图:
2.硫离子的结构示意图:
3.氯原子的结构示意图:
4.F的结构示意图:
原子最外层电子数与其他的关系
1. 最外层电子数=电子层数
1 1
2 2
3 3
2. 最外层电子数=电子总数/2
1 2
2 4
3 6
3. 最外层电子数=内层上电子总数/2
5 10
A.原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
H一个电子,He二个电子,有可能,正确
2 8 32,最外层超过18,错误
2 8 8,如K+、 Cl-等,正确
最外层2或8个电子,若核电荷数为2,则为He;若核电荷数为8个,则为O2-,正确
某同学在画某种元素的一种微粒的原子结构示意图时,忘记在圆圈内标出其核电荷数,请你判断:
(1)该微粒是中性微粒,这种微粒的符号是_____。
(2)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是____。
(3)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是_____。
(4)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是_____。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表公开课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表公开课课件ppt,共36页。PPT课件主要包含了原子书法,人类对原子结构的认识,原子结构的探索之路,实验室中的卢瑟福,战争狂人美梦灭,H2O,认识质量数,认识核素,同位素分离器,还有什么疑问等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学课件ppt,共27页。PPT课件主要包含了本课目录,原子结构,元素周期表,同位素,原子的结构,核素同位素等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 原子结构与元素周期表精品ppt课件: 这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表精品ppt课件,共49页。PPT课件主要包含了课程学习目标,第一课时,新课讲解,思考·讨论,思维启迪,原子核外电子数的规律,原子结构模型的演变,课堂达标,原子核,核外电子等内容,欢迎下载使用。













