





高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教案配套ppt课件
展开我们知道,金属元素的原子最外层电子一般少于4个,在化学反应中容易失去电子,具有金属性;非金属元素的原子最外层电子一般多于4个,在化学反应中容易得到电子,具有非金属性。所以人们常说,原子结构决定元素的性质。
人们经常把元素周期表中的同族元素放在一起研究,是因为他们之间存在着某种内在联系。那么,这种内在的联系是什么呢?我们将从他们的结构和性质的关系进行探讨。
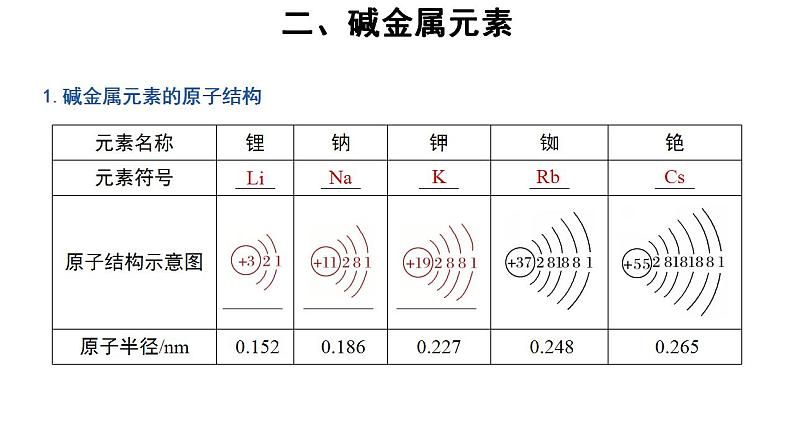
1.碱金属元素的原子结构
(1)由上表可知:在元素周期表中,碱金属元素原子的最外层电子数_____,随核电荷数的增大,电子层数依次_____,原子半径逐渐_____。(2)碱金属元素的原子最外层电子数为1,易失去电子而具有较强的金属性,其单质与钠类似,易与氧气、水等反应。
2.碱金属单质的化学性质
(1)钠、钾与氧气反应
①实验现象:都能在空气中燃烧,钠产生黄色火焰,钾产生紫色火焰(透过蓝色钴玻璃),钾燃烧更剧烈。②反应方程式:___________________、________________。③实验结论:金属的活泼性:K____Na。
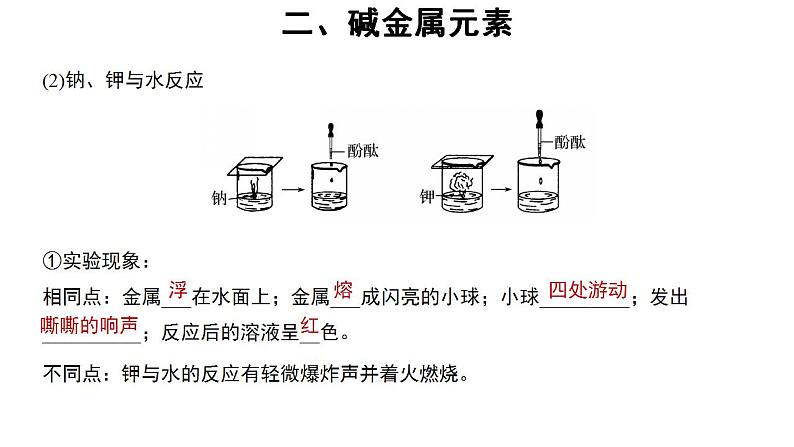
不同点:钾与水的反应有轻微爆炸声并着火燃烧。
①实验现象:相同点:金属___在水面上;金属___成闪亮的小球;小球_________;发出__________;反应后的溶液呈__色。
②化学方程式:__________________________;________________________。③实验结论:与水反应剧烈程度:K_____Na;金属的活泼性:K____Na。
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
3.碱金属单质的物理性质(1)碱金属单质具有硬度____、密度____、熔点低的特点。随着元素原子核电荷数的增加,碱金属单质的熔点和沸点逐渐_____。(2)碱金属单质具有良好的_______、导____性、导____性,液态钠可用作核反应堆的传热介质。
碱金属性质的相似性和递变性
具体情况如下:①与氧气反应从Li→Cs,与氧气反应越来越剧烈,产物越来越复杂。如Li与O2生成Li2O,Na与O2生成Na2O、Na2O2,K与O2生成K2O、KO2。②与H2O(或酸)的反应从Li→Cs,与H2O(或酸)反应越来越剧烈。如K与H2O反应能发生轻微爆炸,则Rb、Cs遇水会发生爆炸。
(1)从锂到铯,碱金属元素单质的密度依次增大( )(2)碱金属元素的单质与氧气反应的产物属于同种类型( )(3)碱金属元素随核电荷数增大,其单质与水反应越来越剧烈( )(4)碱金属元素单质都应该保存在煤油中( )(5)金属钾能从NaCl溶液中置换出钠( )(6)碱金属元素在自然界中能以游离态存在( )
1.从碱金属原子结构的角度解释。(1)碱金属元素的化学性质具有相似性。
提示 碱金属元素的最外层电子数相同,都是1个电子,故它们的化学性质相似。
(2)碱金属元素的性质具有递变性。
提示 随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失电子的能力逐渐增强。
2.据报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期ⅠA族,根据铯在元素周期表中的位置,推断下列内容:(1)铯的原子核外共有____个电子层,最外层电子数为____,铯的原子序数为____。(2)铯单质与水剧烈反应,放出____色气体,同时使紫色石蕊溶液显______色,因为__________________________(写出化学方程式)。(3)预测铯单质的还原性比钠单质的还原性____(填“弱”或“强”)。
2Cs+2H2O===2CsOH+H2↑
解析 根据原子核外电子排布规律,结合铯在元素周期表中的位置知,铯原子核外电子分六层排布,分别是2、8、18、18、8、1,原子序数是55,最外层只有1个电子。铯与钠同主族,具有极强的金属性,与水反应生成氢气和氢氧化铯:2Cs+2H2O===2CsOH+H2↑,氢氧化铯是强碱,使紫色石蕊溶液变蓝色。
1.卤素单质的物理性质
分析上表可知,从F2到I2,颜色逐渐_____,熔、沸点逐渐_____,密度逐渐_____。
2.卤族元素的原子结构
(1)由上表可知:卤族元素的原子最外层电子数都是_____的,随核电荷数的增大,电子层数依次_____,原子半径逐渐_____。(2)卤族元素原子最外层电子数为7,易得到电子而具有较强的非金属性,其单质与氯气类似,能与金属、非金属单质、水等发生反应。
3.卤素单质的化学性质
(1)与氢气反应①卤素单质与氢气反应的条件及生成物的稳定性
②随原子序数的递增,卤素单质与H2化合越来越____,生成的氢化物的稳定性逐渐_____,元素的非金属性逐渐_____。
(2)卤素单质间的置换反应实验①中:试管内液体静置后分层,上层为无色,下层为橙红色,反应的化学方程式:_________________________;
实验②中:试管内液体静置分层,上层为无色,下层为紫红色,反应的化学方程式:_____________________;实验③中:试管内液体静置分层,上层为无色,下层为紫红色,反应的化学方程式:____________________。
由实验①②③得出结论:Cl2→I2氧化性逐渐减弱,相应卤素离子还原性逐渐_____。
Cl2+2NaBr===2NaCl+Br2
2KI+Br2===2KBr+I2
2KI+Cl2===2KCl+I2
卤族元素原子结构和性质的相似性和递变性(1)卤族元素原子结构和性质的相似性:①最外层均有7个电子;②最高正价除F外均显+7价,最低负价为-1价;③气态氢化物的通式为HX(X表示卤素);④最高价氧化物对应水化物的通式为HXO4(F除外)。
(2)卤族元素原子结构和性质的递变性:
1.卤素都是典型的非金属元素,其单质(X2)都具有氧化性。(1)卤素易形成X-的原因是_________________________________________________________。(2)X2与H2化合的化学方程式是______________________,其反应条件难易规律是____________________________________。(3)将氯气通入碘化钾溶液中反应的离子方程式是____________________。(4)举例说明氯气的氧化性比单质溴的氧化性强:_____________________________________________________________________。
卤素原子的最外层都是7个电子,易得到1个电子形成
H2+X2===2HX
随原子序数的增大,与H2化合越来越难
Cl2+2I-===2Cl-+I2
氯气能从溴化钾溶液中置换出
溴:Cl2+2KBr===2KCl+Br2(答案合理均可)
2.砹(At)属于卤族元素,下列关于砹(At)及其化合物具有的性质推测不正确的是______(填字母)。A.单质砹易溶于某些有机溶剂B.AgAt是难溶于水的有色固体C.HAtO4的酸性比HClO4的弱D.HAt难溶于水,且受热很难分解
同主族元素的原子结构与性质的关系
1.随着碱金属元素原子序数的增大,下列递变规律正确的是A.原子半径逐渐增大B.最高价氧化物对应水化物的碱性逐渐减弱C.单质熔、沸点逐渐升高D.单质的氧化性逐渐增强
解析 随着碱金属元素原子序数的增大,最高价氧化物对应水化物的碱性逐渐增强,单质熔、沸点逐渐降低,单质的还原性逐渐增强。
2.下列有关碱金属元素的性质判断正确的是A.K与H2O反应最剧烈B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出NaC.碱金属的阳离子没有还原性,所以有强氧化性D.从Li到Cs都易失去最外层1个电子,且失电子能力逐渐增强
解析 A项,在碱金属元素中,K不是最活泼的元素;B项,Rb先与水反应,不会置换出Na;C项,碱金属的阳离子很稳定,不具有强氧化性。
3.下列事实不能用于判断金属性强弱的是A.金属单质间发生的置换反应B.1 ml金属单质在反应中失去电子的多少C.金属元素的最高价氧化物对应水化物的碱性强弱D.金属元素的单质与水或酸反应置换出氢气的难易程度
解析 金属单质在反应中失去电子的多少,不能作为判断金属性强弱的依据,如1 ml Al反应失去的电子比1 ml Na多,但Al的金属性比Na弱。
4.部分卤族元素的某种性质A随核电荷数的变化趋势如图所示,则A可能表示
A.原子半径 B.氢化物的稳定性C.原子的电子层数 D.单质的密度
解析 从氯到碘,原子半径逐渐增大,A项不符合题意;从HCl到HI,稳定性逐渐减弱,B项符合题意;从Cl到I,原子的电子层数逐渐增多,C项不符合题意;从Cl2到I2,单质的密度逐渐增大,D项不符合题意。
5.关于卤素(用X表示)的下列叙述正确的是A.卤素单质与水反应均可用X2+H2O===HXO+HX表示B.HX都极易溶于水,它们的热稳定性随核电荷数增加而增强C.卤素单质的颜色从F2→I2按相对分子质量增大而加深D.X-的还原性依次为F-
6.下列说法中,不符合第ⅦA族元素性质特征的是A.从上到下元素的非金属性增强B.易形成-1价离子C.从上到下最高价氧化物对应水化物的酸性减弱(F除外)D.从上到下氢化物的还原性依次增强
解析 同主族元素,从上到下元素的非金属性逐渐减弱,选项A错误;第ⅦA族元素最外层有7个电子,易得1个电子形成-1价离子,选项B正确;从上到下元素的非金属性逐渐减弱,所以最高价氧化物对应水化物的酸性逐渐减弱(F除外),选项C正确;同主族元素,从上到下元素的非金属性逐渐减弱,所以氢化物的还原性依次增强,选项D正确。
7.下列有关碱金属元素和卤素的说法中,错误的是A.溴单质与H2的反应比碘单质与H2的反应更剧烈B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的 能力最强C.钾与水的反应比钠与水的反应更剧烈D.随核电荷数的增加,碱金属元素和卤素的熔、沸点都逐渐降低
解析 溴的非金属性强于碘,故溴单质与H2的反应比碘单质与H2的反应更剧烈,A项正确;碱金属元素中,锂的金属性最弱,故锂原子失去最外层电子的能力最弱;卤素中,氟的非金属性最强,故氟原子得电子的能力最强,B项正确;钾的金属性比钠强,故钾与水的反应比钠与水的反应更剧烈,C项正确;随核电荷数的增加,碱金属元素单质的熔、沸点逐渐降低,卤素单质的熔、沸点逐渐升高,D项不正确。
(2)下列单质的熔、沸点随原子序数递增而升高的是____(填字母,下同)。A.碱金属元素 B.卤族元素
8.(1)常见卤素氢化物中最不稳定的是____(写化学式)。
解析 常见卤素中碘元素的非金属性最弱,氢化物最不稳定的是HI。
解析 碱金属元素单质的熔、沸点随原子序数的递增而降低,卤素单质的熔、沸点随原子序数的递增而升高。
人教版 (2019)必修 第一册第三节 化学键示范课课件ppt: 这是一份人教版 (2019)必修 第一册第三节 化学键示范课课件ppt,共32页。PPT课件主要包含了导入新课,静电作用,细口瓶,带相反电荷离子,阳离子和阴离子,活泼金属,活泼非金属,离子键,归纳总结,最外层等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表课文课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表课文课件ppt,共29页。PPT课件主要包含了导入新课,原子符号,深度思考,解析N=A-Z,A-Z,A-x-n,A-x+n,归纳总结,相关概念,氢元素的三种核素等内容,欢迎下载使用。
化学必修 第一册第一节 原子结构与元素周期表教学演示ppt课件: 这是一份化学必修 第一册第一节 原子结构与元素周期表教学演示ppt课件,共28页。PPT课件主要包含了导入新课,电子层数目,原子序数递增,最外层电子数,电子层数递增,核电荷数,质子数,核外电子数,易错警示,电子层数等内容,欢迎下载使用。













