







- 3.2金属材料(第二课时)课件+教案+练习 课件 77 次下载
- 4.1原子结构与元素周期表(第一课时)课件+教案+练习 课件 84 次下载
- 4.2元素周期律课件+教案+练习 课件 80 次下载
- 4.3化学键(第一课时)课件+教案+练习 课件 79 次下载
- 4.3化学键(第二课时)课件+教案+练习 课件 81 次下载
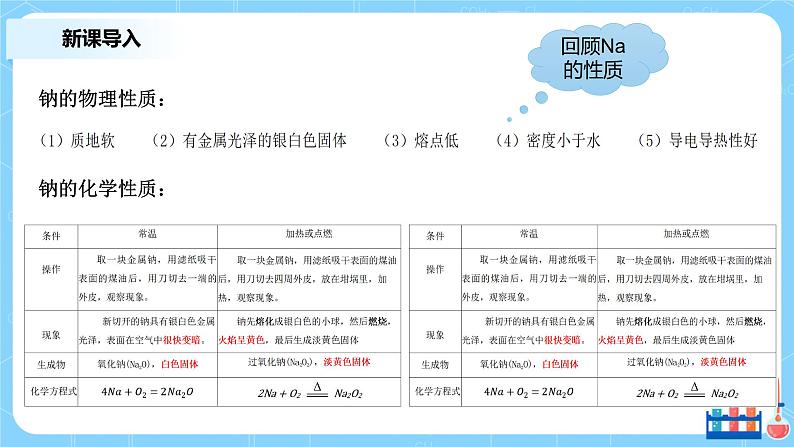
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教课内容ppt课件
展开一、新课导入二、比较钾与钠化学性质的异同三、预测锂、铷、铯的化学性质四、归纳碱金属的相似性和递变性五、预测卤族元素化学性质特点六、归纳卤族元素的相似性和递变性
1、探寻元素性质与周期表的关系
比较钾与钠化学性质的异同
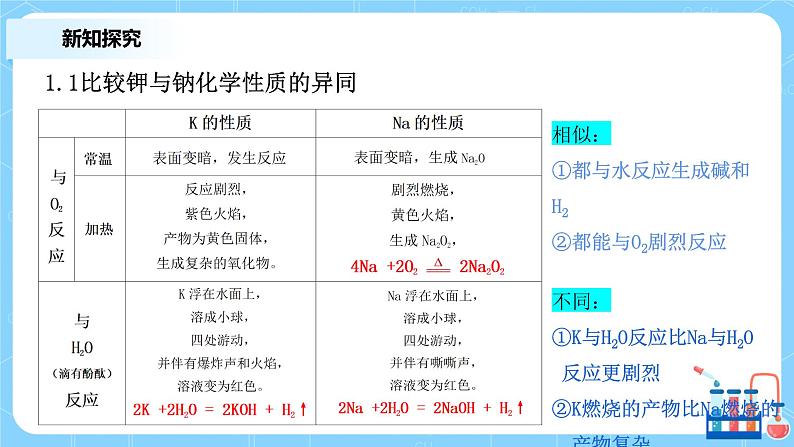
1.1比较钾与钠化学性质的异同
相似:①都与水反应生成碱和H2 ②都能与O2剧烈反应 不同: ①K与H2O反应比Na与H2O 反应更剧烈②K燃烧的产物比Na燃烧的 产物复杂
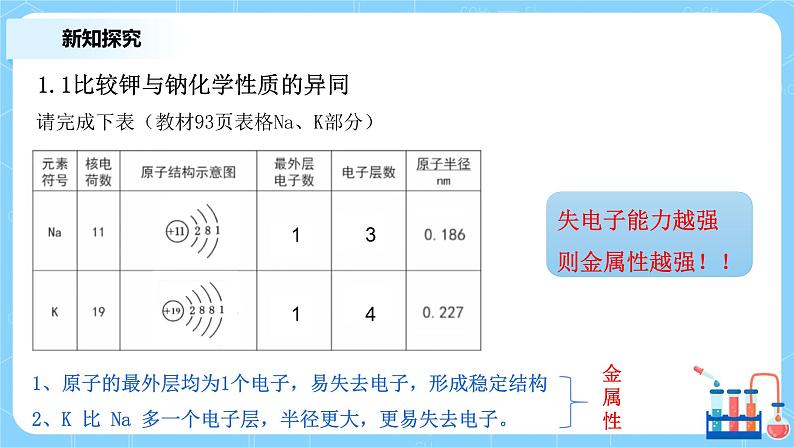
请完成下表(教材93页表格Na、K部分)
1、原子的最外层均为1个电子,易失去电子,形成稳定结构2、K 比 Na 多一个电子层,半径更大,更易失去电子。
失电子能力越强则金属性越强!!
(1)单质与水(或酸)反应置换出H2的难易程度 K与H2O反应比Na与H2O反应更容易 → 金属性:K > Na(2)最高价氧化物对应的水化物——氢氧化物的碱性强弱 碱性强弱:KOH 、NaOH → 金属性:K > Na
1.1 总结1:金属性判断的依据(本质:原子越易失电子,金属性越强)
1.1 总结2:比较钾与钠化学性质的异同
都能与O2、H2O反应。生成+1价化合物
K比Na多一层电子,半径大
K比Na更容易发生反应,反应也更剧烈。
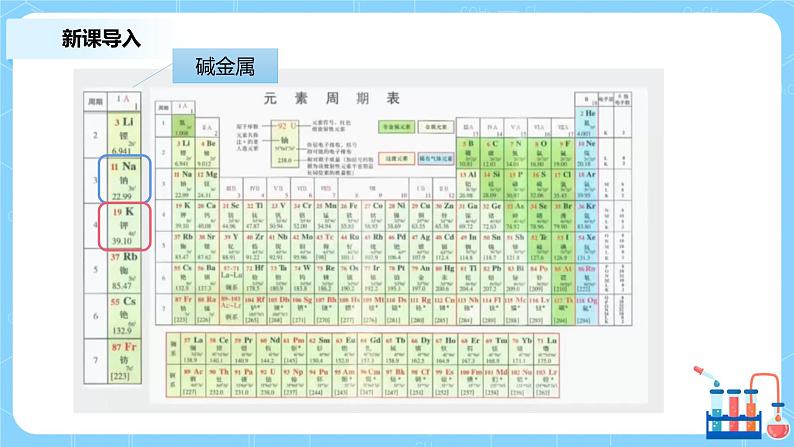
1.2 预测Li、Rb、Cs的化学性质
预测:①能与H2O反应、与O2反应,生成+1价 的化合物②与O2或H2O反应时,Li比Na难反应③与O2或H2O反应时,Rb、Cs比K易反应
实验事实:·Li与O2加热时反应,生成Li2O·与H2O反应时,Li比Na缓慢·铷Rb、Cs遇空气立即燃烧·铷Rb、铯Cs遇H2O剧烈反应,甚至爆炸
1.2 总结3:归纳碱金属的相似性和递变性
ⅠA族,周期序数逐渐增大
与O2、H2O反应更容易,也更剧烈。
1.3 总结4:归纳碱金属的相似性和递变性
1、相似性:碱金属除Cs略带金色光泽外,其他都是 银白色有金属光泽的固体。 密度较小, 硬度较小,熔、沸点较低, 导电、导热性较强2、递变性:从Li→Cs密度逐渐增大(Na、K反常), 熔、沸点逐渐降低
2. 探究同主族的非金属是否也具有相似性和递变性
预测卤族元素化学性质的基本思路是什么?
2.1 预测卤族元素化学性质有哪些特点?
2.2 验证卤族元素的化学性质
非金属性判断的依据(本质:原子越易得电子,非金属性越强)
(1)与H2化合越容易,气态氢化物越稳定,非金属性越强。(2)最高价氧化物对应水化物的酸性越强,非金属性越强。
结论1、卤族元素的性质具有相似性。2、元素都具有非金属性, 单质都具有氧化性。3、从F到I,元素的非金属性逐渐减弱, 单质的氧化性逐渐减弱。
结论 从Cl到I,元素的非金属性逐渐减弱。
氯水分别与IBr、KI溶液的反应
氧化性: Cl2 > Br2还原性: Br- > Cl-氧化性: Cl2 > I2还原性: I- > Cl-
氧化性: Br2 > I2 还原性: I- > Br-
结论(1)卤素单质氧化性: Cl2 > Br2 > I2 从Cl → I ,单质的氧化性逐渐减弱(2)卤素离子的还原性:Cl- < Br-< I- 从Cl → I ,离子的还原性逐渐增强
2.2 总结5:归纳卤族元素的相似性与递变性
“位置— 结构 — 性质”模型
1、设计实验验证镁与钙金属性的强弱 方案1:比较钙和镁单质分别与水(或酸)反应置 换出氢气的难易 方案2:比较氢氧化钙与氢氧化镁的碱性强弱2、查找资料,评价用金属锂做电池的优势和潜在危险,并 对锂电池的使用提出合理的建议。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表公开课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表公开课课件ppt,共36页。PPT课件主要包含了原子书法,人类对原子结构的认识,原子结构的探索之路,实验室中的卢瑟福,战争狂人美梦灭,H2O,认识质量数,认识核素,同位素分离器,还有什么疑问等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表一等奖课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表一等奖课件ppt,共41页。PPT课件主要包含了钠镁铝分别与水反应,核外电子的排布,学习目标,电子排布,电子式,等电子微粒,绕核高速旋转,问题探究,电子分层排布,玻尔的电子分层理论等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学课件ppt,共27页。PPT课件主要包含了本课目录,原子结构,元素周期表,同位素,原子的结构,核素同位素等内容,欢迎下载使用。














