





还剩16页未读,
继续阅读
成套系列资料,整套一键下载
选择性必修1 第一章 第一节 第3课时 热化学方程式 燃烧热-教学课件
展开
这是一份选择性必修1 第一章 第一节 第3课时 热化学方程式 燃烧热-教学课件,共24页。
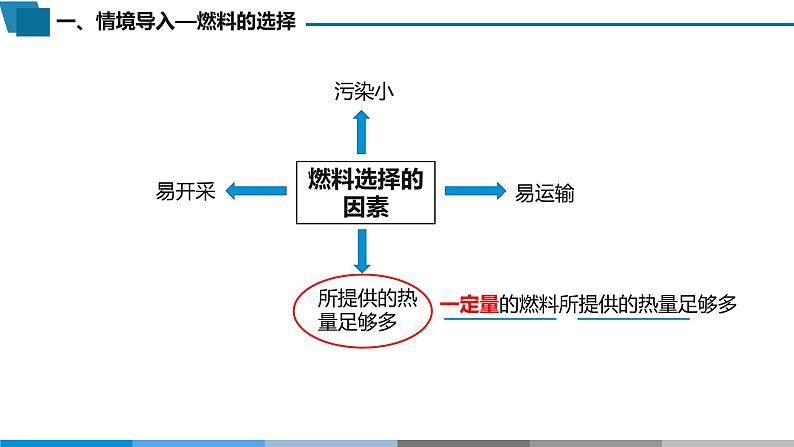
热化学方程式 燃烧热化学(人教版)选择性必修1 第一章 第一节 第三课时以上场景的热能都是由什么物质提供的呢?天然气(CH4)汽油(C5~C12烷烃类)火箭推进剂燃料选择的因素所提供的热量足够多污染小易开采易运输一定量的燃料所提供的热量足够多【知识回顾—焓变的计算】已知断裂1 mol H-H键、1 mol O=O键时所吸收的热量分别为436 kJ、496 kJ,形成1 mol O-H键时所释放的热量为463 kJ,计算以下化学反应的反应热:1 mol H2与0.5 mol O2反应生成H2O(g)△H = E反应物断键 – E生成物成键△H = (436+496/2) – 463×2 = – 242 kJ/mol 表示反应物的量与放出的热量之间的关系:2H2(g)+ O2 (g) = 2H2O (g) △H = – 484 kJ/mol 1、热化学方程式:能表明反应所释放或吸收的热量的化学方程式2、热化学方程式的书写物质后都用括号注明物质的聚集状态不用注明反应条件指明反应温度和压强(常温常压:25℃、101kPa 可以不注明)方程式后正确书写焓变△H: “+、 –”、kJ/mol同一个反应中,化学计量数与△H成正比,且可为整数或分数2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/molH2O(g) = H2O(l) △H = – 44 kJ/molg:气态 l:液态 s:固态 aq:溶液 【思考】△H单位中“每摩尔”表示什么?答:“每摩尔”不是指“每摩尔某物质”,而是指“每摩尔反应”。 ②2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol对于反应②:2 mol H2(g) 与1 mol O2(g) 反应生成2 mol H2O(g)表示“每摩尔反应”, “每摩尔反应”放出484 kJ的热量。因此,书写热化学方程式时, △H 必须与化学方程式的化学计量数一一对应。【课堂练习】判断热化学方程式是否正确,正确的打√,错误的打×。(5)2H2(g) + O2(g) = 2H2O(l) △H = – 571.6 kJ/mol(2)H2(g) + Cl2(g) = 2HCl(g) △H = – 183 kJ(3)已知强酸与强碱稀溶液发生中和反应生成1mol H2O放热57.3 kJ,则 2KOH(aq) + H2SO4(aq) = K2SO4(aq) + 2H2O(l) △H = – 57.3 kJ/mol( )( )( )( )×物质状态、反应条件×△H 单位:kJ/mol√×化学计量数与△H 不成正比( )×可逆反应实际转化率<100%,热化学方程式指该反应完全进行的能量变化(1)28 g CO(g)在氧气中燃烧生成CO2(g)放出283 kJ的热量(2)11.2 L(标准状况)N2(g)在氧气中反应生成NO(g)放出68 kJ的热量2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol 【课堂练习】依据事实,写出下列反应的热化学方程式。N2(g) + O2(g) = 2NO(g) △H = – 136 kJ/mol 【思考】一定量的燃料燃烧到什么程度放出的热量多?燃料完全燃烧生成指定的产物HCSNH2O(l)而不是H2O(g)CO2 (g)而不是CO(g)SO2 (g)N2 (g)1、燃烧热:在101 kPa时,1 mol 纯物质完全燃烧生成指定产物时所放出的热量, 单位为 kJ/mol【思考】根据燃烧热的定义,解释“甲烷的燃烧热为890 kJ/mol” 表示什么?1 mol 甲烷完全燃烧生成CO2、液态H2O所放出的热量为890 kJ而不是SO3(g) C产物应为CO2(g)H2的燃烧热是指生成液态H2O的燃烧反应所放出的热量燃料C8H18应为1 mol燃烧热的热化学方程式(1)1 mol 甲烷在氧气中完全燃烧释放的能量为890 kJ(2)28 g CO在氧气中燃烧生成CO2(g)释放的能量为283 kJCH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol 【课堂练习】依据事实,写出以下物质燃烧热的热化学方程式2、燃烧热的热化学方程式:以1 mol 燃料为标准配平方程式完全燃烧生成指定产物2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol×√【课堂练习】下列有关热化学方程式及其叙述正确的是( )A.乙烷的燃烧热为-1559 kJ/mo1,则乙烷燃烧热的热化学方程式为: 2C2H6(g) + 7O2(g) = 4CO2(g) + 6H2O(1) △H= – 3118 kJ/mo1B.1mol甲醇(l)完全燃烧生成CO2和H2O(1)时放出726 kJ热量,则其燃烧的热化学方程式为 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/molC.已知2C(s) +O2(g) = 2CO(g) △H=-221kJ·mol-1,则C的燃烧热为110.5kJ/mo1D.稀醋酸与NaOH溶液反应:H+(aq) + OH—(aq) = H2O(1) △H= – 57.3kJ/molBA. 燃烧热的热化学方程式: B. 燃烧的热化学方程式:① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/mol 弱酸【思考】以下为部分燃料的燃烧热,结合燃料本身的特点及燃料的选择条件,讨论以下燃料的应用。大气污染,一般不作燃料不易制备、运输,但无污染且燃烧热较大,是未来新能源西气东输工程,家庭常用燃料可再生能源,液体易运输,且燃烧热较大,逐渐被应用于乙醇汽油中第一枚液体火箭发动机的推进剂中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂液体火箭推进剂的发展液氧汽油肼类燃料(肼、偏二甲肼)2N2H4(l) + N2O4(l) = 3N2(g) + 4H2O(l) △H = – 1225 kJ/mol液态肼为常用火箭燃料推进剂稳定、易储存、燃烧热大、生成气体可作推进作用第一枚液体火箭发动机的推进剂中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂液体火箭推进剂的发展液氧汽油肼类燃料(肼、偏二甲肼)液氧煤油液氢液氧“长征七号”运载火箭采用液氧煤油推进剂“长征五号”运载火箭采用液氢液氧推进剂【思考】根据以下物质的燃烧热数据,计算相同质量的H2(g)、CH4(g)、C2H5OH(l)完全燃烧放出的热量,说明用液氢作为火箭燃料的优点。142.955.629.7由计算可知,相同质量的上述三种燃料, H2(g) 完全燃烧放出的热量最多,同时, H2(g) 燃烧产物无污染,这是用液氢作为火箭燃料的优点。 2.燃烧是人们利用热能的重要方式。下列有关燃烧热的说法正确的是( )A.燃烧热所指的燃烧产物一定是相应元素的最高价氧化物B.实验测定H2的燃烧热时与所用H2量的多少无关C.含碳物质燃烧生成1 mol CO2时所放出的热量是燃烧热D.1 mol C燃烧生成CO时放出的热量是燃烧热 4.1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为 ( )A.C+H2O = CO+H2 ΔH= +131.3 kJ·mol-1B.C(s)+H2O(g)= CO(g)+H2(g) ΔH= +10.94 kJ·mol-1C.C(s)+H2O(l) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1D.C(s)+H2O(g) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1 参考答案:1、D2、B3、C4、D5、C
热化学方程式 燃烧热化学(人教版)选择性必修1 第一章 第一节 第三课时以上场景的热能都是由什么物质提供的呢?天然气(CH4)汽油(C5~C12烷烃类)火箭推进剂燃料选择的因素所提供的热量足够多污染小易开采易运输一定量的燃料所提供的热量足够多【知识回顾—焓变的计算】已知断裂1 mol H-H键、1 mol O=O键时所吸收的热量分别为436 kJ、496 kJ,形成1 mol O-H键时所释放的热量为463 kJ,计算以下化学反应的反应热:1 mol H2与0.5 mol O2反应生成H2O(g)△H = E反应物断键 – E生成物成键△H = (436+496/2) – 463×2 = – 242 kJ/mol 表示反应物的量与放出的热量之间的关系:2H2(g)+ O2 (g) = 2H2O (g) △H = – 484 kJ/mol 1、热化学方程式:能表明反应所释放或吸收的热量的化学方程式2、热化学方程式的书写物质后都用括号注明物质的聚集状态不用注明反应条件指明反应温度和压强(常温常压:25℃、101kPa 可以不注明)方程式后正确书写焓变△H: “+、 –”、kJ/mol同一个反应中,化学计量数与△H成正比,且可为整数或分数2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/molH2O(g) = H2O(l) △H = – 44 kJ/molg:气态 l:液态 s:固态 aq:溶液 【思考】△H单位中“每摩尔”表示什么?答:“每摩尔”不是指“每摩尔某物质”,而是指“每摩尔反应”。 ②2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol对于反应②:2 mol H2(g) 与1 mol O2(g) 反应生成2 mol H2O(g)表示“每摩尔反应”, “每摩尔反应”放出484 kJ的热量。因此,书写热化学方程式时, △H 必须与化学方程式的化学计量数一一对应。【课堂练习】判断热化学方程式是否正确,正确的打√,错误的打×。(5)2H2(g) + O2(g) = 2H2O(l) △H = – 571.6 kJ/mol(2)H2(g) + Cl2(g) = 2HCl(g) △H = – 183 kJ(3)已知强酸与强碱稀溶液发生中和反应生成1mol H2O放热57.3 kJ,则 2KOH(aq) + H2SO4(aq) = K2SO4(aq) + 2H2O(l) △H = – 57.3 kJ/mol( )( )( )( )×物质状态、反应条件×△H 单位:kJ/mol√×化学计量数与△H 不成正比( )×可逆反应实际转化率<100%,热化学方程式指该反应完全进行的能量变化(1)28 g CO(g)在氧气中燃烧生成CO2(g)放出283 kJ的热量(2)11.2 L(标准状况)N2(g)在氧气中反应生成NO(g)放出68 kJ的热量2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol 【课堂练习】依据事实,写出下列反应的热化学方程式。N2(g) + O2(g) = 2NO(g) △H = – 136 kJ/mol 【思考】一定量的燃料燃烧到什么程度放出的热量多?燃料完全燃烧生成指定的产物HCSNH2O(l)而不是H2O(g)CO2 (g)而不是CO(g)SO2 (g)N2 (g)1、燃烧热:在101 kPa时,1 mol 纯物质完全燃烧生成指定产物时所放出的热量, 单位为 kJ/mol【思考】根据燃烧热的定义,解释“甲烷的燃烧热为890 kJ/mol” 表示什么?1 mol 甲烷完全燃烧生成CO2、液态H2O所放出的热量为890 kJ而不是SO3(g) C产物应为CO2(g)H2的燃烧热是指生成液态H2O的燃烧反应所放出的热量燃料C8H18应为1 mol燃烧热的热化学方程式(1)1 mol 甲烷在氧气中完全燃烧释放的能量为890 kJ(2)28 g CO在氧气中燃烧生成CO2(g)释放的能量为283 kJCH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol 【课堂练习】依据事实,写出以下物质燃烧热的热化学方程式2、燃烧热的热化学方程式:以1 mol 燃料为标准配平方程式完全燃烧生成指定产物2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol×√【课堂练习】下列有关热化学方程式及其叙述正确的是( )A.乙烷的燃烧热为-1559 kJ/mo1,则乙烷燃烧热的热化学方程式为: 2C2H6(g) + 7O2(g) = 4CO2(g) + 6H2O(1) △H= – 3118 kJ/mo1B.1mol甲醇(l)完全燃烧生成CO2和H2O(1)时放出726 kJ热量,则其燃烧的热化学方程式为 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/molC.已知2C(s) +O2(g) = 2CO(g) △H=-221kJ·mol-1,则C的燃烧热为110.5kJ/mo1D.稀醋酸与NaOH溶液反应:H+(aq) + OH—(aq) = H2O(1) △H= – 57.3kJ/molBA. 燃烧热的热化学方程式: B. 燃烧的热化学方程式:① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/mol 弱酸【思考】以下为部分燃料的燃烧热,结合燃料本身的特点及燃料的选择条件,讨论以下燃料的应用。大气污染,一般不作燃料不易制备、运输,但无污染且燃烧热较大,是未来新能源西气东输工程,家庭常用燃料可再生能源,液体易运输,且燃烧热较大,逐渐被应用于乙醇汽油中第一枚液体火箭发动机的推进剂中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂液体火箭推进剂的发展液氧汽油肼类燃料(肼、偏二甲肼)2N2H4(l) + N2O4(l) = 3N2(g) + 4H2O(l) △H = – 1225 kJ/mol液态肼为常用火箭燃料推进剂稳定、易储存、燃烧热大、生成气体可作推进作用第一枚液体火箭发动机的推进剂中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂液体火箭推进剂的发展液氧汽油肼类燃料(肼、偏二甲肼)液氧煤油液氢液氧“长征七号”运载火箭采用液氧煤油推进剂“长征五号”运载火箭采用液氢液氧推进剂【思考】根据以下物质的燃烧热数据,计算相同质量的H2(g)、CH4(g)、C2H5OH(l)完全燃烧放出的热量,说明用液氢作为火箭燃料的优点。142.955.629.7由计算可知,相同质量的上述三种燃料, H2(g) 完全燃烧放出的热量最多,同时, H2(g) 燃烧产物无污染,这是用液氢作为火箭燃料的优点。 2.燃烧是人们利用热能的重要方式。下列有关燃烧热的说法正确的是( )A.燃烧热所指的燃烧产物一定是相应元素的最高价氧化物B.实验测定H2的燃烧热时与所用H2量的多少无关C.含碳物质燃烧生成1 mol CO2时所放出的热量是燃烧热D.1 mol C燃烧生成CO时放出的热量是燃烧热 4.1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为 ( )A.C+H2O = CO+H2 ΔH= +131.3 kJ·mol-1B.C(s)+H2O(g)= CO(g)+H2(g) ΔH= +10.94 kJ·mol-1C.C(s)+H2O(l) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1D.C(s)+H2O(g) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1 参考答案:1、D2、B3、C4、D5、C
相关资料
更多









