




高中化学第三单元 共价键 共价晶体教学课件ppt
展开3.3共价键 共价晶体(第2课时)
一、核心素养发展目标
1.掌握共价键的键能概念及影响因素,能分析共价键的键能与反应中能量变化的关系;
2.能根据共价晶体的微观结构预测其性质。
二、教学重点及难点
重点 共价键的键能及影响因素、与反应中能量变化的关系
难点 共价晶体的微观结构
三、教学方法
讲授法、讨论法
四、教学工具
PPT、视频、共价晶体晶胞模型
五、教学过程
一、共价键键能与化学反应的反应热
【讲述】键能:人们把在101 kPa、298 K(25℃)条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,或气态基态原子A原子和B原子形成1 mol气态AB分子释放的最低能量。
【问】条件和单位是什么?
【生】通常是298 K、101 KPa条件下的标准值。
单位:kJ·mol-1
【讲述】键能越大,共价键越牢固, 由此形成的分子越稳定。
当两个原子形成共价键时,原子轨道发生重叠。原子轨道重叠的程度越大,共价键的键能越大,两原子核间的平均间距——键长越短。
键参数 —— 键长
【展示】Cl2中Cl-Cl键长
【讲述】定义:构成化学键的两个原子之间的核间距。
单位:pm(1 pm=10-12 m)
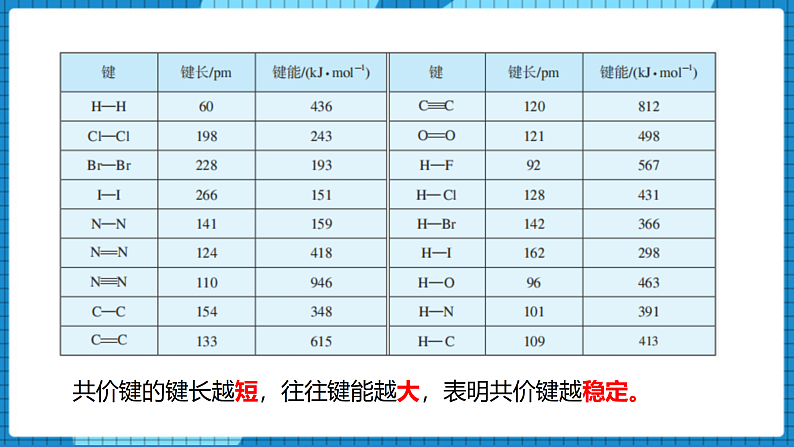
【展示】部分共价键的键长和键能表
【讲述】共价键的键长越短,往往键能越大,表明共价键越稳定。
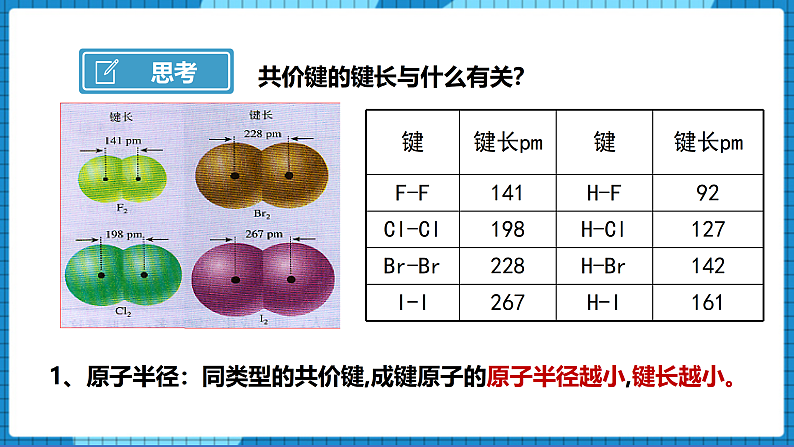
【问】共价键的键长与什么有关?
【生】1、原子半径:同类型的共价键,成键原子的原子半径越小,键长越小。
【展示】F-F、Cl-Cl、Br-Br、H-F、H-Cl等的键长键能表格及图片。
【生】1、原子半径:同类型的共价键,成键原子的原子半径越小,键长越小。
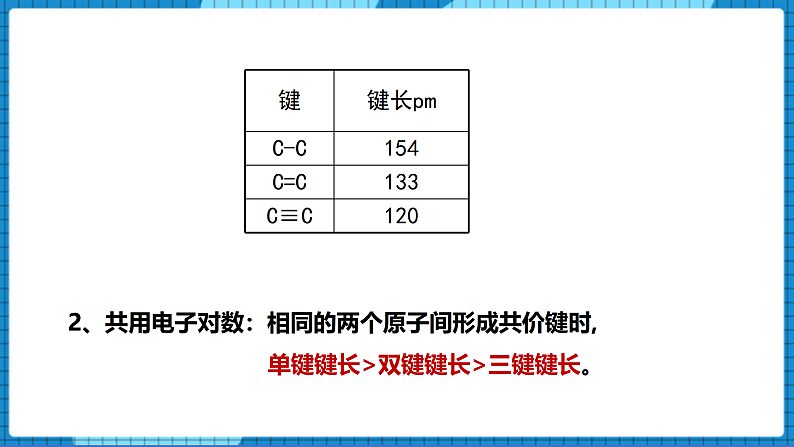
【展示】碳碳单键、双键、三键的键长表格。
【生】2、共用电子对数:相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
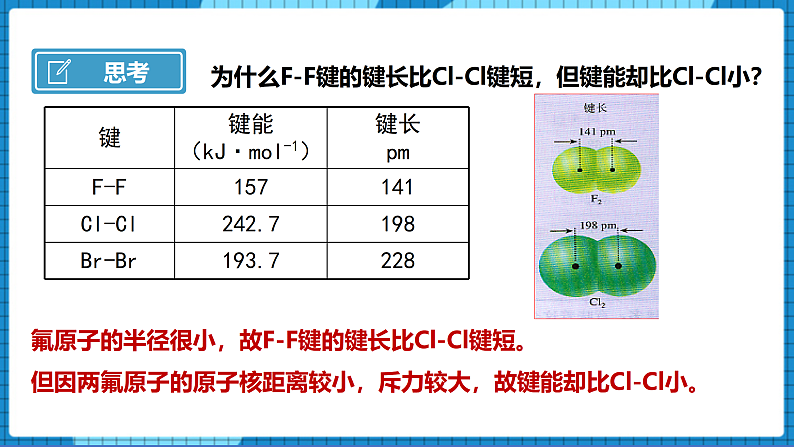
【问】为什么F-F键的键长比Cl-Cl键短,但键能却比Cl-Cl小?
【生】氟原子的半径很小,故F-F键的键长比Cl-Cl键短。
但因两氟原子的原子核距离较小,斥力较大,故键能却比Cl-Cl小。
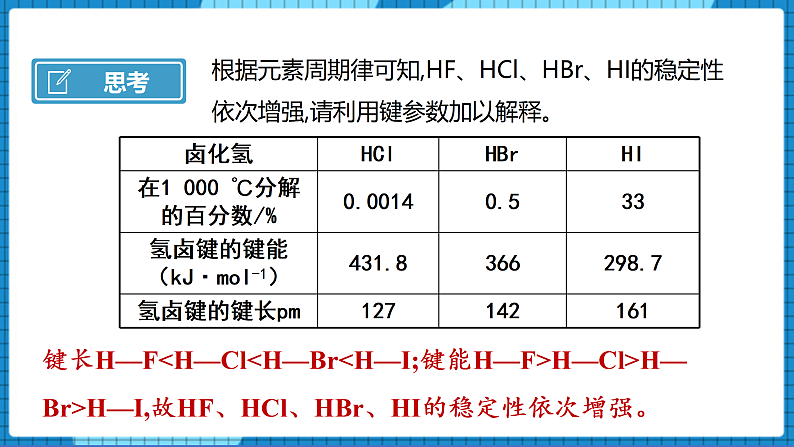
【问】根据元素周期律可知,HF、HCl、HBr、HI的稳定性依次增强,请利用键参数加以解释。
【展示】卤化氢在1 000 ℃分解的百分数/%及键长键能表
【生】键长H—F<H—Cl<H—Br<H—I;键能H—F>H—Cl>H—Br>H—I,故HF、HCl、HBr、HI的稳定性依次增强。
【展示】N2(g)和O2(g)生成NO(g)过程中的能量变化图
【讲述】化学反应中发生旧化学键的断裂和新化学键的形成。
反应物和生成物中化学键的强弱直接决定着化学反应过程中的能量变化。
【问】旧化学键断裂所吸收的总能量大于新化学键形成所放出的总能量,为什么反应?
【生】吸热反应
【问】旧化学键断裂所吸收的总能量小于新化学键形成所放出的总能量,为什么反应?
【生】放热反应
二、共价晶体
【讲述】概念:自然界中有一类晶体像金刚石一样,晶体中所有原子通过共价键结合,形成空间网状结构,像这样的晶体叫做共价晶体。
组成的粒子:原子
粒子间的作用力:共价键
【展示】元素周期表
【讲述】常见的共价晶体
(1)硼(B)、硅(Si)、锗(Ge)和灰锡(Sn)
(2)金刚砂(SiC)、氮化硅(Si3N4)和二氧化硅(SiO2)
(3)极少数金属氧化物,如刚玉(Al2O3)
由于共价键的键能大,所以共价晶体一般具有很高的熔、沸点和很大的硬度。
【展示】金刚石物质、结构、晶胞图
【讲述】在金刚石晶体里以共价键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四面体的中心。
最小的碳环由6个碳组成,且不在同一平面内。
【问】一个金刚石晶胞中,含有几个碳原子?
【展示】计算过程
【生】8个
【问】金刚石中,1 mol C 形成的共价键数目是多少?
【展示】每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为:1 :(4 x ½)= 1:2
【生】2 mol
【展示】二氧化硅晶体相关图片
【问】分析二氧化硅晶体结构模型,判断晶体中最小的环上有多少个原子?
【生】SiO2晶体中最小环上有12个原子
【问】1 mol SiO2中含有多少摩尔Si—O键?
【生】1 mol SiO2中含有4 mol Si—O键
【展示】部分共价晶体的键能、键长、熔点表
【讲述】对于结构相似的共价晶体而言,共价键的键长越长,键能就越小,晶体的熔、沸点越低,硬度越小。
【问】回顾学过的共价晶体,有哪些共同的物理性质?
【生】共价晶体的物理性质
①熔点很高
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。
②硬度很大
③一般不导电,但晶体硅是半导体
④难溶于一般溶剂
【课堂小结】师生一起回顾和总结。
【课堂练习】
1.下列说法正确的是( )
A.分子中键能越大,表示分子拥有的能量越高,共价键越难断裂
B.分子中键长越大,表示成键原子轨道重叠越多,键越牢固
C.形成化学键的过程是一个吸收能量的过程
D.形成化学键的过程是一个放出能量的过程
答案:D
2.下列有关共价晶体的叙述错误的是( )
A.共价晶体中,只存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
答案:D
3.碳化硅(SiC)是一种晶体,具有类似于金刚石的结构,其中C原子和Si原子的位置是交替排列的。有下列三种晶体:①金刚石 ②晶体硅 ③碳化硅,它们的熔点从高到低的顺序是( )
A.①③② B.②③① C.③①② D.②①③
答案:A
4.已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,计算N≡N键的键能是 kJ·mol-1。
答案:945.6
5.有关碳和硅的共价键键能如下表所示:
共价键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 348 | 413 | 351 | 226 | 318 | 452 |
简要分析和解释下列有关事实。
(1)比较通常条件下,CH4和SiH4的稳定性强弱: 。
(2)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
(3)SiH4的稳定性小于CH4,硅更易生成氧化物,原因是 。
答案:(1)CH4比SiH4稳定
(2)C—C键和C—H键键能较大,所形成的烷烃较稳定,而硅烷中Si—Si键和Si—H键的键能较小,易断裂,导致长链硅烷难以生成
(3)C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
高中化学苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第三单元 共价键 共价晶体说课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第三单元 共价键 共价晶体说课ppt课件,共34页。PPT课件主要包含了内容索引,素养阐释,自主预习新知导学,合作探究释疑解惑,问题引领,归纳提升,键能的应用,典型例题,答案B,课堂小结等内容,欢迎下载使用。
苏教版 (2019)选择性必修2第三单元 共价键 共价晶体课文内容ppt课件: 这是一份苏教版 (2019)选择性必修2第三单元 共价键 共价晶体课文内容ppt课件,共42页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,共价键的特征,问题引领,归纳提升,典型例题,共价键的分类等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第三单元 共价键 共价晶体背景图课件ppt: 这是一份高中化学苏教版 (2019)选择性必修2第三单元 共价键 共价晶体背景图课件ppt,共20页。PPT课件主要包含了共价键的键能,两原子核间的平均间距,共价晶体,共价键,空间网状,键能和键长的应用,键长的比较方法,金刚石晶胞结构等内容,欢迎下载使用。












