




高中化学苏教版 (2019)选择性必修2第一单元 分子的空间结构课堂教学课件ppt
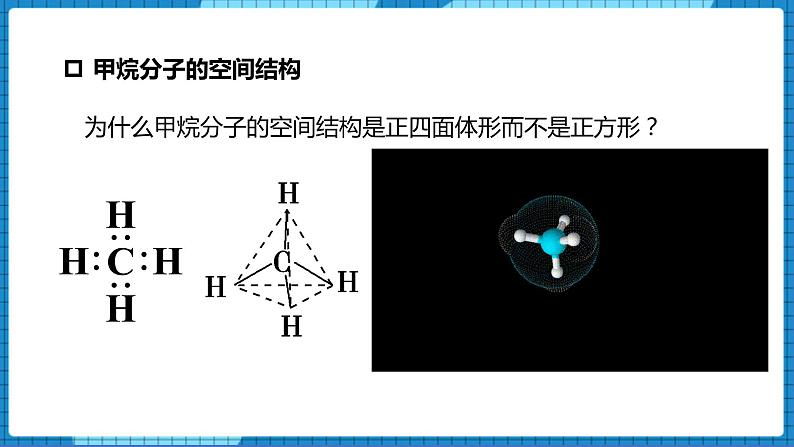
展开为什么甲烷分子的空间结构是正四面体形而不是正方形?
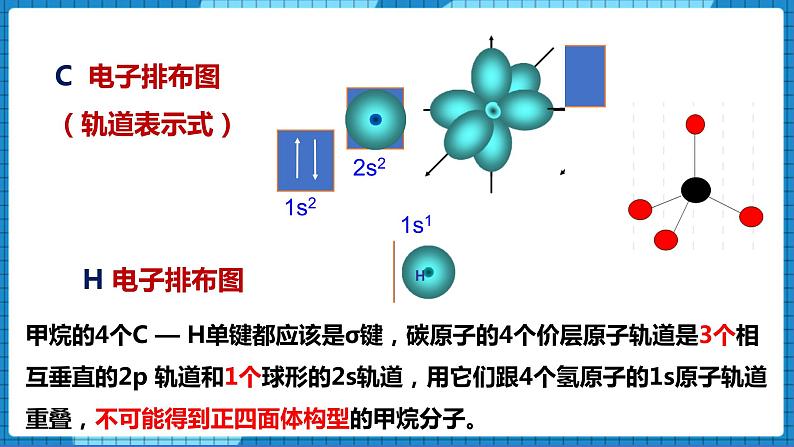
C 电子排布图(轨道表示式)
甲烷的4个C — H单键都应该是σ键,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型的甲烷分子。
鲍林还是分子生物学的奠基人之一。
鲍林在化学的多个领域都有过重大贡献,曾两次荣获诺贝尔奖(1954年化学奖,1962年和平奖)。
鲍林系统地研究了化学物质的组成、结构、性质三者的关系,于1931年提出了杂化轨道理论。
他在化学研究中创造性地提出了许多新的概念。例如,原子的共价半径、金属半径、离子半径、元素电负性标度等,这些概念的应用,对现代化学、凝聚态物理的发展都有重要的意义。
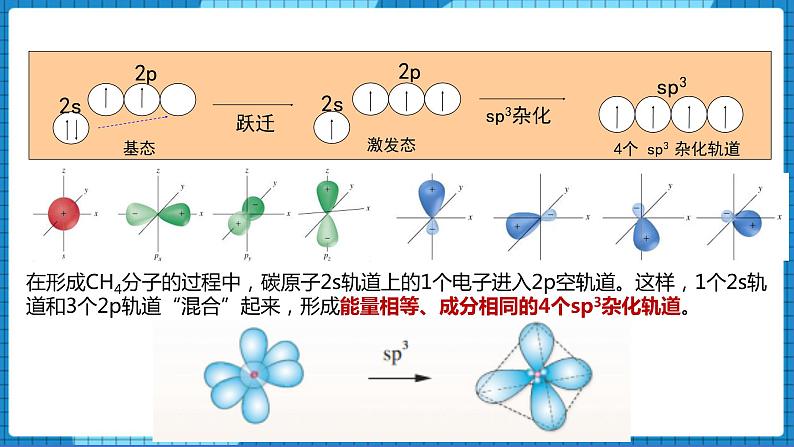
在形成CH4分子的过程中,碳原子2s轨道上的1个电子进入2p空轨道。这样,1个2s轨道和3个2p轨道“混合”起来,形成能量相等、成分相同的4个sp3杂化轨道。
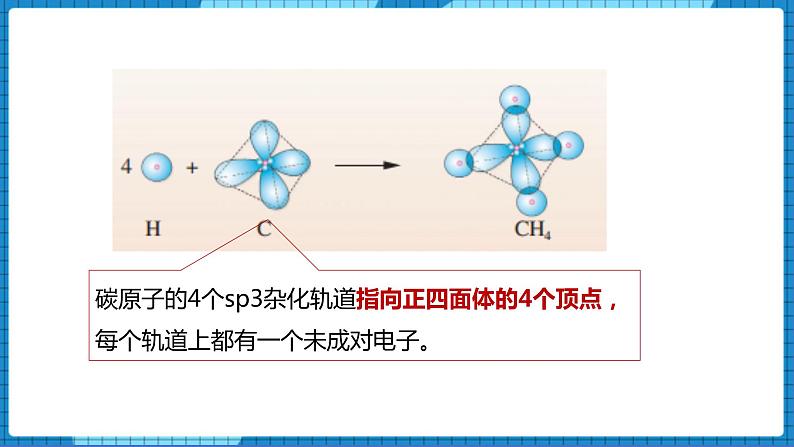
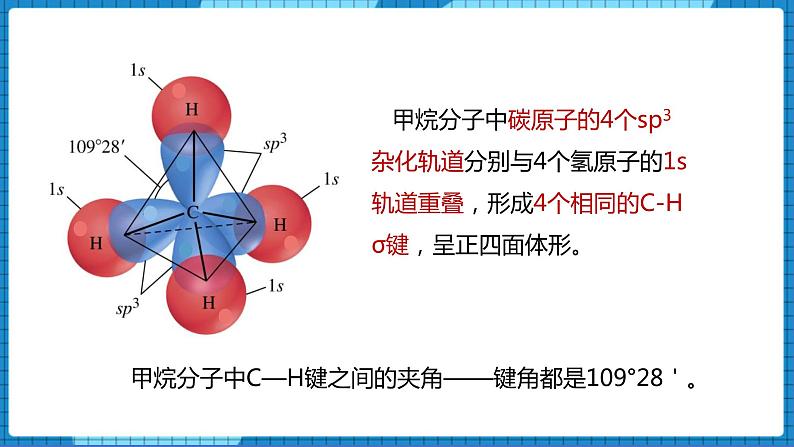
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。
甲烷分子中碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个相同的C-H σ键,呈正四面体形。
甲烷分子中C—H键之间的夹角——键角都是109°28'。
1.概念:外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
(1)参与杂化的原子轨道能量相近(同一能级组或相近能级组的轨道)
(2)杂化前后原子轨道数目不变: 参加杂化的轨道数目等于形成的杂化轨道数目; 杂化改变了原子轨道的形状、方向,成键时更有利于轨道间的重叠。
(3)杂化后的轨道之间尽可能远离,在空间取最大夹角分布,能使相互间排斥力最小。
更有利于成键:轨道成键时更有利于轨道间的重叠满足最小排斥,最大夹角分布
杂化后形成的化学键更稳定杂化轨道只用于形成σ键和容纳孤电子对
金刚石中的碳原子、晶体硅和石英(SiO2)晶体中的硅原子也是采用sp3杂化轨道形成共价键的。
正四面体结构的分子或离子的中心原子,一般采用sp3杂化轨道形成共价键,如CCl4、NH4+等。
BF3分子的结构示意图
在形成BF3分子的过程中,碳原子2s轨道上的1个电子进入2p空轨道。这样,1个2s轨道和2个2p轨道“混合”起来,形成能量相等、成分相同的3个sp2杂化轨道。
sp2杂化轨道的形成过程
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分每两个轨道间的夹角为120°,呈平面三角形。
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。
BF3是平面正三角形分子,F原子位于正三角形的三个顶点,B原子位于分子中心,分子中键角均为120°。
BeCl2分子的结构示意图
在形成BeCl2分子的过程中,碳原子2s轨道上的1个电子进入2p空轨道。这样,1个2s轨道和1个2p轨道“混合”起来,形成能量相等、成分相同的2个sp杂化轨道。
sp杂化轨道的形成过程
sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分两个轨道间的夹角为180°,呈直线形。
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道。
sp、sp2两种杂化形式中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对。
应用杂化轨道理论解释多中心原子的结构
已知:乙烯是平面分子,键角为120,分子中含有碳碳双键。 如何来确定中心原子C的杂化类型呢?
乙烯 中心原子C的sp2杂化
乙烯 中心原子C的sp2杂化过程
乙炔是直线形分子,键角为180°,分子中含有碳碳三键。乙炔分子的碳原子采用什么杂化?它的杂化轨道用于形成什么化学键?怎么理解它存在碳碳三键?
乙炔 中心原子C的sp杂化
乙炔 中心原子C的sp杂化过程
CH4 CCl4、NH4+
CH2=CH2 BF3
CH≡CH、BeCl2
1.价电子对之间的夹角越小,排斥力越小。 ( )2.NH3分子的VSEPR模型与分子空间结构不一致。( )3.五原子分子的空间结构都是正四面体形。( )4.杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( )5.凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )6.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )
1.判断正误(正确的打“√”,错误的打“×”)
选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构授课课件ppt: 这是一份选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构授课课件ppt,共39页。PPT课件主要包含了内容索引,素养阐释,自主预习新知导学,合作探究释疑解惑,问题引领,归纳提升,典型例题,课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第一单元 分子的空间结构教学演示课件ppt: 这是一份高中化学苏教版 (2019)选择性必修2第一单元 分子的空间结构教学演示课件ppt,共36页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,等电子原理,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子的空间结构备课课件ppt: 这是一份人教版 (2019)选择性必修2第二节 分子的空间结构备课课件ppt,共24页。PPT课件主要包含了学习目标,多样的分子空间结构,分子结构的测定,质谱仪,CO2,H2O等内容,欢迎下载使用。













