



还剩12页未读,
继续阅读
所属成套资源:苏教版高中化学选择性必修2课件PPT全册
成套系列资料,整套一键下载
苏教版 (2019)选择性必修2第三单元 共价键 共价晶体公开课ppt课件
展开
这是一份苏教版 (2019)选择性必修2第三单元 共价键 共价晶体公开课ppt课件,共20页。PPT课件主要包含了先变小后变大,共价键的本质,共价键的形成条件,共价键的表示方法,共价键的类型,活动与探究,σ键和π键的比较,强度大不易断裂,强度较小易断裂,有机物中的共价键等内容,欢迎下载使用。
1.能说出共价键的概念与形成,知道共价键的特征——具有饱和性和方向性。2. 了解σ键和π键的形成及特点。3. 了解共价晶体的结构与性质。4. 了解共价晶体的特征,能描述金刚石、二氧化硅等共价晶体的结构与性质的关系。
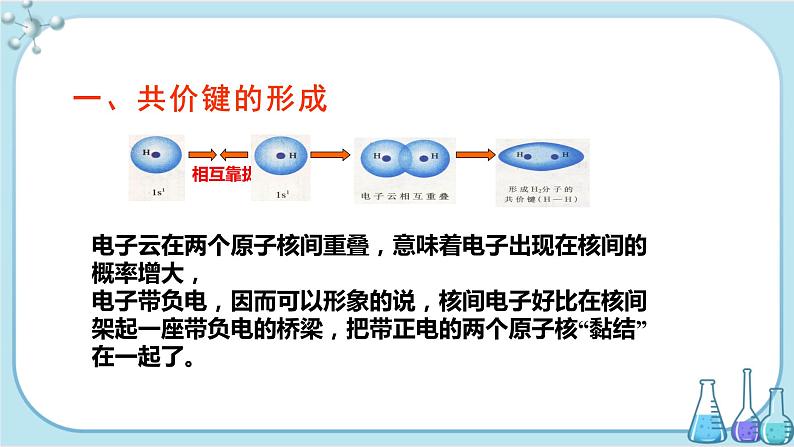
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
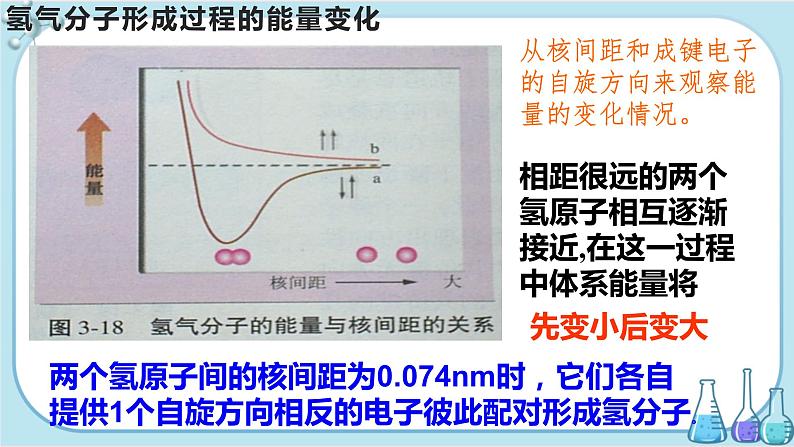
氢气分子形成过程的能量变化
从核间距和成键电子的自旋方向来观察能量的变化情况。
相距很远的两个氢原子相互逐渐接近,在这一过程中体系能量将
两个氢原子间的核间距为0.074nm时,它们各自提供1个自旋方向相反的电子彼此配对形成氢分子。
当成键原子相互接近时,由于电子在两个原子核之间出现的概率增加,使它们同时受到两个原子核的吸引,从而使体系能量降低,形成化学键。即高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用是共价键的本质。
电负性相同或差值小的非金属元素原子形成的化学键为共价键
用一条短线表示由一对共用电子所形成的共价键,依次类推“=”表示共价双键
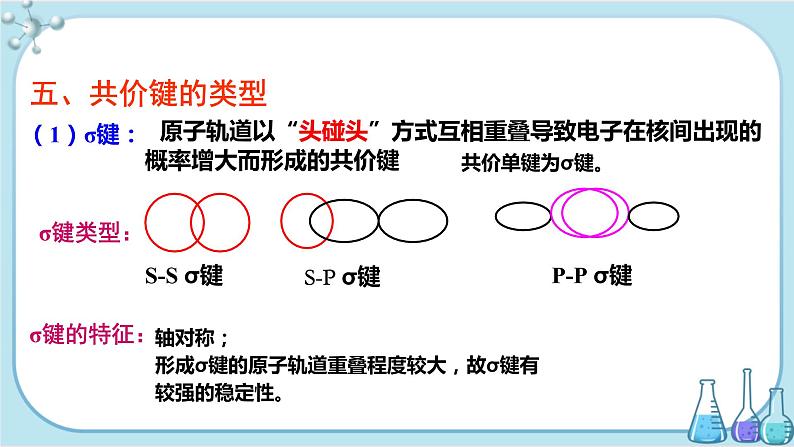
原子轨道以“头碰头”方式互相重叠导致电子在核间出现的概率增大而形成的共价键
轴对称;形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
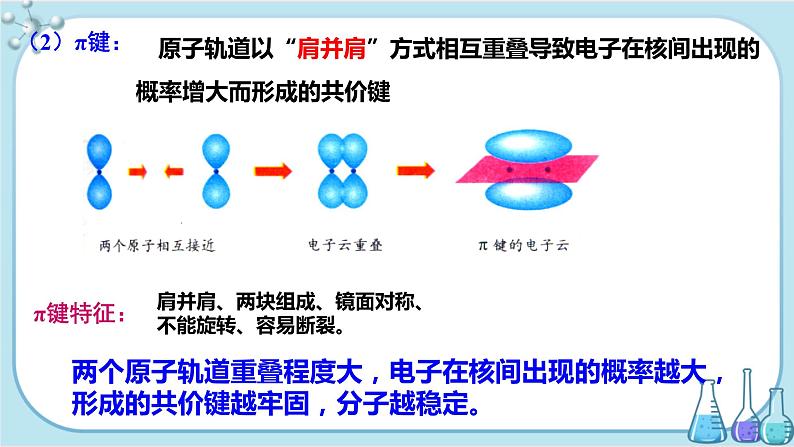
原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键
肩并肩、两块组成、镜面对称、不能旋转、容易断裂。
两个原子轨道重叠程度大,电子在核间出现的概率越大,形成的共价键越牢固,分子越稳定。
已知氮分子的共价键是叁键,你能写出它的电子式吗?氮原子的原子轨道是如何形成共价键的?
(提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键。
s电子和s电子、s电子和p电子只能形成σ键;p电子和p电子既可形成σ键,又可能形成π键;且 p电子和p电子先形成σ键,后形成π键。
共价单键是 键,共价双键中一个是 键,另一个是 键,共价三键中一个是 键,另两个为 键
乙烷: 个σ键 乙烯: 个σ键 个π键 乙炔: 个σ键 个π键
4、乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。
(1)、共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。如:H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子
(2)共价键具有方向性
原子在形成共价键时,首先选择电子云重叠最多的方式,电子云最大重叠的方向
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
共价键的方向性决定着分子的空间构型。
因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。
1、非极性键:共用电子不偏向任何一个原子的共价键, 同种非金属元素的原子形成的共价键。2、极性键:共用电子发生偏向的共价键,偏向吸引电子能力大的一方 不同种非金属元素的原子形成的共价键。 成键原子的电负性相差越大,键的极性越强。
依据成键原子所属元素电负性差值的大小,极性键可分为强极性键和弱极性键,当电负性差值为零时,形成非极性共价键;差值不为零时,形成极性共价键,而且差值越小,形成的共价键极性越弱。
八、共价晶体 1.共价晶体(1)共价晶体的定义相邻原子间以共价键结合而形成的具有三维骨架结构的晶体称为共价晶体。(2)常见的共价晶体①某些单质:如金刚石(C)、晶体硼(B)、晶体硅(Si)、晶体锗(Ge)等。②某些化合物:如碳化硅晶体(SiC)、二氧化硅晶体(SiO2)、氮化硼晶体(BN)、氮化铝(AlN)等。(3)共价晶体的物理性质共价晶体的熔点很高,硬度很大。对结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的熔点就越高。
例3 已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法不正确的是( )A.该晶体属于共价晶体B.该晶体熔化时破坏分子间作用力C.该晶体中C—N键的键能比金刚石中C—C键的键能大D.该晶体中每个氮原子连接3个碳原子,每个碳原子连接4个氮原子
{2}金刚石和二氧化硅结构
例4 下列有关共价晶体的叙述不正确的是( )A.金刚石和二氧化硅晶体的最小结构单元都是正四面体结构B.含1 ml C的金刚石中C—C键数目是2NA,1 ml SiO2晶体中Si—O键数目是4NAC.水晶和干冰在熔化时,晶体中的共价键都会断裂D. SiO2晶体是共价晶体,所以晶体中不存在分子,SiO2不是它的分子式
解析:A对,金刚石是1个中心碳原子连接4个碳原子,二氧化硅是1个中心硅原子连接4个氧原子,均为正四面体结构。B对,金刚石中,1个C原子与另外4个C原子形成4个C—C键,这个C原子对每个单键的贡献只有 ,所以1 ml C原子形成的C—C键为4 ml× =2 ml,而二氧化硅晶体中1个Si原子分别与4个O原子形成4个Si—O键,则1 ml SiO2晶体中Si—O键为4 ml。C错,干冰熔化时只破坏分子间作用力,共价键不会断裂。D对,共价晶体中不存在分子。
1.能说出共价键的概念与形成,知道共价键的特征——具有饱和性和方向性。2. 了解σ键和π键的形成及特点。3. 了解共价晶体的结构与性质。4. 了解共价晶体的特征,能描述金刚石、二氧化硅等共价晶体的结构与性质的关系。
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
氢气分子形成过程的能量变化
从核间距和成键电子的自旋方向来观察能量的变化情况。
相距很远的两个氢原子相互逐渐接近,在这一过程中体系能量将
两个氢原子间的核间距为0.074nm时,它们各自提供1个自旋方向相反的电子彼此配对形成氢分子。
当成键原子相互接近时,由于电子在两个原子核之间出现的概率增加,使它们同时受到两个原子核的吸引,从而使体系能量降低,形成化学键。即高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用是共价键的本质。
电负性相同或差值小的非金属元素原子形成的化学键为共价键
用一条短线表示由一对共用电子所形成的共价键,依次类推“=”表示共价双键
原子轨道以“头碰头”方式互相重叠导致电子在核间出现的概率增大而形成的共价键
轴对称;形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键
肩并肩、两块组成、镜面对称、不能旋转、容易断裂。
两个原子轨道重叠程度大,电子在核间出现的概率越大,形成的共价键越牢固,分子越稳定。
已知氮分子的共价键是叁键,你能写出它的电子式吗?氮原子的原子轨道是如何形成共价键的?
(提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键。
s电子和s电子、s电子和p电子只能形成σ键;p电子和p电子既可形成σ键,又可能形成π键;且 p电子和p电子先形成σ键,后形成π键。
共价单键是 键,共价双键中一个是 键,另一个是 键,共价三键中一个是 键,另两个为 键
乙烷: 个σ键 乙烯: 个σ键 个π键 乙炔: 个σ键 个π键
4、乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。
(1)、共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。如:H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子
(2)共价键具有方向性
原子在形成共价键时,首先选择电子云重叠最多的方式,电子云最大重叠的方向
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
共价键的方向性决定着分子的空间构型。
因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。
1、非极性键:共用电子不偏向任何一个原子的共价键, 同种非金属元素的原子形成的共价键。2、极性键:共用电子发生偏向的共价键,偏向吸引电子能力大的一方 不同种非金属元素的原子形成的共价键。 成键原子的电负性相差越大,键的极性越强。
依据成键原子所属元素电负性差值的大小,极性键可分为强极性键和弱极性键,当电负性差值为零时,形成非极性共价键;差值不为零时,形成极性共价键,而且差值越小,形成的共价键极性越弱。
八、共价晶体 1.共价晶体(1)共价晶体的定义相邻原子间以共价键结合而形成的具有三维骨架结构的晶体称为共价晶体。(2)常见的共价晶体①某些单质:如金刚石(C)、晶体硼(B)、晶体硅(Si)、晶体锗(Ge)等。②某些化合物:如碳化硅晶体(SiC)、二氧化硅晶体(SiO2)、氮化硼晶体(BN)、氮化铝(AlN)等。(3)共价晶体的物理性质共价晶体的熔点很高,硬度很大。对结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的熔点就越高。
例3 已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法不正确的是( )A.该晶体属于共价晶体B.该晶体熔化时破坏分子间作用力C.该晶体中C—N键的键能比金刚石中C—C键的键能大D.该晶体中每个氮原子连接3个碳原子,每个碳原子连接4个氮原子
{2}金刚石和二氧化硅结构
例4 下列有关共价晶体的叙述不正确的是( )A.金刚石和二氧化硅晶体的最小结构单元都是正四面体结构B.含1 ml C的金刚石中C—C键数目是2NA,1 ml SiO2晶体中Si—O键数目是4NAC.水晶和干冰在熔化时,晶体中的共价键都会断裂D. SiO2晶体是共价晶体,所以晶体中不存在分子,SiO2不是它的分子式
解析:A对,金刚石是1个中心碳原子连接4个碳原子,二氧化硅是1个中心硅原子连接4个氧原子,均为正四面体结构。B对,金刚石中,1个C原子与另外4个C原子形成4个C—C键,这个C原子对每个单键的贡献只有 ,所以1 ml C原子形成的C—C键为4 ml× =2 ml,而二氧化硅晶体中1个Si原子分别与4个O原子形成4个Si—O键,则1 ml SiO2晶体中Si—O键为4 ml。C错,干冰熔化时只破坏分子间作用力,共价键不会断裂。D对,共价晶体中不存在分子。












