

高中化学苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第三单元 共价键 共价晶体第2课时学案
展开一、共价键键能与化学反应的反应热
1.共价键的键参数
(1)键能
在101 kPa、298 K条件下,1 ml气态AB分子生成气态A原子和B原子的过程中所吸收的能量,称为AB间共价键的键能。键能的单位是kJ· ml-1。
(2)键长
两个原子形成共价键时,两原子核间的平均间距。
(3)共价键的影响因素
键长越短,键能越大,共价键就越稳定。
2.键能与化学反应热的关系
ΔH=反应物的总键能—生成物的总键能
若ΔH>0,则该反应为吸热反应;若ΔH<0,则该反应为放热反应。
1.利用共价键的键参数解释气态氢化物稳定性:HF>HCl>HBr>HI的原因:______________________________________________
____________________________________________________________________。
[答案] 键长:H—F
(1)已知几种键能数据如下表:
则2H2(g)+CO(g)===CH3OH(g)ΔH=________kJ·ml-1
[解析] (1)反应热等于断裂化学键吸收的总能量与形成化学键放出的总能量之差。ΔH=(436×2+1 076-413×3-343-465)kJ/ml=-99 kJ·ml-1。
[答案] -99
二、共价晶体
1.共价晶体简介
(1)概念
所有原子通过共价键结合,形成空间网状结构的晶体。
(2)结构特征
①共价晶体中只存在原子,原子间全部通过共价键相结合。
②共价晶体中不存在单个分子。如SiO2代表硅原子和氧原子的原子个数比为1∶2,并不代表分子。
(3)常见的共价晶体
①某些非金属单质:如金刚石、晶体硅、晶体硼等。
②某些非金属化合物:如金刚砂(SiC)、二氧化硅(SiO2)、氮化硼(BN)、氮化硅(Si3N4)等。
(4)共价晶体的物理性质
①共价晶体一般有很高的熔点、沸点和很大的硬度。
②键长越短,键能越大,熔点、沸点越高,硬度就越大。
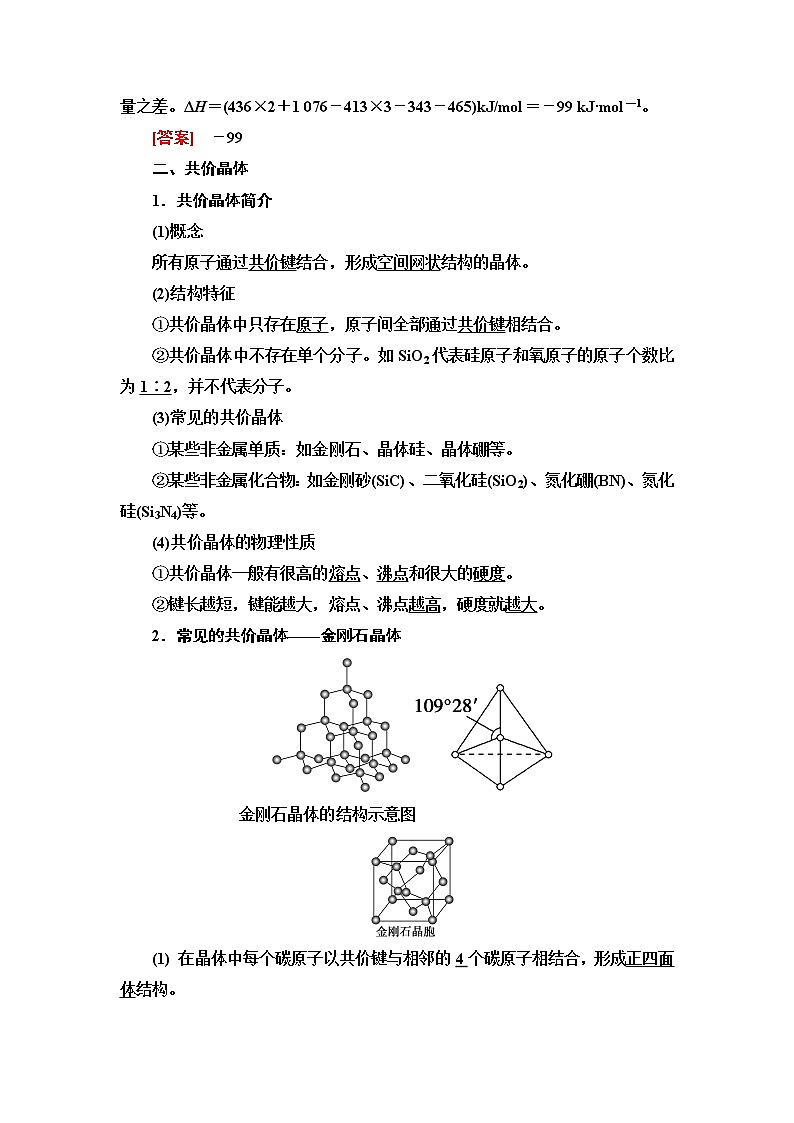
2.常见的共价晶体——金刚石晶体
金刚石晶体的结构示意图
(1) 在晶体中每个碳原子以共价键与相邻的4个碳原子相结合,形成正四面体结构。
(2) 晶体中C—C—C夹角为109°28′_。
(3) 最小环上有6个碳原子。
判断正误(正确的打“√”,错误的打“×”)
(1)共价晶体中一定含有共价键,可能含有离子键。(×)
(2)二氧化硅的分子式为SiO2。(×)
(3)共价晶体的熔点一定比金属晶体的高。(×)
(4)共价晶体的熔点一定比离子晶体的高。(×)
(5)下列物质的熔点:金刚石>金刚砂( SiC)>晶体硅。(√)
(6)12 g金刚石中含有2NA个C—C键。(√)
还原法处理氮的氧化物是环境科学研究的热点课题。氢气还原法:H2还原NO发生的反应为2NO(g)+2H2(g)===N2(g)+2H2O(g)。几种化学键的键能数据如下:
[问题1] 表格中的四种共价键,键能最大和键长最长的共价键分别是哪两种?
[提示] 键能最大的是N≡N,键长最长的是 H—H。
[问题2] H2还原NO的反应:2NO(g)+2H2(g)===N2(g)+2H2O(g)中,反应物总键能和生成物总键能分别为多少?
[提示] 反应物总键能为2×436 kJ·ml-1+2×630 kJ·ml-1=2132 kJ·ml-1,生成物总键能为946 kJ·ml-1+4×463 kJ·ml-1=2798 kJ·ml-1.
[问题3] 2NO(g)+2H2(g)===N2(g)+2H2O(g)反应的焓变 ΔH为多少?
[提示] ΔH =2132 kJ·ml-1-2798 kJ·ml-1=-666 kJ·ml-1。
[问题4] 反应热 ΔH与反应物的键能、生成物的键能有何关系?
[提示] 反应热 ΔH=反应物的键能总和—生成物的键能总和。
一、键参数的意义
1.键能的意义
键能是衡量共价键稳定性的一个重要参数。键能越大,即形成共价键时放出的热量越多,共价键越稳定。例如:
① N2分子的化学性质很稳定,是因为N≡N的键能很大(946 kJ·ml-1)。
② H—F、H—Cl、H—Br、H—I键的键能依次为567 kJ·ml-1、431 kJ·ml-1、366 kJ·ml-1、298 kJ·ml-1,键能逐渐减小,HF、HCl、HBr、HI分子的稳定性逐渐减弱。
③CH2===CH2中C===C键的键能(615 kJ·ml-1)小于C2H6中C—C键的键能(348 kJ·ml-1)的两倍,CH≡CH中C≡C键的键能(812 kJ·ml-1)小于C—C键的键能的3倍,也小于C—C键、C===C键的键能之和,表明乙烯、乙炔分子中的π键不如σ键牢固,比较容易断裂。
2.键长的意义
键长是衡量共价键稳定性的另一个参数。键长越短,往往键能越大,表明共价键越稳定。键能和键长共同决定键的稳定性和分子的性质。例如:
①F—F、Cl—Cl、Br—Br、I—I的键长逐渐增大,分子的稳定性逐渐减弱。
②当两个原子间形成双键、三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,即键长变短。如C—C、C===C、C≡C的键长分别为154 pm、133 pm、120 pm。
二、化学键与反应热的关系
1.定性关系
化学反应中发生旧化学键断裂和新化学键形成,如果旧化学键断裂所吸收的总能量大于新化学键形成所放出的总能量,则该化学反应为吸热反应;反之,该化学反应为放热反应。
2.定量关系
能量变化=反应物的键能总和-生成物键能总和(特别注意,键能是指共价键,其他化学键的能量不能叫做键能)。
1.某些化学键的键能数据如表,若1 ml H2与1 ml Cl2完全燃烧(H2+Cl2===2HCl),则下列说法正确的是( )
A.反应共吸收248 kJ热量
B.反应共放出248 kJ热量
C.反应共吸收183 kJ热量
D.反应共放出183 kJ热量
D [由化学反应能量变化与化学键键能的关系,得该反应的能量变化=反应物总键能-生成物总键能=(436+243-2×431)kJ·ml-1=-183 kJ·ml-1,即反应放出183 kJ热量,故选D。]
2.工业合成氨的反应N2+3H2===2NH3的能量变化如图所示,请回答有关问题:
(1)合成1 ml NH3(l)________(填“吸收”或“放出”)________kJ的热量(用字母表示)。
(2)已知:拆开1 ml H—H键、1 ml N—H键、1 ml NN键分别需要的能量是436 kJ、391 kJ、946 kJ,则1 ml N2(g)完全反应生成NH3(g)产生的能量变化为________kJ。
(3)推测反应2NH3(l)===N2(g)+3H2(g)比反应2NH3(g)===N2(g)+3H2(g)________(填“吸收”或“放出”)的热量________(填“多”或“少”)。
[解析] (1)反应物的总能量大于生成物的总能量,此反应为放热反应,则由能量变化图,合成1 ml NH3(l)则放出的热量等于(b+c-a)kJ。
(2)上图中的a等于断裂0.5 ml氮气和1.5 ml氢气所吸收的热量,即(946×0.5+436×1.5)kJ=1127 kJ;1 ml N2(g)完全反应则消耗3 ml氢气生成2 mlNH3(g)产生的能量变化为(946+436×3-391×6)kJ=-92 kJ。
(3)因为合成NH3放出热量,所以氨气分解则吸收热量,又液体氨气转化为气态还要吸热,所以液态氨分解吸收的热量比气态氨吸收的热量多。
[答案] (1)放出 b+c-a (2)-92 (3) 吸收 多
二氧化硅又称硅石,化学式为SiO2。自然界中存在有结晶二氧化硅和无定形二氧化硅两种。结晶二氧化硅因晶体结构不同,分为石英、鳞石英和方石英三种。纯石英为无色晶体,大而透明棱柱状的石英叫水晶。含有微量杂质的水晶带有不同颜色,有紫水晶、茶晶、墨晶等。普通的砂是细小的石英晶体,有黄砂(较多的铁杂质)和白砂(杂质少、较纯净)。晶体硅和金刚石晶体结构相似,二氧化硅晶体可以看做晶体硅中Si—Si键断裂插入O原子。
二氧化硅晶体的结构示意图
[问题1] 二氧化硅晶体中每个硅原子与多少个氧原子连接?每个氧原子与多少个硅原子连接?每个硅原子形成多少个共价键?
[提示] 4;2;4。
[问题2] 二氧化硅晶体中每个硅原子与紧邻的氧原子构成什么构型?相邻硅氧键夹角为多少?
[提示] 正四面体型;109°28′。
[问题3] 二氧化硅晶体最小环上有多少个原子?
[提示] 12。
[问题4] 60 g二氧化硅晶体中含有Si、O、Si—O键数目分别为多少?(NA表示阿伏加德罗常数)
[提示] NA;2NA;4NA。
一、共价晶体的结构特点和性质
1.结构特点
共价晶体是原子间以共价键结合而形成的空间网状结构,晶体中不存在单个分子。
共价键的饱和性和方向性分别决定了每个原子周围配位数的多少和键角的大小,所以共价晶体不遵循紧密堆积原则,而是较松散排列的结构。如金刚石晶体中,每个碳原子周围排列的碳原子只能有四个。
2.物理性质的特点
(1)因为共价晶体中原子间以较强的共价键相结合,熔化时需要很多的能量克服共价键。所以共价晶体的熔、沸点很高,硬度很大。
(2)因为构成共价晶体的原子最外层电子都成键,结构稳定,键能较大,所以共价晶体一般不导电,难溶于水。
3.物理性质的变化规律
在结构相似的情况下,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
二、典型共价晶体的结构特征
1.金刚石晶体的结构
(1)成键特征:每个碳原子与相邻的4个碳原子形成4个共价键,键长相等,键角为109°28′,每个碳原子的配位数为4。
(2)结构单元:每个碳原子均与相邻的4个碳原子构成正四面体,向空间无限延伸得到立体网状结构的晶体,在1个正四面体中含有1+4×eq \f(1,4)=2个碳原子。
(3)晶胞:①8个顶点,6个面心上各有1个碳原子;②把晶胞分割分8个小立方体,则每个小立方体的互为对角位置的4个顶点各有1个碳原子,4个互不相邻的小立方体的体心各有1个碳原子。则每个金刚石晶胞中有8个碳原子。
(4)金刚石晶体中每个C原子形成4个C—C键,而每个键为2个C原子所共有,故碳原子的个数与C—C键数比为1∶ (4×eq \f(1,2))=1∶ 2。因此12 g(1 ml)金刚石中含有2 ml C—C键。
2.晶体硅、碳化硅晶体的结构
(1)晶体硅:将金刚石晶胞中的碳原子换成硅原子,就是晶体硅的晶胞。每个晶体硅晶胞中有8个硅原子。
(2)碳化硅:将晶体硅晶胞的顶点、面心上的硅原子换成碳原子,体内4个硅原子不变,就是碳化硅的晶胞(如图)。
每个碳化硅晶胞中有4个碳原子、4个硅原子。
(3)1 ml晶体硅中含有2 ml Si—Si键,1 ml SiC中含有4 ml Si—C键。
3.二氧化硅(石英)晶体的结构
晶体硅的结构示意图
二氧化硅的结构示意图
(1)二氧化硅晶体可以看作是在晶体硅中2个硅原子之间插入了1个氧原子。每个硅原子与4个氧原子结合,硅原子位于正四面体的中心,氧原子位于正四面体的顶点。
(2)每个氧原子为2个正四面体共有,每个正四面体中占有1个完整的硅原子。因此硅氧原子的个数比为1∶(4×eq \f(1,2))=1∶2。因此二氧化硅晶体中并不存在单个的SiO2分子,它是由硅原子和氧原子按1∶2的比例组成的空间立体网状结构的晶体。
(3)1 ml SiO2含有4 ml Si—O键。
1.下列各组物质熔点高低的比较,正确的是( )
A.Mg>Al>Na
B.MgO>NaCl>KCl
C.晶体硅>金刚石>碳化硅
D.冰>金刚石>NaCl
B [Al、Mg、Na都是金属晶体,Al、Mg、Na核电荷数顺序:Al>Mg>Na;原子半径顺序:Al<Mg<Na,金属晶体中原子半径越小,电荷越多,熔点越高,所以熔点顺序:Al>Mg>Na,A错误;MgO、NaCl、KCl都是离子晶体,镁离子半径小于钠离子、钾离子半径,氧负离子半径小于氯离子半径;离子晶体中阴阳离子半径越小,电荷越大,熔点越高;所以熔点高低顺序为MgO>NaCl>KCl,B正确;晶体硅、金刚石、碳化硅都是共价晶体,因键长C—C<C—Si<Si—Si,共价晶体中半径越小,共价键越强,熔点越高,则熔点高低顺序为金刚石>碳化硅>晶体硅,C错误;熔点高低顺序为金刚石>NaCl>冰,D错误。]
2.设NA为阿伏加德罗常数的值。下列说法中正确的是
A.12 g金刚石中含有C—C的个数为4NA
B.40 g金刚砂晶体(SiC)中含有C—Si的个数为2NA
C.28 g晶体硅中含有Si—Si键的个数为2NA
D.SiO2晶体中1 ml硅原子可与氧原子形成2NA个共价键(Si—O)
C [金刚石中每个C原子形成4个C—C键,每个C—C键被两个C原子共用,则每个C具有4×eq \f(1,2)=2个C—C键,12 g金刚石含有1 ml碳原子,含有C—C的个数为2NA,A错误;金刚砂晶体中1个C原子连4个Si原子,1个Si原子连4个C原子,40 g金刚砂晶体(SiC)中含有1 ml碳原子和1 ml硅原子,含有C—Si的个数为4NA,B错误;与金刚石类似,晶体硅中每个Si原子形成Si—Si键,28 g晶体硅物质的量为1 ml,因此中含有Si—Si键的个数为2NA,C正确;SiO2晶体中每个Si与周围4个O原子结合形成4个Si—O键,因此SiO2晶体中每摩尔硅原子可与氧原子形成4NA个共价键(Si—O键),D错误。]
3.(双选)美国加州Livermre国家实验室物理学家Chng-Shik和他的同事们,在40Gpa的高压容器中,用Nd:YbLiF4激光器将液态二氧化碳加热到1800 K,二氧化碳转化为与石英具有相似结构的晶体。估计该晶体可能具有的结构或性质是( )
A.该晶体属于共价晶体
B.硬度与金刚石相近
C.熔点较低
D.硬度较小
AB [该晶体结构与石英晶体即SiO2晶体相似,属于共价晶体,A正确;该晶体属于共价晶体,故硬度与金刚石相近,B正确;该晶体为共价晶体,具有较高的熔点,C错误;该晶体为共价晶体,硬度较大,D错误。]
1.(2021·江苏淮安市·高二期中)炼铁过程中发生的3CO+Fe2O3eq \(=====,\s\up10(高温))3CO2+2Fe为放热反应,下列说法正确的是( )
A.断开C≡O键放出热量
B.形成C===O键吸收热量
C.放热反应都需要加热
D.有的吸热反应不需要加热
D [断键吸热,A错误;形成化学键放出热量,B错误;放热反应不一定需要加热,如酸碱中和反应常温下即可进行,C错误;有些吸热反应常温下即可发生,如氢氧化钡晶体与氯化铵的反应,D正确。]
2.(2021·山东滨州市·高二期中)氮氧化铝(AlON)属于共价晶体,是一种超强透明材料,下列描述错误的是( )
A.AlON和Al的晶体类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和石英的化学键类型相同
A [AlON是共价晶体,Al是金属晶体,A错误;AlON是共价晶体,石英的主要成分是SiO2,SiO2也是共价晶体,B正确;AlON是共价晶体,原子间是共价键,Al2O3是离子化合物,Al和O之间是离子键,C正确;AlON是共价晶体,原子间是共价键,石英的主要成分是SiO2,SiO2也是共价晶体,原子间也是共价键,D正确。]
3.通常人们把拆开1 ml化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以计算化学反应的反应热。下列是一些化学键的键能。
根据键能数据估算反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热为( )
A.-1 940 kJ·ml-1B.+1 940 kJ·ml-1
C.-485 kJ·ml-1D.+485 kJ·ml-1
A [由反应热ΔH=反应物键能之和-生成物键能之和可得,ΔH=(414 kJ·ml-1×4+4×155 kJ·ml-1)-(489 kJ·ml-1×4+4×565 kJ·ml-1)=-1940 kJ·ml-1,故选A。]
4.我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是( )
A.11BN 和10BN的化学性质相似
B.该晶体具有良好的导电性
C.该晶胞中含有14个B原子,4个N原子
D.B原子周围等距且最近的B原子数为6
A [11B和10B互为同位素,11B和10B的化学性质相似,故11BN和10BN的化学性质相似,A正确;该晶体为立方氮化硼晶体,属于由共价键形成的共价晶体,没有导电性,B错误;B原子位于晶胞的8个顶点和6个面心,该晶胞中含B为8×eq \f(1,8)+6×eq \f(1,2)=4个,N原子都在晶胞内,有4个N原子,C错误;由晶胞可知,B原子位于晶胞的8个顶点和6个面心,以1个顶点的B原子为研究对象,1个晶胞中与顶点B原子等距且最近的B有3个(位于3个面心),由于顶点B原子为8个晶胞共有、面心B原子为2个晶胞共有,则B原子周围等距且最近的B原子数为eq \f(8×3,2)=12,D错误。]
5.化学键的键能是指气态基态原子间形成1 ml 化学键时释放的最低能量。如:H(g)+I(g)―→H—I(g) ΔH=+297 kJ/ml,即H—I键的键能为297 kJ/ml,也可以理解为破坏1 ml H—I 键需要吸收297 kJ的热量。化学反应的发生可以看成旧化学键的断裂和新化学键的形成。下表是一些键能数据(单位:kJ/ml):
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性________(填“大于”或“小于”)CF4的稳定性。试预测C—Br键的键能范围:________
(3)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大)。________(填“能”或“不能”)。
②非金属性越强的原子形成的共价键越牢固。________(填“能”或“不能”)。从数据中找出一些规律,请写出一条:____________________________
____________________________________________________________________。
[解析] (1)键能越大,分子越稳定。C—Cl键键能为330 kJ/ml,C—F键键能为427 kJ/ml,所以CF4更稳定;F、Cl、Br、I是同主族元素,原子半径越来越大,与C形成的共价键的键长越来越长,键能越来越小,所以C—Br键的键能大小介于C—I键键能和C—Cl键键能之间。
(2)ΔH=反应物键能之和-生成物键能之和=436 kJ/ml+243 kJ/ml-2×432 kJ/ml=-185 kJ/ml,所以Q=185。
(3)①H的原子半径小于F的原子半径,但是H—H键键能小于H—F键键能,所以①结论不正确;②Cl的非金属性强于S,但是S—S键键能大于Cl—Cl键键能,所以②结论不正确;从H—F、H—Cl;C—F、C—Cl;H—O、H—S几组键的键能中可得出:与相同原子结合时,同主族元素形成的共价键,原子半径越小,共价键越牢固。
[答案] (1)小于 218 kJ/ml 330 kJ/ml (2)185 (3)①不能 ②不能 与相同原子结合时,同主族元素形成的共价键,原子半径越小,共价键越牢固学 习
任 务
1.能分析共价键的键能与化学反应中能量变化的关系。
2.能根据共价晶体的微观结构预测其性质。
化学键
H—H
C—O
C≡O
H—O
C—H
E/(kJ·ml-1)
436
343
1 076
465
413
共价键的键能与化学反应的反应热
化学键
H—H
NO中的
共价键
N≡N
H—O
键能(kJ·ml-1)
436
630
946
463
化学键
Cl—Cl
H—H
H—Cl
键能/kJ·ml-1
243
436
431
共价晶体的结构与性质
化学键
C—H
C—F
H—F
F—F
键能/(kJ·ml-1)
414
489
565
155
高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型导学案: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型导学案,共16页。学案主要包含了共价晶体,分子晶体,晶体结构的复杂性等内容,欢迎下载使用。
苏教版 (2019)选择性必修2第四单元 分子间作用力 分子晶体第2课时学案设计: 这是一份苏教版 (2019)选择性必修2第四单元 分子间作用力 分子晶体第2课时学案设计,共13页。学案主要包含了分子晶体,晶体的共性与个性等内容,欢迎下载使用。
化学选择性必修2第三单元 共价键 共价晶体第1课时学案: 这是一份化学选择性必修2第三单元 共价键 共价晶体第1课时学案,共12页。学案主要包含了共价键的形成,共价键的类型等内容,欢迎下载使用。













