
- 沪教版化学九上 第5章 金属的冶炼与利用 试卷 试卷 1 次下载
- 沪教版化学九上 第1章综合检测 试卷 5 次下载
- 沪教版化学九上 第2章综合检测 试卷 4 次下载
- 沪教版化学九上 第3章综合检测 试卷 2 次下载
- 沪教版化学九上 第4章综合检测 试卷 4 次下载
沪教版化学九上 第5章综合检测
展开第5章综合检测
(时间:60 分钟 满分:100 分)
一、选择题(本题包括15小题,每小题2分,共30分,每小题只有一个选项符合题意)
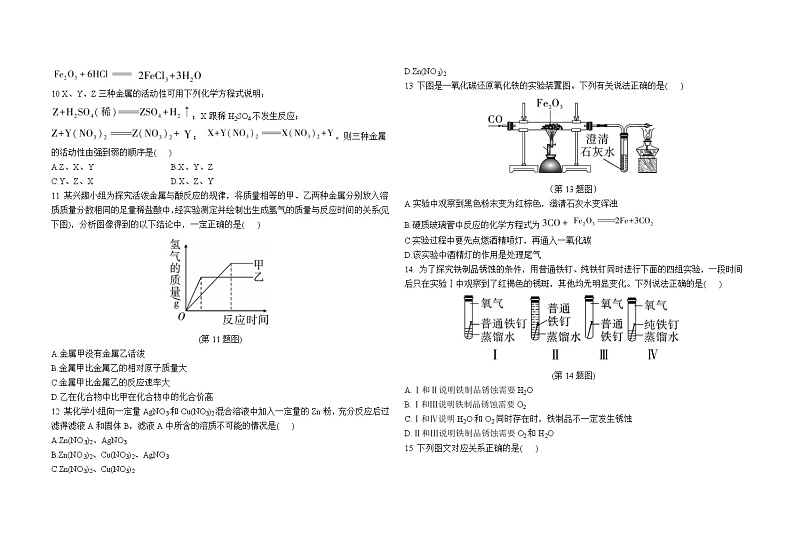
1 下列金属制品中,利用其导热性的是( )
2 下列物质属于合金的是( )
A.铁矿石 B.不锈钢
C.铁锈 D.大理石
3 现有甲、乙、丙三种金属,甲在常温下就能与氧气反应,乙、丙在常温下几乎不与氧气反应;如果将乙、丙分别放入硫酸铜溶液中,过一会儿,在丙的表面有红色固体析出,而乙表面没有变化。则甲、乙、丙三种金属的活动性由弱到强的顺序是( )
A.甲<乙<丙 B.乙<甲<丙
C.乙<丙<甲 D.甲<丙<乙
4 金属有许多共性,但也有一些特性。下列关于金属特性的描述,不正确的是( )
A.铝——由我制成的容器很耐用,因为我的性格很内向(不活泼)
B.汞——我的“眼泪”最易落(熔点最低)
C.钨——酷暑高温能奈我何(熔点最高)
D.银——我是电线上的长跑冠军(导电性最强)
5 向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤。下面对反应结果的判断,错误的是( )
A.若反应后溶液为蓝色,滤渣中一定不含有Zn
B.若反应后溶液为蓝色,滤渣中一定含有Ag,可能含有Cu
C.若反应后溶液为无色,滤渣中一定含有Ag和Cu
D.若反应后溶液为无色,滤渣中一定不含有Zn
6. 下列化学反应属于置换反应的是( )
7. 下列各组物质混合,不能反应的是( )
A.银与稀硫酸 B.铝与盐酸
C.锌和硫酸铜溶液 D.铁和硝酸铜溶液
8 下列实验现象描述正确的是( )
A.铜片投入稀硫酸中产生大量的气泡
B.细铁丝在氧气中燃烧时,火星四射,放出大量的热,生成黑色的固体
C.一氧化碳通入盛放氧化铁的玻璃管中,看到粉末由红棕色变成黑色
D.把铁钉放在硫酸铜溶液中,银白色固体表面有铜析出,溶液由蓝色变为浅绿色
9 某化学兴趣小组为探究镁、铁、锌、铜的金属活动性顺序,设计了如图所示的三个实验(其中金属均已打磨,且形状、大小相同;所用盐酸的溶质质量分数、用量也相同)。下列判断错误的是( )
(第9题图)
A.通过实验①和③的反应剧烈程度,可以判断出镁和锌的金属活动性强弱
B.通过实验②的反应现象,可以判断出铜和铁的金属活动性强弱
C.通过上述三个实验,能判断出四种金属的活动性顺序
D.实验②铁片表面有铁锈,可以先用稀盐酸清洗,反应的化学方程式为
10 X、Y、Z三种金属的活动性可用下列化学方程式说明:;X跟稀H2SO4不发生反应;; 。则三种金属的活动性由强到弱的顺序是( )
A.Z、X、Y B.X、Y、Z
C.Y、Z、X D.X、Z、Y
11 某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入溶质质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见下图),分析图像得到的以下结论中,一定正确的是( )
(第11题图)
A.金属甲没有金属乙活泼
B.金属甲比金属乙的相对原子质量大
C.金属甲比金属乙的反应速率大
D.乙在化合物中比甲在化合物中的化合价高
12 某化学小组向一定量AgNO3和Cu(NO3)2混合溶液中加入一定量的Zn粉,充分反应后过滤得滤液A和固体B,滤液A中所含的溶质不可能的情况是( )
A.Zn(NO3)2、AgNO3
B.Zn(NO3)2、Cu(NO3)2、AgNO3
C.Zn(NO3)2、Cu(NO3)2
D.Zn(NO3)2
13 下图是一氧化碳还原氧化铁的实验装置图。下列有关说法正确的是( )
(第13题图)
A.实验中观察到黑色粉末变为红棕色,澄清石灰水变浑浊
B.硬质玻璃管中反应的化学方程式为
C.实验过程中要先点燃酒精喷灯,再通入一氧化碳
D.该实验中酒精灯的作用是处理尾气
14. 为了探究铁制品锈蚀的条件,用普通铁钉、纯铁钉同时进行下面的四组实验,一段时间后只在实验Ⅰ中观察到了红褐色的锈斑,其他均无明显变化。下列说法正确的是( )
(第14题图)
A.Ⅰ和Ⅱ说明铁制品锈蚀需要H2O
B.Ⅰ和Ⅲ说明铁制品锈蚀需要O2
C.Ⅰ和Ⅳ说明H2O和O2同时存在时,铁制品不一定发生锈蚀
D.Ⅱ和Ⅲ说明铁制品锈蚀需要O2和H2O
15 下列图文对应关系正确的是( )
二、填空题(本题包括4小题,共32分)
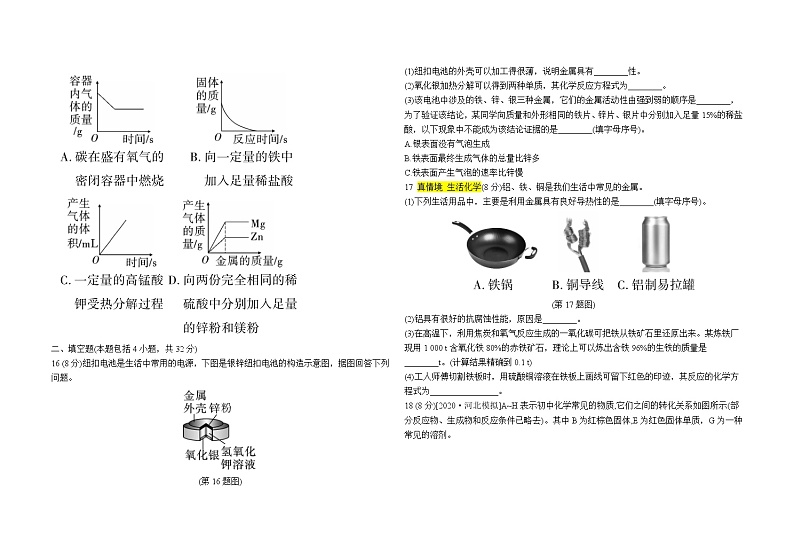
16 (8分)纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,据图回答下列问题。
(第16题图)
(1)纽扣电池的外壳可以加工得很薄,说明金属具有________性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为________。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是________,为了验证该结论,某同学向质量和外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填字母序号)。
A.银表面没有气泡生成
B.铁表面最终生成气体的总量比锌多
C.铁表面产生气泡的速率比锌慢
17 真情境 生活化学(8分)铝、铁、铜是我们生活中常见的金属。
(1)下列生活用品中,主要是利用金属具有良好导热性的是________(填字母序号)。
(第17题图)
(2)铝具有很好的抗腐蚀性能,原因是________。
(3)在高温下,利用焦炭和氧气反应生成的一氧化碳可把铁从铁矿石里还原出来。某炼铁厂现用1 000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是________t。(计算结果精确到0.1 t)
(4)工人师傅切割铁板时,用硫酸铜溶液在铁板上画线可留下红色的印迹,其反应的化学方程式为________________。
18 (8分)[2020·河北模拟]A~H表示初中化学常见的物质,它们之间的转化关系如图所示(部分反应物、生成物和反应条件已略去)。其中B为红棕色固体,E为红色固体单质,G为一种常见的溶剂。
(第18题图)
请回答下列问题:
(1)B的化学式为________。
(2)反应③的基本反应类型为________。
(3)F的一种用途是________。
(4)写出一个符合反应⑥的化学方程式:________。
19 (8分)金属具有广泛的应用。
(1)下图为洁净铁钉的有关实验。
(第19题图)
②中铁钉锈蚀主要是铁与空气中的氧气和发生化学反应;③中铁锈与稀硫酸反应的化学方程式为________。
(2)某炼铁厂要冶炼1 000 t含杂质3%的生铁,需要含Fe2O3 80%的赤铁矿的质量是________(计算结果精确至0.1 t)。
(3)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4 g,向其中加入100 g一定溶质质量分数的稀硫酸,恰好完全反应生成0.2 g氢气,得到无色溶液,固体无剩余。下列说法正确的是________(填字母序号)。
A.样品中一定含有镁
B.样品中一定不含有银,可能含有铁
C.所得溶液中溶质总质量为12 g
D.参加反应的硫酸的质量为10 g
三、实验探究(本题包括2小题,共30分)
20 (16分)金属在生产和生活中应用广泛。请回答下列问题。
(1)生活中常用铁锅做饭,主要利用了铁的________性。
(2)厨房中铁锅容易生锈,结合生活实际,写出一种防止铁锅生锈的具体方法:________。
(3)铝合金制造的飞机外壳,具有轻量化、能抗击强大气流的冲击、耐受水雾和雨雪侵蚀等特点。这是利用了铝合金的________、________(写出两条即可)等优点。
(4)某研究小组为探究铁、铜、锰(Mn)的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用5%的盐酸体积相同)。
【实验记录与分析】
写出实验一试管中铁和盐酸发生反应的化学方程式:________________。
21 (14分)世界上每年因锈蚀而报废的金属设备和材料,高达产量的20%~40%,某实验小组对铁的锈蚀进行了如下探究。
【探究过程】如图所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内的水沿着导管慢慢进入广口瓶(容积为146 mL)。当温度恢复到室温,量筒内水面高度不变时读数(此时广口瓶内氧气含量几乎为零),记录量筒内的起始和最终读数以及所需时间如表:
(第21题图)
(1)金属锈蚀是金属与________发生了反应。
(2)实验①和②说明NaCl可以________(填“加快”或“减慢”)铁锈蚀的速率。
(3)实验开始后,广口瓶内温度有所上升,说明铁锈蚀是________(填“吸热”或“放热”)的过程。
(4)实验①和实验③是探究碳对铁锈蚀速率的影响,则表格空白处实验③的样品组成是________。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算出空气中氧气的体积分数是________(精确到0.1%)%,试分析该实验结果出现误差的原因:________________(写出一条即可)。
四、计算题(本题包括1小题,共8分)
22 (8分)黄铜是铜和锌的合金,某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10 g粉末状黄铜样品放入烧杯中,量取45 mL稀硫酸分三次加到其中,每次充分反应后测定所生成氢气的质量,实验数据如下表:
试求:
(1)m的数值为________。
(2)黄铜样品中铜的质量分数(写出计算过程)。
第5章答案与解析
一、1. C 【解析】 金制成耳环利用了金的金属光泽;铜制成导线利用了铜的导电性;铜制成铜火锅利用了铜的导热性;铁制成勺子利用了铁的硬度大的性质。
2. B 【解析】 铁矿石的主要成分是铁的化合物,不属于合金;不锈钢是铁的合金;铁锈的主要成分是氧化铁,不属于合金;大理石的主要成分是碳酸钙,不属于合金。
3. C 【解析】 甲、乙、丙三种金属,甲在常温下就能与氧气反应,乙、丙在常温下几乎不与氧气反应,说明甲的活动性最强。把乙和丙分别放入硫酸铜溶液中,过一会儿,在丙的表面有红色固体析出,说明丙的金属活动性比铜强;而乙表面没有变化,说明乙的金属活动性比铜弱。故甲、乙、丙三种金属的活动性由弱到强的顺序是乙<丙<甲。
4. A 【解析】 常温下铝能与空气中的氧气反应,在其表面形成一层致密的氧化铝薄膜,从而保护内部的铝不被腐蚀。
5. D 【解析】 向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,锌先与硝酸银反应生成硝酸锌和银,硝酸银反应完全后,锌再与硝酸铜反应生成硝酸锌和铜;若反应后溶液为蓝色,说明硝酸铜有剩余,锌与硝酸铜不能共存,滤渣中一定不含有Zn,选项A不符合题意。 若反应后溶液为蓝色,滤渣中一定含有Ag,若硝酸铜部分参加反应,则滤渣中含有铜,若硝酸铜未参加反应,则滤渣中没有铜,选项B不符合题意。若反应后溶液为无色,说明硝酸铜已全部反应,滤渣中一定含有Ag和Cu,选项C不符合题意。若反应后溶液为无色,说明硝酸铜已全部反应,锌可能有剩余,滤渣中可能含有Zn,选项D符合题意。
6. A 【解析】 置换反应的反应物和生成物都是一种单质和一种化合物,分析选项可知A符合题意。
7. A 【解析】 在金属活动性顺序中,银排在氢之后,不能和稀硫酸反应。
8. B 【解析】 铜不能与稀硫酸反应;铁丝在氧气中能剧烈燃烧,燃烧现象为火星四射,放出大量的热,生成黑色固体;一氧化碳和氧化铁在高温条件下反应生成铁和二氧化碳,常温下不反应;铁与硫酸铜反应生成硫酸亚铁和铜,所以观察到的实验现象是银白色固体表面有红色物质析出,溶液由蓝色变为浅绿色,“表面有铜析出”是实验结论而不是实验现象。
9. C 【解析】 A.金属的活动性越强,与酸反应的速率越快,通过实验①和③的反应剧烈程度,可以判断出铁和镁的金属活动性强弱,正确。B.位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,通过实验②的反应现象,铁片的表面覆盖一层红色物质,说明活动性铁>铜,正确。C.根据实验①和③中均能产生气泡,且①产生气泡的速率快,说明镁的金属活动性比锌强,即镁>锌>氢;根据实验②中铁片的表面覆盖一层红色物质,说明活动性铁>铜,无法确定四种金属的活动性顺序,错误。D.铁片表面有铁锈,可以先用稀盐酸清洗,两者反应生成氯化铁和水,反应的化学方程式为,正确。
10. A 【解析】 由可知,Z能把Y置换出来,说明活动性Z>Y;由可知,X能置换出Y,说明活动性X>Y;由可知,Z能置换出H2,说明活动性Z>H;由X跟稀H2SO4不发生反应可知,X不能置换出H2,说明活动性H>X。综合以上分析可得:活动性Z>X>Y,A正确。
11. A 【解析】 乙反应完全所需要的时间比甲短,说明乙比甲活泼;由于不知道金属在化合物中的化合价,因此不能判断金属相对原子质量的大小;由题图可知,金属甲比金属乙的反应速率小;由于不知道金属的相对原子质量大小,因此无法比较化合价高低。
12. A 【解析】锌的金属活动性比银和铜强,锌能与硝酸铜、硝酸银发生置换反应,当同一种金属同时能置换两种活动性较弱的金属时,首先被置换出来的是金属活动性最弱的金属,即锌先与硝酸银反应生成硝酸锌和银,当银被全部置换出来后,若还有锌存在,锌才能继续与硝酸铜发生置换反应,生成硝酸锌和铜。若溶液中含有硝酸银,说明银还没有被全部置换出来,则硝酸铜还没有参加反应,则此时滤液中的溶质是Zn(NO3)2、Cu(NO3)2、AgNO3,滤液中所含的溶质不可能为Zn(NO3)2、AgNO3,故A情况不可能出现。
13. D 【解析】 实验中观察到红棕色固体逐渐变为黑色,A错误;该反应是在高温条件下发生的,缺少反应条件,B错误;实验时先通入一氧化碳,排净装置内的空气,然后再点燃酒精喷灯,防止加热时发生爆炸,C错误;用酒精灯点燃尾气,可防止一氧化碳污染空气,D正确。
14. C 【解析】 Ⅰ中铁钉生锈,Ⅱ中铁钉没有生锈,说明铁制品锈蚀需要O2,A错误;Ⅰ中铁钉生锈,Ⅲ中铁钉没有生锈,说明铁制品锈蚀需要H2O,B错误;Ⅰ中普通铁钉生锈,Ⅳ中纯铁钉没有生锈,说明H2O和O2同时存在时,铁制品不一定发生锈蚀,C正确;Ⅱ和Ⅲ不能说明铁制品锈蚀需要O2和H2O,两组实验所控制的变量不同,D错误。
15. B 【解析】 碳和氧气反应生成二氧化碳,密闭容器内的氧气转化为二氧化碳,气体的质量不断地增加,至反应完全后气体的质量保持不变,A错误;向一定量的铁中加入足量的稀盐酸,铁和稀盐酸反应生成氯化亚铁和氢气,所以加入足量的稀盐酸,固体的质量会减小,直至为零,B正确;一定量的高锰酸钾受热分解只会产生一定量的气体,等到高锰酸钾完全反应就不再产生气体,C错误;向两份完全相同的稀硫酸中分别加入足量锌粉和镁粉,由于金属足量,产生气体的量和酸的多少有关,因此产生的气体质量相同,D错误。
二、16. (1)延展(2分) (2)(2分) (3)锌、铁、银(2分) B(2分)
17. (1)A(2分) (2)铝和氧气反应在其表面生成一层致密的氧化铝薄膜,从而保护里层的铝不再和氧气反应(2分) (3)583.3(2分) (4)(2分) 【解析】 一氧化碳和氧化铁在高温条件下反应生成铁和二氧化碳,根据化学方程式进行计算,可设理论上可以炼出的含铁96%的生铁的质量是x,则
18. (1)Fe2O3(2分) (2)置换反应(2分) (3)灭火(合理即可)(2分) (4)(合理即可)(2分)
19. (1)水(2分) (2分) (2)1 732.1 t(2分)(3)C(2分) 【解析】 (1)②中铁钉锈蚀主要是铁与空气中的氧气和水发生化学反应;③中氧化铁和硫酸反应生成硫酸铁和水,化学方程式为。
(2)设需要含Fe2O3 80%的赤铁矿的质量是x。
(3)2.4 g样品与稀硫酸反应生成0.2 g氢气,则该金属可能是镁,也可能是锌和铝,还可能是锌、铝、镁,A错误;根据实验现象,反应后得到无色溶液,固体无剩余,则金属粉末中一定不含铁和银,B错误;反应生成0.2 g氢气,说明参加反应的硫酸的质量是9.8 g,所得溶液中溶质总质量为9.8 g+2.4 g-0.2 g=12 g,C正确;参加反应的硫酸的质量是9.8 g,D错误。
三、20. (1)导热(2分) (2)洗净擦干(或其他合理答案)(2分) (3)密度小(2分) 硬度大(或抗腐蚀性强等其他合理答案)(2分) (4)Mn(2分) Fe(2分)
Cu(2分) (2分) 【解析】 (1)铁具有导热性,可用来做铁锅。(2)隔绝氧气和水可以防止铁制品生锈,防止铁锅生锈可以将铁锅洗净擦干或者在其表面涂一层油等。(3)具有“轻量化”的特点说明铝合金的密度小,具有“能抗击强大气流的冲击”的特点说明铝合金的硬度大,具有“耐受水雾和雨雪侵蚀”的特点说明铝合金的抗腐蚀性强。(4)氢前金属的金属活动性越强,与酸反应的速率越快,根据实验一中立即产生气泡、速率较慢;实验二中铜片无明显现象;实验三中立即产生气泡、速率较快等现象可得出三种金属的活动性顺序是锰>铁>铜。铁和盐酸反应生成氯化亚铁与氢气,反应的化学方程式为。
21. (1)氧气和水(2分) (2)加快(2分) (3)放热(2分) (4)1.0 g铁粉和10滴水(2分) (5)19.2(3分) 装置气密性不好(或铁粉的量不足等其他合理答案均可)(3分) 【解析】 (1)金属锈蚀是金属与氧气、水发生了反应。(2)实验②中加入NaCl后相比实验①,完全反应所需的时间缩短,说明NaCl可以加快铁锈蚀的速率。(3)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是放热过程。(4)实验①和③是探究碳对铁锈蚀速率的影响,相比实验①,实验③中的样品组成应该是1.0 g铁粉和10滴水。(5)因为量筒内液体减少的体积即为所消耗广口瓶内氧气的体积,所以空气中氧气的体积分数是28 mL146 mL×100%≈19.2%;若装置的气密性不好或铁粉的量不足均会导致所测定的结果偏小。
四、22. (1)0.04(1分)









