





2022版《导与练》高考化学二轮复习 区间四 物质结构与元素周期律课件PPT
展开NO.1 “品”高考考情——考什么?怎么考?精准备考!
1.(2021·全国甲卷,11)W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )A.原子半径:Z>Y>X>WB.W与X只能形成一种化合物C.Y的氧化物为碱性氧化物,不与强碱反应D.W、X和Z可形成既含有离子键又含有共价键的化合物
2.(2021·全国乙卷,11)我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )A.原子半径大小顺序为W>X>Y>ZB.化合物XW中的化学键为离子键C.Y单质的导电性能弱于Z单质的D.Z的氧化物的水化物的酸性强于碳酸
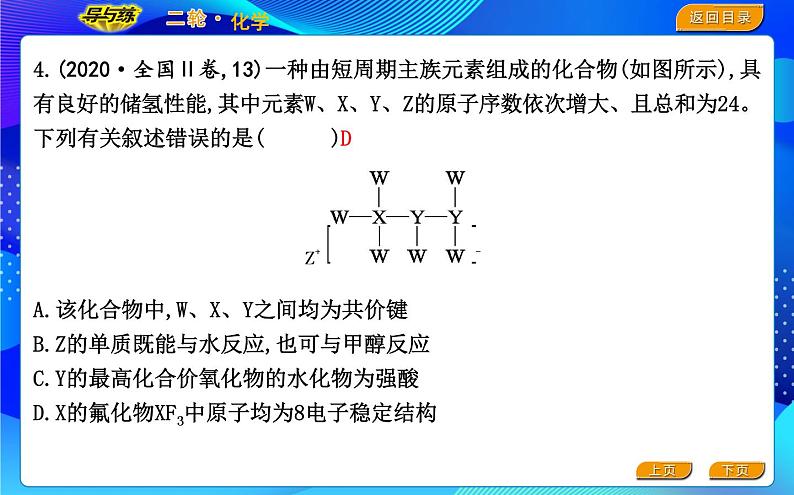
4.(2020·全国Ⅱ卷,13)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是( )A.该化合物中,W、X、Y之间均为共价键B.Z的单质既能与水反应,也可与甲醇反应C.Y的最高化合价氧化物的水化物为强酸D.X的氟化物XF3中原子均为8电子稳定结构
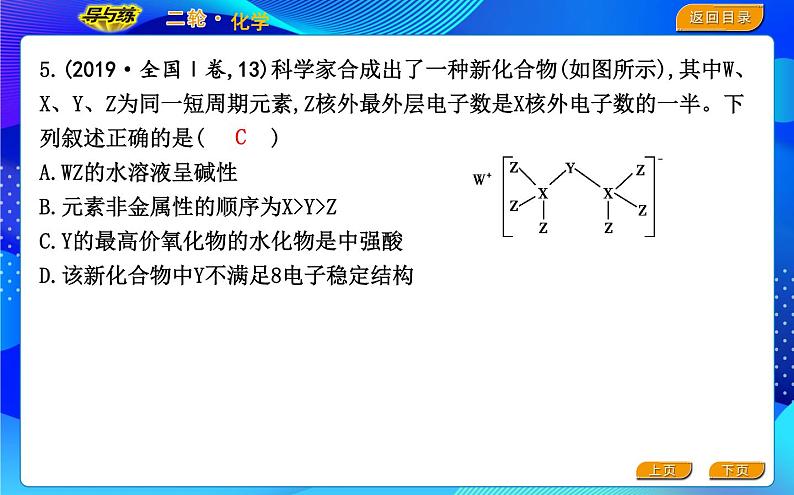
5.(2019·全国Ⅰ卷,13)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )A.WZ的水溶液呈碱性B.元素非金属性的顺序为X>Y>ZC.Y的最高价氧化物的水化物是中强酸D.该新化合物中Y不满足8电子稳定结构
6.(2019·全国Ⅲ卷,9)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )A.熔点:X的氧化物比Y的氧化物高B.热稳定性:X的氢化物大于Z的氢化物C.X与Z可形成离子化合物ZXD.Y的单质与Z的单质均能溶于浓硝酸
7.(2017·全国Ⅱ卷,9)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )A.原子半径:d>c>b>aB.4种元素中b的金属性最强C.c的氧化物的水化物是强碱D.d单质的氧化性比a单质的氧化性强
8.(2021·广东卷,13)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是( )A.XEZ4是一种强酸B.非金属性:W>Z>YC.原子半径:Y>W>ED.ZW2中,Z的化合价为+2价
9.(2021·湖南卷,7)W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为 2∶1 的18e-分子。下列说法正确的是( )A.简单离子半径:Z>X>YB.W与Y能形成含有非极性键的化合物C.X和Y的最简单氢化物的沸点:X>YD.由W、X、Y三种元素所组成化合物的水溶液均显酸性
1.(2019·全国Ⅱ卷,9)2019年是门捷列夫发现元素周期律150周年。如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )A.原子半径:W
结合物质的性质推断元素
2.(2018·全国Ⅰ卷,12)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )A.常温常压下X的单质为气态B.Z的氢化物为离子化合物C.Y和Z形成的化合物的水溶液呈碱性D.W与Y具有相同的最高化合价
3.(2018·全国Ⅱ卷,10)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )A.X与其他三种元素均可形成两种或两种以上的二元化合物B.Y与其他三种元素分别形成的化合物中只含有离子键C.四种元素的简单离子具有相同的电子层结构D.W的氧化物对应的水化物均为强酸
1.(2018·全国Ⅲ卷,13)W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是( )A.原子半径大小为W
2.(2016·全国Ⅰ卷,13)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 ml·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )A.原子半径的大小W
1.此类型题目属于必考题型。通常以原子结构特点、原子在周期表中的位置特点结合元素化合物性质规律为题干,重点考查元素性质周期性变化规律、原子半径比较及元素化合物性质等内容。2.考查形式为选择题,难度一般中等偏大。解题难点是各元素的具体推断过程,对学生逻辑判断等能力要求较高。3.此类题从近些年高考及模考情况来看,有求新求变的趋势:变化主要是对结构式与原子成键规律及原子稳定性知识结合进行考查题型大热。要求学生对物质结构模块有一定知识储备,才能较好地应对此类题型。
4.2021年全国Ⅰ卷、全国Ⅱ卷、全国Ⅲ卷合并为全国甲卷、全国乙卷,关于物质结构与元素周期律这个区间,全国甲、全国乙卷考查形式均为“结合原子结构推断元素”的形式。另外,目前公布的各地方卷也是以此形式考查为主且对结构式均有涉及,仅浙江卷是以“结合元素位置推断元素”这种形式考查。5.预测2022年此区间仍为必考内容。形式上,考虑到过去的考查形式及冷热交替的特点,对命题点2、3这种形式的考题,预计出现概率也会比较高。命题点4这种形式从全国卷看已经逐渐淡出,地方卷也基本无此形式,但在各地模考中偶有出现,对此命题点也应适当训练。
NO.2 “讲”必备知识——考什么,讲什么,实现精讲!
(2)三素(元素、核素、同位素)概念及判断。(3)核外电子排布规律。(4)原子结构示意图识别及含义。
2.位、构、性关系(1)族序数的奇偶性与原子序数奇偶性相同(Ⅷ族第二列除外),另外元素化合价与主族奇偶性基本一致,奇数族通常显奇数价,偶数族通常显示偶数价,比如N是第ⅤA主族,其常见价态为-3、0、+1、+3、+5(但也有-2、+2、+4价态,规律不是非常准确)。(2)主族元素:最高正价=主族序数=最外层电子数(O、F除外);最低负价=主族序数-8=最外层电子数-8。(3)电子层数=周期数。(4)最外层电子数少于4容易失电子,表现正价,表现还原性;最外层电子数多于4容易得电子,表现负价,表现氧化性。
3.微粒(原子或简单离子)半径大小比较(1)电子层数相同:核电荷数越大,半径越小。(2)最外层电子数相同:电子层数越多,半径越大。(3)电子层数相同,核电荷数也相同:最外层电子数越多,半径越大,最外层电子数越少,半径越小。
元素周期表与元素周期律
1.1~20号元素原子结构以及在周期表中的位置
2.周期表结构(1)七个周期分为两种:三短、四长。(2)16个族分四种:七主(ⅠA~ⅦA)、七副(ⅠB~ⅦB)、一八(Ⅷ)、一零(0族)。(3)金属与非金属交界的阶梯线。(4)过渡元素全部为金属,位置在ⅡA与ⅢA族之间。(5)元素种类最多的周期为第六、七周期,元素种类最多的族为第ⅢB族,了解周期表里的特殊元素,比如液态金属(汞)、液态非金属(溴单质)等。(6)周期表一、二周期同主族相差2个电子,二、三周期同族相差8个电子,三、四周期相差8个电子(ⅠA、ⅡA族),三、四周期相差18个电子(ⅢA至ⅦA族及0族)。
3.元素周期律(1)原子半径:同周期(左至右)大→小,同主族(上至下)小→大。(2)元素非金属性(或氧化性或得电子能力):同周期(左至右)弱→强,同主族(上至下)强→弱。(3)元素金属性(或还原性或失电子能力):同周期(左至右)强→弱,同主族(上至下)弱→强。(4)金属性实验判据①金属单质跟水或酸反应置换出氢气的难易程度:越容易则金属性越强,反之,金属性越弱;②最高价氧化物对应水化物的碱性强弱:最高价氧化物对应的水化物(氢氧化物)的碱性越强,这种金属元素金属性越强,反之,金属性越弱;③金属单质间的置换反应。
(5)非金属性实验判据①非金属元素单质与氢气化合的难易程度及生成氢化物的稳定性强弱:如果元素的单质跟氢气化合生成气态氢化物容易且稳定,则证明这种元素的非金属性较强,反之,则非金属性较弱;②最高价氧化物对应水化物的酸性强弱:酸性越强则对应元素非金属性越强;③非金属单质间的置换反应。
1.物质熔点、沸点比较规律(1)一般来讲,熔点、沸点:原子晶体>离子晶体>分子晶体,金属晶体熔点、沸点变化比较大,有些金属非常高,比如钨、铂、铁,有些很低,比如Na、Hg等。(2)原子晶体之间熔点、沸点比较:主要比较其共价键长度,一般的共价键越短,键能越大,熔点、沸点越高。(3)离子晶体之间熔点、沸点比较:主要由离子半径与离子所带电荷数目决定,离子半径越小,熔点、沸点越高,离子所带电荷越多,熔点、沸点越高。(4)分子晶体之间熔点、沸点比较:分子结构相似,则相对分子质量越大,熔点、沸点越高;含有氢键的分子晶体熔点、沸点反常的高;烃类有机物的同分异构体支链越多,熔点、沸点一般越低。
(5)金属晶体之间熔点、沸点比较:金属晶体熔点、沸点主要由金属离子半径以及金属离子所带电荷决定,半径越小,熔点、沸点一般越高,电荷越多,熔点、沸点越高。2.常见单质及无机物性质(物理、化学性质)及转化(参考区间三中的内容)。
NO.3 “练”关键能力——考什么,练什么,实现精练!
1.(2021·四川成都模拟)化合物A的结构如图所示。X、Y、Z、W是原子序数递增的短周期主族元素,Y在自然界中以化合态形式存在,Z的最外层电子数是周期序数的3倍。下列说法正确的是( )A.化合物A中各原子或离子均达到2或8电子稳定结构B.X、Y、Z三种元素的电负性顺序为Z>Y>XC.X、Y、Z、W四种元素形成的单质中,W的单质熔点最高D.WYX4能与H2O发生氧化还原反应生成H2
解析 化合物A的结构如题图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,Z原子最外层电子数是其周期序数的3倍,则Z为O;Y元素在自然界都以化合态存在,且Y的原子序数小于Z,化合物A中Y可以形成3个或4个共价键,则Y为B;X形成1个共价键,W形成+1价阳离子,则X为H,W为Na。根据分析可知,X为H,Y为B,Z为O,W为Na元素。化合物A中有2个B原子,只形成了3个共价键,没有达到8电子稳定结构,A错误;同一周期元素,从左到右,电负性依次增大,同一主族元素,从上到下,电负性依次减小,故H、B、O三种元素电负性由大到小为O>H>B,即Z>X>Y,B错误;元素H、B、O、Na的单质依次为分子晶体、原子晶体、分子晶体、金属晶体,其熔点最高的是原子晶体B的单质,C错误;WYX4为NaBH4,NaBH4中H元素化合价为-1,具有较强还原性,能与H2O发生氧化还原反应生成H2,D正确。
2.(2021·吉林长春模拟)短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有一种金属元素;W、X、Y三种原子的最外层电子数之比为2∶3∶1,Z的最高价氧化物对应水化物的化学式为HnZO2n-2。下列说法正确的是( )A.W、X两种元素至少可以形成两种分子B.Y的简单离子半径是同周期简单离子中最小的C.X、Z两种元素形成的一种化合物可用于干燥氨气D.W、X、Z的简单氢化物通常均为气体
解析 由短周期主族元素W、X、Y、Z的原子序数依次增大,Z的最高价氧化物对应水化物的化学式为HnZO2n-2可知,Z为P元素;由W、X、Y、Z中只有一种金属元素,W、X、Y三种原子的最外层电子数之比为2∶3∶1可知,W为C元素、X为O元素、Y为Mg元素。W为C元素、X为O元素,两元素可以形成CO、CO2等化合物,A正确;Y为Mg元素,属于第三周期元素,同周期元素,电子层结构相同的阳离子半径从左到右依次减小,且阴离子半径大于阳离子半径,所以第三周期中铝离子半径是同周期简单离子半径中最小的,B错误;X为O元素,Z为P元素,氧元素和磷元素形成的酸性氧化物为五氧化二磷,是常见的酸性干燥剂,能与氨气反应,故不能用于干燥氨气,C错误;W为C元素、X为O元素、Z为P元素,其简单氢化物分别为CH4、H2O、PH3,通常情况,H2O为液体,D错误。
3.(2021·江西抚州模拟)科学家利用原子“组合”成一种具有高效催化性能的超分子,其分子结构如图所示(短线代表共价键),其中W、X、Y、Z四种短周期元素的原子序数依次递增,W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。设NA为阿伏加德罗常数的值,下列说法不正确的是( )A.简单离子半径:Y>Z>WB.Y与W、X、Z均能形成至少两种化合物C.1 ml ZW与水发生反应生成1 ml W2,转移电子数为2NAD.最简单氢化物的沸点:Y>X
1.(2021·浙江杭州三模)如图,X、Y、Z、W四种短周期元素的原子最外层电子数之和为21。下列说法正确的是( )A.原子半径(r):r(Z)>r(Y)>r(X)B.X的氢化物一定比Y的氢化物的沸点要低C.WY2、WZ4、WX均有熔点高、硬度大的特性D.某病毒DNA链中有T元素,可能是T取代了普通DNA链中的P元素
解析 设X的最外层电子数为a,则Y、W、Z的最外层电子数分别为(a+2)、a、(a+3),从而得出a+(a+2)+a+(a+3)=21,a=4,故X、Y、W、Z分别为C、O、Si、Cl,则T为As。C、O为同周期元素,C在O的左边,则原子半径 r(C)>r(O),A不正确;X、Y分别为C、O,若X的氢化物中碳原子数比较多(如石蜡),常温下呈固态,则其沸点可能比Y的氢化物(H2O)的沸点要高,B不正确;SiCl4在固态时形成分子晶体,其熔点较低,硬度较小,C不正确;某病毒DNA链中有As元素,As与P属于同主族元素,可能是As取代了普通DNA链中的P元素生成的,D正确。
2.(2021·陕西西安二模)现有短周期主族元素X、Y、Z、W,其中X、Y、Z在元素周期表中的相对位置关系如图,且X、Y、Z的原子序数之和为32,W原子的最外层电子数是其次外层电子数的2倍。下列说法错误的是( )A.化合物WY2中所有原子的最外层均达到8电子稳定结构B.原子半径:Y>ZC.X、Z、W简单氢化物的沸点:Z>X>WD.X的氧化物对应水化物为强酸
解析 现有短周期主族元素X、Y、Z、W,W原子的最外层电子数是其次外层电子数的2倍,则W为C;其中X、Y、Z在元素周期表中的相对位置关系如题图,设X的原子序数为a,X、Y、Z的原子序数之和为32,则a+(a+2)+(a+9)=32,得a=7,则X为N,Z为F,Y为S。化合物WY2即CS2中所有原子的最外层均达到8电子稳定结构,A正确;同周期主族元素,从左到右原子半径逐渐减小,元素位于同主族时,核电荷数越大,电子层数越多,原子半径越大,则原子半径Y>Z,B正确;X、Z、W简单氢化物分别为氨气、氟化氢和甲烷,氨气和氟化氢分子间存在氢键,氟化氢标准状况下为液体,则沸点Z>X>W,C正确;X的最高价氧化物对应水化物即硝酸为强酸,当化合价不为最高价时,例如亚硝酸是弱酸,D错误。
1.X、Y、Z、W是原子序数依次增大的主族元素,X、Y、Z、W的单质在常温下均为气态,Z与Y形成的一种化合物在常温下为红棕色气体,X、Y、W位于三个不同的周期。下列说法正确的是( )A.非金属性:Z>Y>X>WB.含氧酸的酸性:Y
2.(2021·山东泰安模拟)短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素常用来鉴定一些文物的年代;B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其K层电子数;若往E单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。下列说法正确的是( )A.A的氢化物常温下一定为气态B.简单离子半径大小顺序为E>B>C>DC.C的氧化物比D的氧化物熔点高D.E的氧化物均可作为消毒剂,其对应水化物均为强酸
解析 根据A的一种核素的用途,确定A为C元素,B的氢化物的水溶液呈碱性,则B为N元素,D是短周期金属元素,原子的最外层电子数等于其K层电子数,且原子序数大于7的只有Mg元素,即D为Mg元素,则C为Na元素,氯气的水溶液既显酸性又具有漂白性,可使紫色石蕊试液先变红后褪色,所以E为Cl元素。C的氢化物即为烃类,随着C原子数的增多,常温下的状态有气体、液体或固体,所以不一定都是气体,A错误;E、B、C、D对应的简单离子分别为Cl-、N3-、Na+、Mg2+,离子半径大小顺序为Cl->N3->Na+>Mg2+,B正确;C、D的氧化物分别为氧化钠和氧化镁,氧化钠和氧化镁均为离子晶体,镁离子比钠离子电荷数大,半径小,因而氧化镁晶格能大,熔点高,C错误;氯的氧化物都具有氧化性,可作消毒剂;在氯的含氧酸中,HClO、HClO2为弱酸,D错误。
3.(2021·湖北武汉二模)主族元素Q、W、X、Y、Z的原子序数均不大于20。化合物ZW2与水剧烈反应,生成一种强碱和一种可燃性气体单质,Q与X同族,且X的最外层电子数是内层电子数的3倍,常温下,Y的单质能溶于Q的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是( )A.简单离子半径:Z>Q>X>YB.工业上用电解相应氯化物冶炼Y单质C.Q与X形成的化合物中,每个原子最外层均满足8电子结构D.化合物ZW2中只含有离子键
解析 主族元素Q、W、X、Y、Z的原子序数均不大于20,化合物ZW2与水剧烈反应,生成一种强碱和一种可燃性气体单质,则ZW2是CaH2,所以Z是Ca元素、W是H元素;X的最外层电子数是内层电子数的3倍,则X是O元素,Q与X同族,则Q为S元素,Y的单质能溶于Q的最高价氧化物对应的水化物的稀溶液,即能溶于稀H2SO4,却不溶于其浓溶液,即不能溶于浓H2SO4,则Y为Al元素。Q为S元素、X为O元素、Y为Al元素、Z为Ca元素,简单离子半径Q>Z>X>Y,A错误;Y为Al元素、而Al为活泼金属,工业上电解熔融的Al2O3冶炼Al单质,而氯化铝为共价化合物不导电,B错误;Q与X形成的化合物有SO2与SO3,S原子最外层电子数均不满足8电子结构,C错误;化合物ZW2是CaH2,属于离子化合物,且只含有离子键,D正确。
1.(2021·山西太原模拟)A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法正确的是( )A.对应的简单离子半径:C>D>BB.D、E形成的化合物中含有极性共价键C.电解C、E形成的化合物的水溶液,可生成C、E对应的单质D.由A、B、E形成的化合物中都含有共价键,且都为强酸
解析 A、B、C、D、E这五种元素分布在三个不同的短周期,且原子半径依次增大,则A为H;转化图中,最终可以得到两性化合物,中学阶段所学习的两性化合物主要有Al2O3、Al(OH)3,则这些元素中,一定有O和Al;D的单质能和X(二元化合物且为强电解质)溶液、Y溶液分别生成Z、W(溶液呈碱性),Z、W再反应生成两性化合物,则D为Al,X为HCl,Y为NaOH,Z为AlCl3,W为NaAlO2,两性化合物为Al(OH)3。综上所述,A为H,B为O,C为Na,D为Al,E为Cl,X为HCl,Y为NaOH,Z为AlCl3,W为NaAlO2,两性化合物为Al(OH)3。B为O,C为Na,D为Al,则对应的简单离子半径为B>C>D,A错误;D为Al,E为Cl,它们形成的化合物AlCl3是含极性键的共价化合物,B正确;C为Na,E为Cl,它们形成的化合物NaCl的水溶液,经电解可以生成NaOH、H2、Cl2,C错误;A为H,B为O,E为Cl,它们形成的化合物都是Cl的含氧酸,其中HClO是弱酸,D错误。
2.(2021·福建漳州三模)短周期元素W、X、Y、Z的原子序数依次增加。m、a、b、c是由这些元素组成的物质,其中m是日常生活中常用的调味品,b为黄绿色气体单质,上述物质的转化关系如图。下列说法正确的是( )A.非金属性:Z>X>WB.原子半径:W
[思维建模] 此类题解题模式是①通读题目找出“题眼(也就是关键元素或物质)”,然后推断与“题眼”相关联的元素,这样逐一推断出各种元素;②逐一分析各选项内容,根据内容相关联的知识点进行分析作答。
[十年高考题眼总结归纳]1.最外层只有2个电子[He、Be、Mg]。2.最外层有6个电子[O、S]。3.最外层电子数为内层电子数的2倍[C]。4.最外层电子数是其内层电子总数的3倍[O]。5.最高化合价为最低化合价绝对值的3倍[S]。6.周期数是族序数的3倍[Na]。7.周期表中周期序数等于族序数[H、Be、Al]。8.质子数是其最外层电子数的3倍[Li、P]。9.至今发现的非金属性最强的元素且无正价[F]。10.原子最外层电子数是其电子层数的2倍[He、C、S]。
11.原子中只有1个电子[H]。12.原子内层电子数是最外层电子数的一半[C]。13.原子核外有两个未成对电子[C、O、Si、S]。14.原子半径在所有短周期主族元素中最大[Na]。15.元素的合金是日常生活中常用的金属材料[Al]。16.元素单质是自然界硬度最大的物质[C]。17.元素单质晶体熔点高、硬度大,是一种重要的半导体材料[Si]。18.元素单质广泛用作半导体材料[Si]。19.乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应[Na、Al、Cl或S]。20.盐YZW与浓盐酸反应,有黄绿色气体产生[NaClO]。21.所含元素的物质焰色反应为黄色[Na盐或NaOH]。
22.三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生[Na2S2O3]。23.气态氢化物与其最高价氧化物对应的水化物能反应[N或S]。24.气态氢化物可与其最高价含氧酸反应生成离子化合物[N]。25.某元素负一价阴离子的核外有10个电子[F]。26.某元素单质通常为黄绿色气体[Cl]。27.某化合物0.01 ml·L-1溶液的pH为2[HCl、HNO3]。28.两种元素可生成一种红棕色有刺激性气味的气体[NO2]。29.两元素化合物可与浓硫酸反应,其生成物可腐蚀玻璃[CaF2]。30.金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应[Na]。31.简单氢化物可用作制冷剂[N]。32.工业上通过分离液态空气获得某元素单质[N、O]。
33.短周期中金属性最强的元素[Na]。34.地壳中含量最多的元素[O]。35.单质在暗处与H2剧烈化合并发生爆炸[F]。36.M电子层有1个电子[Na]。37.M层有1个未成对的p电子[Al、Cl]。38.+2价阳离子的核外电子排布与氖原子相同[Mg]。
2022版《导与练》高考化学二轮复习 区间一 化学与STSE 化学与传统文化课件PPT: 这是一份2022版《导与练》高考化学二轮复习 区间一 化学与STSE 化学与传统文化课件PPT,共52页。PPT课件主要包含了考情纵览按图索题,命题点1,社会环境,命题点2,化学与生产生活,命题点3,化学与传统文化,考情分析与预测,知能点1,传统文化与化学史等内容,欢迎下载使用。
2022版《导与练》高考化学二轮复习 区间五 电化学课件PPT: 这是一份2022版《导与练》高考化学二轮复习 区间五 电化学课件PPT,共58页。PPT课件主要包含了命题点1,新型化学电源,命题点2,命题点3,命题点4,命题点5,金属的腐蚀与防护,命题点6,考情分析与预测,知能点1等内容,欢迎下载使用。
2022版《导与练》高考化学二轮复习 区间三 物质的性质与变化课件PPT: 这是一份2022版《导与练》高考化学二轮复习 区间三 物质的性质与变化课件PPT,共60页。PPT课件主要包含了命题点1,命题点2,命题点3,命题点4,无机化工流程微型化,命题点5,物质转化微观过程探析,考情分析与预测,知能点1,知能点2等内容,欢迎下载使用。












