




2022版《导与练》高考化学二轮复习 区间五 电化学课件PPT
展开
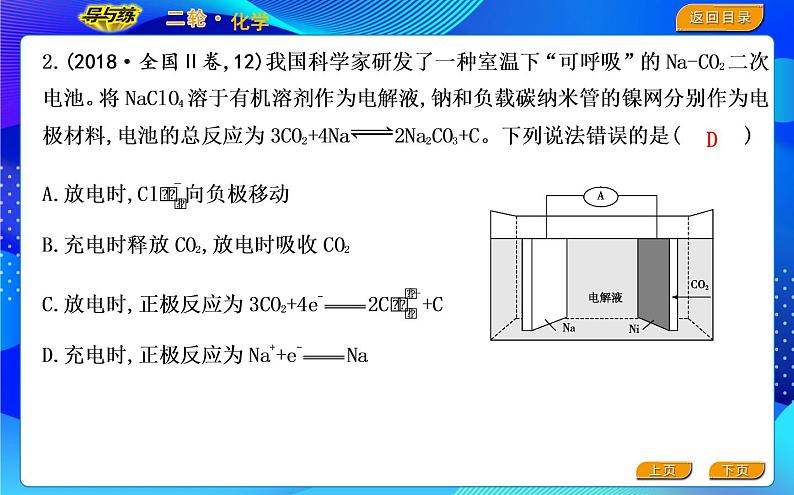
这是一份2022版《导与练》高考化学二轮复习 区间五 电化学课件PPT,共58页。PPT课件主要包含了命题点1,新型化学电源,命题点2,命题点3,命题点4,命题点5,金属的腐蚀与防护,命题点6,考情分析与预测,知能点1等内容,欢迎下载使用。
NO.1 “品”高考考情——考什么?怎么考?精准备考!
1.(2020·全国Ⅰ卷,12)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法错误的是( )
2.(2018·全国Ⅲ卷,11)一种可充电锂—空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )A.放电时,多孔碳材料电极为负极B.放电时,外电路电子由多孔碳材料电极流向锂电极C.充电时,电解质溶液中Li+向多孔碳材料区迁移
3.(2021·广东卷,9)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )A.负极上发生还原反应B.CO2在正极上得电子C.阳离子由正极移向负极D.将电能转化为化学能
可逆电池充放电过程分析
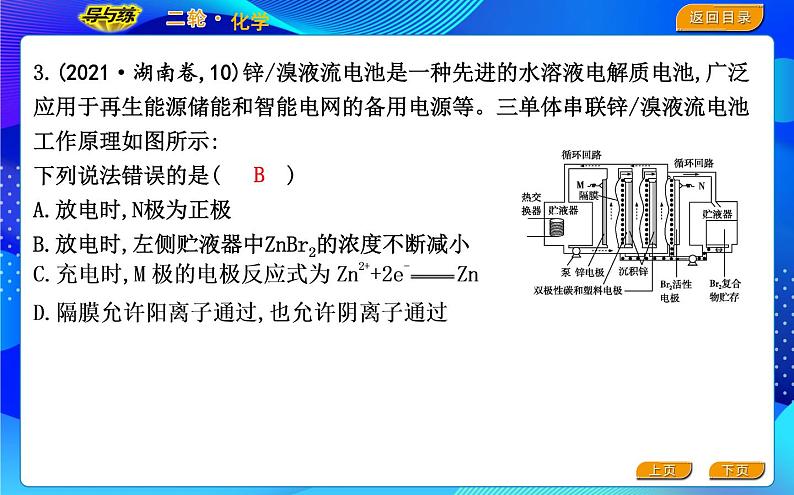
3.(2021·湖南卷,10)锌/溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌/溴液流电池工作原理如图所示:下列说法错误的是( )A.放电时,N极为正极B.放电时,左侧贮液器中ZnBr2的浓度不断减小
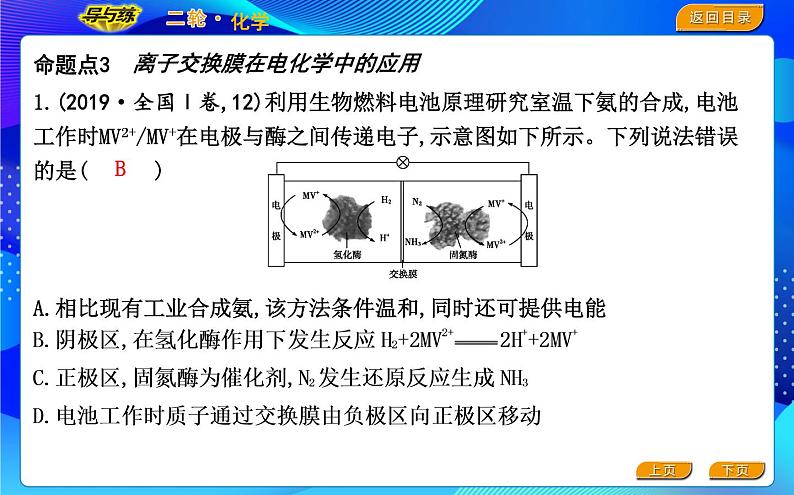
1.(2019·全国Ⅰ卷,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
离子交换膜在电化学中的应用
1.(2021·全国乙卷,12)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列叙述错误的是( )A.阳极发生将海水中的Cl-氧化生成Cl2的反应B.管道中可以生成氧化灭杀附着生物的NaClOC.阴极生成的H2应及时通风稀释安全地排入大气D.阳极表面形成的Mg(OH)2等积垢需要定期清理
电解原理在环保、新材料制备中的应用
2.(2021·全国甲卷,13)乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用
3.(2020·全国Ⅱ卷,12)电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是( )A.Ag为阳极B.Ag+由银电极向变色层迁移C.W元素的化合价升高
1.(2017·全国Ⅰ卷,11)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )A.通入保护电流使钢管桩表面腐蚀电流接近于零B.通电后外电路电子被强制从高硅铸铁流向钢管桩C.高硅铸铁的作用是作为损耗阳极材料和传递电流D.通入的保护电流应该根据环境条件变化进行调整
2.(2019·江苏卷,10)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )A.铁被氧化的电极反应式为Fe-3e- Fe3+B.铁腐蚀过程中化学能全部转化为电能C.活性炭的存在会加速铁的腐蚀D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
电化学相关计算及电极反应式的书写
3.(2021·河北卷,9)K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是( )A.隔膜允许K+通过,不允许O2通过B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
1.电化学是一个经久不衰的考题类型,无论是全国卷还是地方卷均不会爽约。2.此类题型重点考查原电池,偶尔考查电解和金属腐蚀与防护。此类题难点是原理陌生、装置陌生,给考生带来非常大的挑战。3.此类题目往往属于难度中档偏高类型的题目,解决好此题关系重大。4.从2021年考题情况看,此区间有一些新的变化。全国甲、乙两卷均考查了电解原理,这是一个比较大的变化。那么是否说明电化学有转向的趋势呢?笔者认为有很大的可能,其主要原因是过去电化学以原电池为重点考查方向,导致各地模考也在这个方向猛挖深挖,各色电池轮番上场,甚至一些超出学生经验范围的浓差电池或非氧化还原电池也频频出现,导致原电池命题难度提升,要想出一个比较陌生的原电池的题非常难,基于上述分析,电解原理的命题频率会提高,所以可以强化电解原理的学习。
NO.2 “讲”必备知识——考什么,讲什么,实现精讲!
2.解决原电池问题基本流程(1)分析电池内存在的氧化还原反应,若存在多个氧化还原反应还要分析先后顺序。(2)画出双线桥,分析“半反应”;根据电极材料,电子、电流流动方向,离子移动方向或者题目所给图示分析出正负极。(3)综合考虑电极材料、电解质特点以及题目所给的电池构造图写出正负极电极反应式。(4)对陌生装置尤其注意两点:一是装置图中相关物质化合价变化(从中可以分析氧化还原的情况),二是箭头表示的意义(表示微粒移动或表示微粒的转化)。
3.原电池基本解题规律(1)大部分电池一般先写负极反应式,燃料电池一般先写正极反应式;然后用总反应(离子方程式)减去负极(燃料电池为正极)反应式即得正极(燃料电池为负极)反应式。
(3)可充电二次电池:先写放电(原电池)电极反应式,把放电电极反应式“颠倒过来”即充电(电解)电极反应式。(4)注意近些年一些非常规原电池问题时而有所考查,这些电池有浓差电池、温差电池、非氧化还原型原电池等,这些电池不符合原电池基本理论(高中所学原电池理论是基于自发的氧化还原反应理论)。遇到此类问题要根据题意进行分析,而不能硬套我们所学的原电池理论。
2.离子放电顺序(惰性电极)阳极:S2->I->Br->Cl->OH-(活泼电极作阳极时,放电的是阳极材料本身,注意Fe作阳极一般仅能失去2e-);阴极:Ag+>Fe3+>Cu2+>H+(酸)>Sn2+>Zn2+>Fe2+>H+(H2O)>Al3+。
3.电解原理应用、常见四种类型电解及电解质溶液复原。4.电解原理解题基本流程(1)先看阳极是否为“惰性电极”,若为活泼电极,则放电的就是阳极本身,直接写出阳极反应式;若为惰性电极,则根据阴离子放电顺序写出阳极反应式。(2)根据阳离子放电顺序写出阴极反应式。(3)根据阴、阳极反应式结合离子方程式书写规律,写出总反应方程式。(4)根据电解总方程式以及阴、阳极反应式进行相关计算或判断。
电极反应式的书写规律类似于氧化还原反应离子方程式的书写规律:主要的思路是先分析化合价,搞清氧化剂→还原产物及还原剂→氧化产物,然后根据化合价及物质电离情况初步写出电极反应式,最后根据电荷守恒,结合内电路离子种类、交换膜情况及原子守恒补充相关离子,使电极反应式符合电荷守恒和原子守恒。例如:(2019·天津卷,6)我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
[分析技巧]1.有些元素化合价分析不出来,可以考虑整体化合价。例如:(2019年·全国Ⅰ卷,12)
2.某物质是否可拆(是否完全电离)要综合考虑电解质有没有水、是否为熔融电解质、电解质强弱、装置图隐含的信息等。无水、没有熔融条件(电离条件不具备)一般不能拆;弱电解质或非电解质及单质、气体等一般不能拆。
1.金属腐蚀与防护(1)金属腐蚀本质:金属没有负价,所以金属腐蚀本质就是金属失电子被氧化的过程:M-xe- Mx+。(2)金属腐蚀类型:①化学腐蚀;②电化学腐蚀(又分为原电池腐蚀、电解原理腐蚀)。(3)金属防腐原理①涂覆保护层:原理是隔离氧化剂与还原剂(金属)。②电化学保护:根据原电池、电解池原理知,原电池负极发生氧化反应、电解池阳极发生氧化反应,据此我们知道金属原电池腐蚀是因为被腐蚀金属作了负极,电解腐蚀是因为被腐蚀金属作了阳极。电化学保护原理也就是让金属作原电池正极或作电解池阴极即可,其中利用原电池原理防护方法称牺牲阳极的阴极保护法,利用电解池原理防护方法称外加电流的阴极保护法。③加入Ni、Cr把铁
制成不锈钢改变金属内部结构。
2.原电池、电解池串联装置串联电路中阴阳极或正负极总是交替出现,只要分析出某个电极,则与之相邻的电极名称相反(比如某电极是阳极,则与之相邻的电极为阴极)。3.电化学综合计算(1)注意串联的原电池或电解池各个电极放电量相等的基本等量关系。
(3)电化学计算一般比较复杂,耗时较多,所以遇到此类问题时可把选项暂时放一放,或利用排除法进行筛选。
4.电化学装置中离子的移动与电势高低(1)电化学装置中离子移动方向可以总结为八个字“正正负负(原电池中阳离子移向正极,阴离子移向负极),正阴负阳(电解池中阳离子移向阴极,阴离子移向阳极)”。(2)电势问题:原电池中正极电势高于负极,电解池中阳极电势高于阴极。5.各种膜的用途(1)原电池中一般是“单膜(正负极之间)”。原电池中膜的主要作用有两点:一是隔离正负极某些微粒,防止其发生反应造成内放电;二是防止某些微粒在电极表面沉淀析出导致电极活性降低。(2)电解池中很多时候是“双膜或多膜”。多膜会把整个电解池分割成若干不同的“室”,比如有“阳极室”“阴极室”“产品室”等等。电解池中膜的主要作用是控制离子的移动以期获得所需的产品或达到除杂、提纯等目的。
NO.3 “练”关键能力——考什么,练什么,实现精练!
1.(2021·江西抚州模拟)浓度差电池是指电池内物质变化仅是由一物质由高浓度变成低浓度且过程伴随着吉布斯自由能转变成电能的一类电池。如图所示的浓度差电池示意图,下列有关说法正确的是( )A.a极为原电池的负极B.c为Cu2+交换膜C.电流计为0时,两极的CuSO4浓度相等D.转移1 ml 电子时,右池增重48 g
2.(2021·广东佛山模拟)研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的离子交换膜隔开,下列说法错误的是( )
2.(2021·天津高三三模)我国化学工作者提出一种利用有机电极(PTO/HQ)和无机电极(MnO2/石墨毡),在酸性环境中可充电的电池其放电时的工作原理如图所示:下列说法错误的是( )A.放电时,MnO2/石墨毡为正极,发生还原反应B.充电时,有机电极和外接电源的负极相连
1.(2021·黑龙江哈尔滨模拟)某化物所的研究团队创新性地提出锌碘单液流电池的概念,实现锌碘单液流中电解液的利用率近100%,其原理如图所示。下列说法正确的是( )A.放电时A电极反应式为Zn2++2e- ZnB.放电时电解质储罐中离子总浓度减小C.M为阴离子交换膜,N为阳离子交换膜D.充电时A极增重65 g,C区增加离子数为2NA
2.(2021·辽宁沈阳模拟)某实验室设计了如图装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成H+和OH-并分别通过阴、阳膜定向移动。下列说法错误的是( )A.Pt为负极B.石墨电极反应式为ClO-+2e-+2H+ Cl-+H2OC.双极膜中产生的OH-移向Pt电极D.每消耗11.2 L NH3时双极膜中消耗1 ml H2O
解析 Pt电极一侧通入NH3生成N2H4,发生了失电子的氧化反应,为负极,A正确;双极膜中的H+移向正极,ClO-得电子发生还原反应,B正确;阴离子移向负极,C正确;没有说明气体的存在状况,无法计算物质的量,D错误。
解析 根据装置知道,左侧电极为二氧化硫转化为硫酸根离子的过程,S元素化合价升高,失电子,作阳极,则直流电源的左侧是正极;右侧电极是阴极,为氧气得电子转化为过氧化氢的过程。右侧电极是阴极,阴极反应为 2H++O2+2e- H2O2,A正确;根据装置知道,氢氧根离子通过靠近阳极的交换膜进入阳极参加反应,为阴离子交换膜,氢离子通过靠近阴极的交换膜进入阴极参加反应,为阳离子交换膜,B错误;根据装置知道,左侧电极为二氧化硫转化为硫酸根离子的过程,氢氧根离子被消耗,碱性减弱,pH降低,C正确;二氧化硫转化为硫酸根离子,每生成1 ml 硫酸根离子,伴随2 ml 电子转移,根据电子守恒,得到的过氧化氢是1 ml,D正确。
2.(2021·辽宁阜新模拟)科学家利用电化学装置实现了CH4和CO2的耦合转化,原理如图。下列说法错误的是( )A.电极A的电极反应式为CO2+2e- CO+O2-B.该装置工作时,固体电解质中O2-向电极A移动C.若一定条件下生成的乙烯和乙烷的体积比为3∶1,则消耗的CH4和CO2的体积比为8∶7D.电催化CO2被还原为CO,可以改善温室效应,提供工业原料
1.(2021·河北张家口三模)在缺乏氧气的深层潮湿土壤中存在的硫酸盐还原菌,会附着在钢管表面促进钢铁的腐蚀,这个过程被称为厌氧腐蚀,其反应原理如图所示,下列说法正确的是( )A.厌氧腐蚀属于化学腐蚀
2.(2021·上海浦东新区二模)选取pH=2.5和pH=5.0的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( )A.pH=5.0的醋酸溶液中一定存在吸氧腐蚀B.酸度不同,腐蚀的主要类型可能不同C.两组溶液的pH一定逐渐变大D.若改用盐酸进行实验,腐蚀速率一定变大
1.(2021·广东广州三模)中科院研制出了双碳双离子电池,以石墨(Cn)和中间相炭微粒球(MCMB)为电极,电解质溶液为含有KPF6的有机溶液,其充电示意图如下。下列说法错误的是( )A.固态KPF6为离子晶体B.放电时,MCMB电极为负极C.充电时,若阳极增重39 g,则阴极增重145 g
[思维建模] 电化学类题解题模式是①读图:注意化合价变化与箭头意义(箭头一般表示物质的转化或微粒的移动方向),根据两个极区物质化合价变化,分析出正、负极或阴、阳极(失电子的为负极或阳极、得电子的为正极或阴极);②写式:写出正、负极或阴、阳极电极反应式(符合电子得失守恒、电荷守恒、原子守恒,还要注意物质是否可拆),可充电电池放电时的正、负极颠倒过来分别是充电时的阳、阴极;③判断:根据电极反应式或总反应方程式进行计算或判断各选项正误,作答即可。
特别提示:电解池类型题目要首先根据题目所给信息判断阴、阳极电极反应,只有当根据题意无法确定电极反应时才可以根据“离子放电顺序”进行判断。
相关课件
这是一份2022版《导与练》高考化学二轮复习 区间一 化学与STSE 化学与传统文化课件PPT,共52页。PPT课件主要包含了考情纵览按图索题,命题点1,社会环境,命题点2,化学与生产生活,命题点3,化学与传统文化,考情分析与预测,知能点1,传统文化与化学史等内容,欢迎下载使用。
这是一份2022版《导与练》高考化学二轮复习 区间四 物质结构与元素周期律课件PPT,共55页。PPT课件主要包含了命题点1,结合原子结构推断元素,命题点2,结合元素位置推断元素,命题点3,命题点4,考情分析与预测,知能点1,原子结构与元素周期表,知能点2等内容,欢迎下载使用。
这是一份2022版《导与练》高考化学二轮复习 区间三 物质的性质与变化课件PPT,共60页。PPT课件主要包含了命题点1,命题点2,命题点3,命题点4,无机化工流程微型化,命题点5,物质转化微观过程探析,考情分析与预测,知能点1,知能点2等内容,欢迎下载使用。









