





2022版《导与练》高考化学二轮复习 区间六 电解质溶液课件PPT
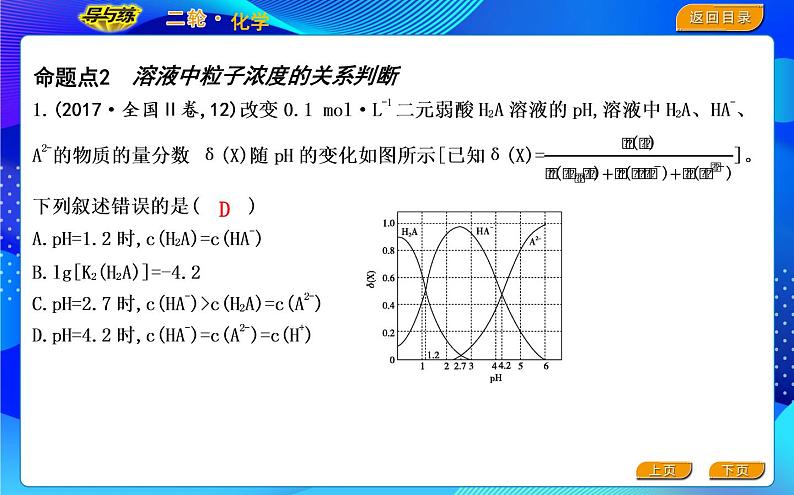
展开NO.1 “品”高考考情——考什么?怎么考?精准备考!
2.(2021·浙江6月选考,19)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是( )A.25 ℃时,若测得0.01 ml·L-1 NaR溶液pH=7,则HR是弱酸B.25 ℃时,若测得0.01 ml·L-1 HR溶液pH>2且 pH<7,则HR是弱酸C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
3.(2021·广东卷,8)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是( ) ml·L-1 GHCl水溶液的pH= ml·L-1 GHCl水溶液加水稀释,pH升高
溶液中粒子浓度的关系判断
2.(2021·湖南卷,9)常温下,用0.100 0 ml·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 ml·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
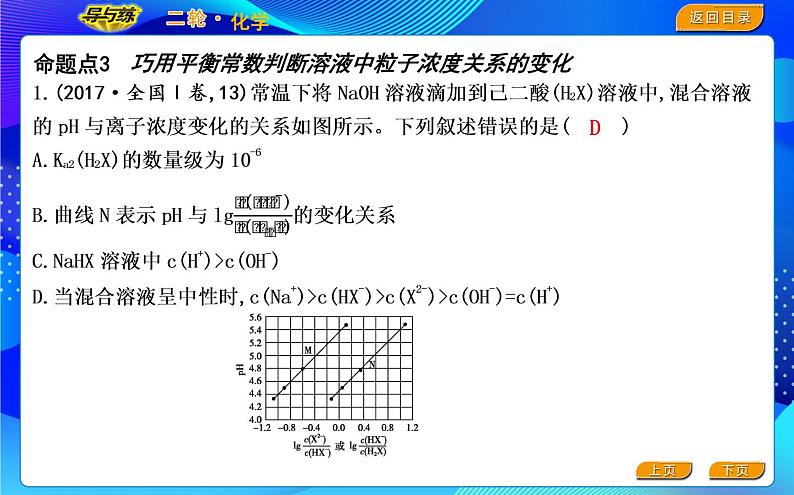
巧用平衡常数判断溶液中粒子浓度关系的变化
结合图像判断溶液中粒子浓度的关系
2.(2019·全国Ⅰ卷,11)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3 ,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2-的导电能力之和大于HA-的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
沉淀溶解平衡的图像分析及其计算
1.(2021·全国乙卷,13)HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)~c(H+)为线性关系,如下图中实线所示。下列叙述错误的是( )A.溶液pH=4时,c(M+)<3.0×10-4 ml·L-1B.MA的溶度积Ksp(MA)=5.0×10-8C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)D.HA的电离常数Ka(HA)≈2.0×10-4
3.(2019·全国Ⅱ卷,12)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )A.图中a和b分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)
1.此类型题目属于极高概率考查题型。全国Ⅰ卷仅2018年没有考查,全国Ⅲ卷每年必考,全国Ⅱ卷偶尔不考。此类题型基本均属压轴题型,具有难度高、综合性强等特点。只有一些高素质学生才能较快地做出此类题型,一般学生仅能弄懂其中一至二个选项。2.此类题型重点考查学生综合分析能力、图像理解能力以及数据处理能力。考查热点有三个守恒关系(电荷守恒、物料守恒、质子守恒)、平衡常数相关计算与判断、数量级以及离子浓度大小排序等。3.此类题型难点有对数坐标的理解、多个平衡之间的关系判断及图像的理解。4.从2021年全国甲、乙卷考查情况看,考查的均是涉及沉淀溶解平衡的图像型题目。预测2022年考查的概率极大,形式应该以图像为呈现方式,主要考查点应该以弱电解质电离平衡、盐类水解平衡、沉淀溶解平衡为主。考虑到命题者的求新、求异,也有可能结合“配位平衡”或“电位滴定”进行考查。
NO.2 “讲”必备知识——考什么,讲什么,实现精讲!
溶液中三大平衡及影响因素
1.影响弱电解质电离平衡、盐类水解平衡、沉淀溶解平衡的因素(1)内因:电解质、盐类、沉淀的本性。(2)外因①温度:温度越高,电离程度一般越大、水解程度越大、溶解程度越大(极个别例外,比如温度越高氢氧化钙溶解度反而越小,其他特殊物质题目一般会给出信息)。
②浓度:单一微粒浓度改变,平衡会向着减弱该微粒浓度改变的方向移动;加水会造成所有微粒浓度减小(除水外,温度不变时H+、OH-浓度变化相反)。注意:外加酸、碱、盐以及能反应的物质均从“单一微粒浓度改变”加以认识。例:醋酸溶液中加CH3COONa固体,实际上是单独增大了CH3COO-的浓度,所以平衡逆向移动,减弱这种改变。2.水的电离影响因素水是一种极弱的电解质,可以根据普通弱电解质电离平衡影响因素分析。①外加酸碱:抑制水的电离(水的电离平衡逆向移动);②外加含弱离子的盐:促进水的电离(水的电离平衡正向移动);③外加活泼金属或氧化物等情况复杂,不予考虑。
溶液中四大常数的关系及综合应用
1.四大常数(1)水的离子积常数Kw。(2)弱电解质电离常数:弱酸电离常数Ka(二元弱酸有Ka1、Ka2)、弱碱电离常数Kb。(3)盐的水解常数:Kh(多元弱酸根有多级水解Kh1、Kh2)。(4)沉淀的溶度积常数:Ksp。
2.所有常数均只与温度有关系(即温度不变,K不变);各种常数在水中或其他稀酸、碱、盐溶液中可能受到各种相关微粒浓度影响,平衡会移动,但是其数值不变。比如稀酸、稀碱溶液中由于H+、OH-浓度较高抑制了水的电离平衡,但水的Kw不变[不过注意Kw=c(H+)·c(OH-),此时H+、OH-浓度也包括稀酸、稀碱电离产生的氢离子和氢氧根离子];再比如CH3COOH在醋酸钠溶液中电离受到抑制,但其Ka不变[Ka表达式中 c(CH3COO-)也包含醋酸钠电离产生的醋酸根离子在内],沉淀溶解平衡类似。所以各种常数表达式中,各微粒浓度均指“溶液中的该微粒浓度”,而并非专指“水、弱酸碱、弱离子盐、沉淀”产生的该微粒浓度。
4.熟练掌握各种常数表达式的书写和基本计算,能运用 Qc与各种K的关系定量判断各种平衡的移动方向:Qc>K,平衡逆向移动;Qc
1.弱酸碱的电离(1)电解质越弱,电离程度越小,电离出的离子浓度通常越低。(2)Ka1≫Ka2,所以一级电离出的离子浓度大于二级电离出的离子浓度。2.盐类水解(1)盐的弱离子对应弱电解质越弱,弱离子水解程度就越大,弱离子的浓度则越小,水解出来的微粒(分子或离子)浓度则越大。(2)Kh1≫Kh2。3.弱电解质电离以及盐类水解程度都很小通常弱电解质电离度多数在10%以内,多数盐类单水解时水解度在1%以内,但注意题目所给条件,有例外的情况。
4.何时考虑水解平衡、电离平衡(1)弱电解质溶液:仅考虑电离平衡(还有水的电离平衡)。(2)含弱离子的盐类(正盐):仅考虑水解平衡(还有水的电离平衡)。(3)弱酸—弱酸盐混合液,弱碱—弱碱盐混合液,酸式盐溶液:既考虑弱酸、碱电离平衡,又考虑盐所含弱离子的水解平衡(酸式酸根离子既水解又电离)。5.三个守恒规律(1)电荷守恒:阳离子所带正电荷总数=阴离子所带负电荷总数。
电解质溶液类题目处理技巧
1.电解质溶液类题目的标志:出现类似以下特点c(X-)>c(Y+)>c(Z-)>c(R+)或c(Y+)+c(R+)=c(Z-)+c(X-)的选项,前者一般属于离子浓度大小比较类题型,可以根据水解程度、电离程度相对大小解决,有些也可以根据电荷守恒结合酸碱性分析,后者一般考查的是“三个守恒”。2.对于酸碱混合型(一弱一强)的离子浓度大小排序问题可用“三点分析法”进行分析。三点分别为:(1)半中点:一元酸、碱弱的一方反应掉50%或二元弱酸被中和掉50%。(2)中性点:溶液整体显中性时溶液中既有弱酸、碱剩余,又有生成的含弱离子的盐存在。
(3)中和点:酸、碱按照方程式化学计量数比恰好完全中和的点。例:CH3COOH与NaOH中和过程。
②中性点:因为显中性,所以有c(H+)=c(OH-),根据电荷守恒有c(CH3COO-)=c(Na+),同时中性溶液中常温下c(H+)=c(OH-)=10-7ml·L-1,浓度极低,所以最后排序为c(CH3COO-)=c(Na+)>c(H+)=c(OH-)。
③中和点:是醋酸被完全中和的点,此时溶液是CH3COONa溶液,由于CH3COO-水解,所以有c(Na+)>c(CH3COO-),由于水解显碱性,所以有 c(OH-)>c(H+),由于醋酸根水解程度较小,所以有c(CH3COO-)>c(OH-),最终排序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。一般题目经常考的就是这几个点的粒子浓度比较,其他点较少考查,如有考查可以根据上述三点综合分析。注意:二元弱酸与一元强碱反应可以根据“一级中和点”“二级中和点”类似进行分析,比如H2C2O4与NaOH反应,一级中和时溶质为NaHC2O4,二级中和时溶质为Na2C2O4。再如二元弱酸正盐与一元强酸反应可以根据“一级反应点”“二级反应点”类似分析,比如Na2C2O4与HCl反应,一级反应点溶质为NaHC2O4和NaCl(1∶1),二级反应点溶质为H2C2O4和NaCl(1∶2)等等。
3.电解质溶液类题目涉及图像坐标为对数时:要“化对为指”,即把对数(或负对数)坐标化为指数坐标来考虑,要注意负对数化为指数坐标后,沿坐标轴方向坐标值是减小的。例:(2018·全国Ⅲ卷,12)如图1是原题图像,如图2是“化对为指”后图像
4.电解质溶液类题目涉及K计算的图像通常均根据“交点”或“有坐标值的点”进行计算:例(2017·全国Ⅱ卷,12)
NO.3 “练”关键能力——考什么,练什么,实现精练!
1.(2021·浙江高三模拟)25 ℃时,下列说法正确的是( )A.H2A溶液与NaOH溶液按物质的量1∶1恰好完全反应时,溶液酸碱性无法判断B.可溶性正盐BA溶液呈中性,可以推测BA对水的电离没有影响C.醋酸的电离度:pH=3的醋酸溶液大于pH=4的醋酸溶液D.pH=2的HCl和pH=12的Ba(OH)2溶液等体积混合后,溶液显碱性
解析 H2A溶液与NaOH溶液按物质的量1∶1恰好完全反应后,生成的是NaHA,但是H2A的电离常数不知道,所以该溶液酸碱性无法判断,A正确;可溶性正盐BA溶液呈中性,只能说明HA和BOH的电离常数相同,但是如果都是弱酸、弱碱,且电离常数相同,则BA的阴、阳离子水解程度相同,促进水的电离,B错误;醋酸是弱电解质,稀释促进电离,稀释后溶液的pH增大,pH越大说明越稀,醋酸的电离程度越大,C错误;pH=2的HCl和pH=12的Ba(OH)2 溶液中,氢离子和氢氧根离子浓度相同,等体积混合后,溶液显中性,D错误。
2.(2021·天津南开中学高三三模)常温下,下列说法正确的是( )
溶液中粒子浓度关系判断
[思维建模] 此类题解题模式是①读图:如果有对数或负对数,则需要“化对为指”;若有倒数坐标,则把坐标“正过来”;②分析各选项内容:若为离子浓度大小比较类型选项,则首先分析溶液成分,然后根据电离、水解程度以及“三个守恒规律”进行分析;若为涉及K的计算,通常根据图像中“交点”或“有坐标值的点”来进行计算;若涉及“中和反应问题或数量级计算问题”,则根据上述“知能点4”技巧进行分析。
高考化学二轮复习专题7电解质溶液(含解析)课件PPT: 这是一份高考化学二轮复习专题7电解质溶液(含解析)课件PPT,共60页。PPT课件主要包含了对点集训,电解质溶液图像分析等内容,欢迎下载使用。
2022版《导与练》高考化学二轮复习 区间一 化学与STSE 化学与传统文化课件PPT: 这是一份2022版《导与练》高考化学二轮复习 区间一 化学与STSE 化学与传统文化课件PPT,共52页。PPT课件主要包含了考情纵览按图索题,命题点1,社会环境,命题点2,化学与生产生活,命题点3,化学与传统文化,考情分析与预测,知能点1,传统文化与化学史等内容,欢迎下载使用。
2022版《导与练》高考化学二轮复习 区间五 电化学课件PPT: 这是一份2022版《导与练》高考化学二轮复习 区间五 电化学课件PPT,共58页。PPT课件主要包含了命题点1,新型化学电源,命题点2,命题点3,命题点4,命题点5,金属的腐蚀与防护,命题点6,考情分析与预测,知能点1等内容,欢迎下载使用。












