


中职化学第六单元 电解质溶液课题1 溶液中的解离平衡精品课件ppt
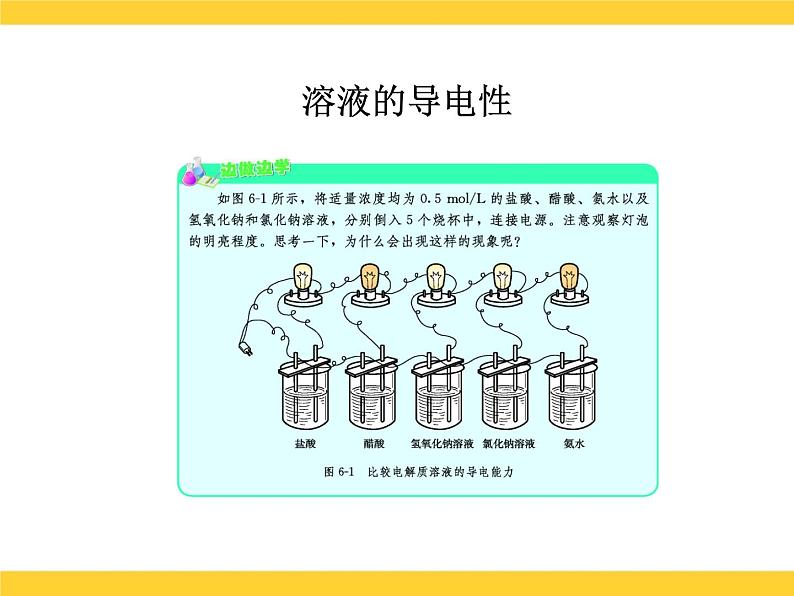
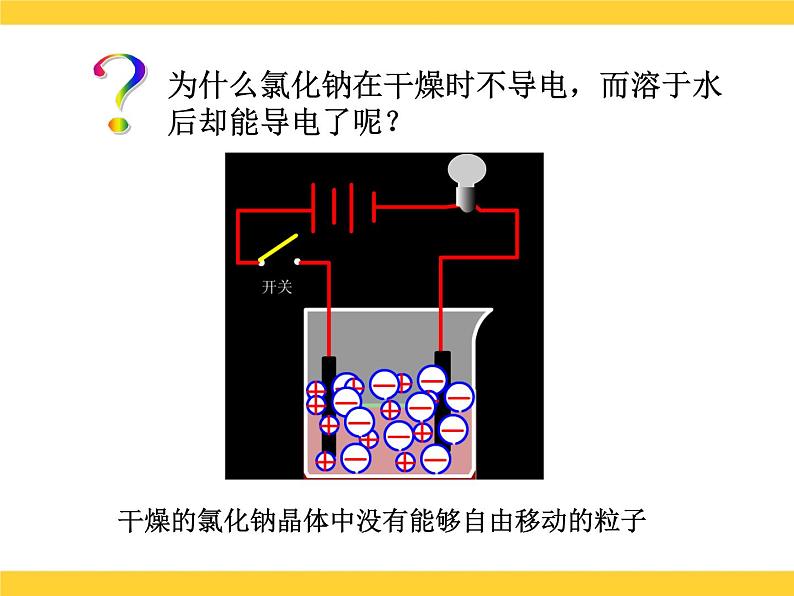
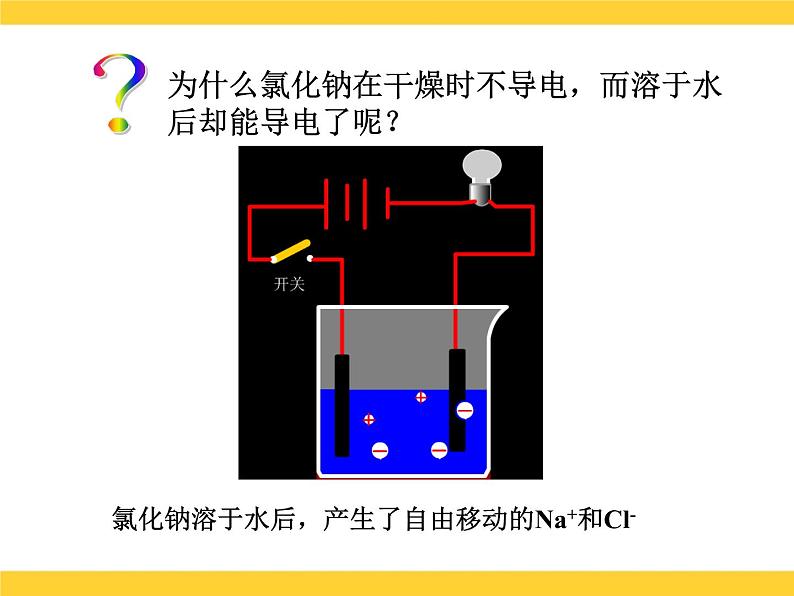
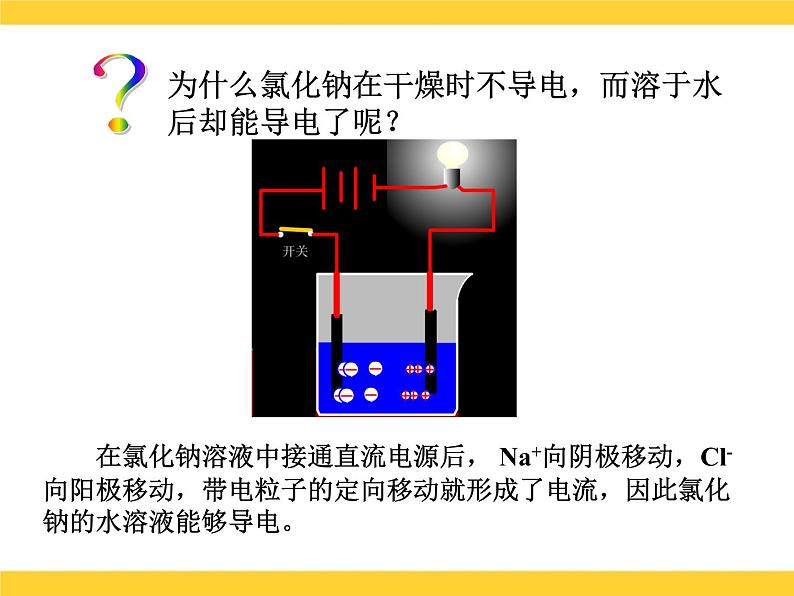
展开课题1 溶液的解离平衡溶液的导电性?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?干燥的氯化钠晶体中没有能够自由移动的粒子?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?氯化钠溶于水后,产生了自由移动的Na+和Cl-?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢? 在氯化钠溶液中接通直流电源后, Na+向阴极移动,Cl-向阳极移动,带电粒子的定向移动就形成了电流,因此氯化钠的水溶液能够导电。电离 定义:物质溶解于水后,离解成自由移动的离子的过程。 条件:必须有自由移动的带电的微粒的物质才能导电。 表示方法:电离方程式NaCl = Na+ + Cl-HCl=H + + Cl-NaOH=Na+ + OH-小结电离内因离子化合物:物质结构中含有离子,如:碱、盐等。共价化合物:分子中共用电子对偏移程度较大,如: 酸等。外因:溶于水后,在水分子作用下电离。溶液的导电性可用下式表示:酸 碱 盐化合物溶于水电离自由移动的离子外电场作用导电定向移动形成电流酸:HnR=nH++Rn-碱:M(OH)n= Mn+ + nOH-基本概念电解质: 是在水溶液中或熔融状态能够导电的化合物。如:酸、碱、盐都是电解质,它们的水溶液都能导电,但导电能力不同。电解质的分类 据电解质在水中的导电能力不同,可将电解质分为:(1)强电解质:在水溶液中完全电离为 离子的,如NaCl、HCl等。它主要以正、负离子的形式存在于溶液中。 HCl H+ + Cl-(2)弱电解质:在水溶液中仅能部分电 离的,如HAc、NH3、等。 它主要以分子状态存在于溶液中,只有少部分电离成正、负离子。由于离子浓度小,导电性差,其电离过程是可逆的。 HAc H+ + Ac- 二、弱电解质的解离弱电解质分子解离成离子的速率离子结合成弱电解质分子的速率两种速率相等,处于解离平衡状态 弱电解质解离过程中离子生成和结合成分子的速率随时间的变化示意图1.解离平衡 一定条件下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,解离过程就达到了平衡状态,这就叫弱电解质的解离平衡。2.特征: 动: 定: 变 :解离平衡是动态平衡 v(离子化) = V(分子化)平衡时,离子和分子共存,浓度保持不变外界条件改变,解离平衡会发生移动3.解离平衡移动的影响因素(1)浓度:加水稀释,电离平衡向电离方向移动,即溶液浓度越小,弱电解质越易解离。(2)温度:升温,电离平衡向解离方向移动(电离一般要吸热)。 溶液越稀越解离;温度越高越解离。课堂练习 1.下列物质:①能导电的是( ) ②属于电解质的是( ) ③属于非电解质的是( ) A. 溶液 B.铜 C.液态 D.液态 E.蔗糖溶液 F.液氨 G.氨水 H. 溶液 I.石墨 J.无水乙醇 2.把0.05mol 固体分别加入到下列100mL液体中,溶液的导电性基本不变,该液体是( ) A.自来水 B.0.5mol/L盐酸 C.0.5mol/L醋酸 D.0.5mol/L氨水
化学农林牧渔类第二节 弱电解质的解离平衡优秀ppt课件: 这是一份化学农林牧渔类第二节 弱电解质的解离平衡优秀ppt课件,共21页。PPT课件主要包含了学习目标与核心素养,主要内容,强电解质和弱电解质,弱电解质的解离平衡,实验与探究,实验现象,HCl,NaOH,实验结论,过程分析等内容,欢迎下载使用。
中职化学高教版(2021)化学通用类第二节 弱电解质的解离平衡优秀ppt课件: 这是一份中职化学高教版(2021)化学通用类第二节 弱电解质的解离平衡优秀ppt课件,共60页。PPT课件主要包含了质量浓度,学中做,物质的量浓度,02×1023,做中学,摩尔质量,气体摩尔体积,←粒子大小,第二节化学平衡,碳酸钙分解需加高温等内容,欢迎下载使用。
中职课题1 糖类优秀ppt课件: 这是一份中职课题1 糖类优秀ppt课件












