


中职化学人教版通用类课题2 来自地层深处的元素——硫精品课件ppt
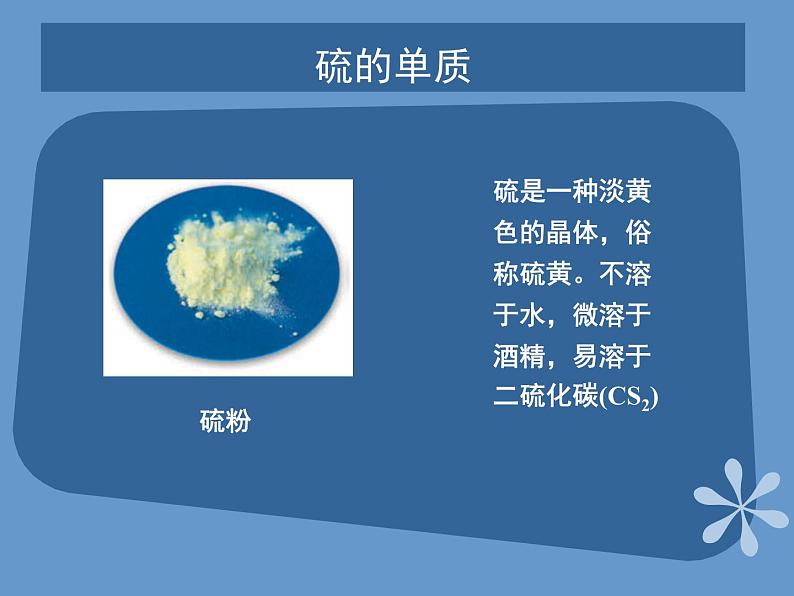
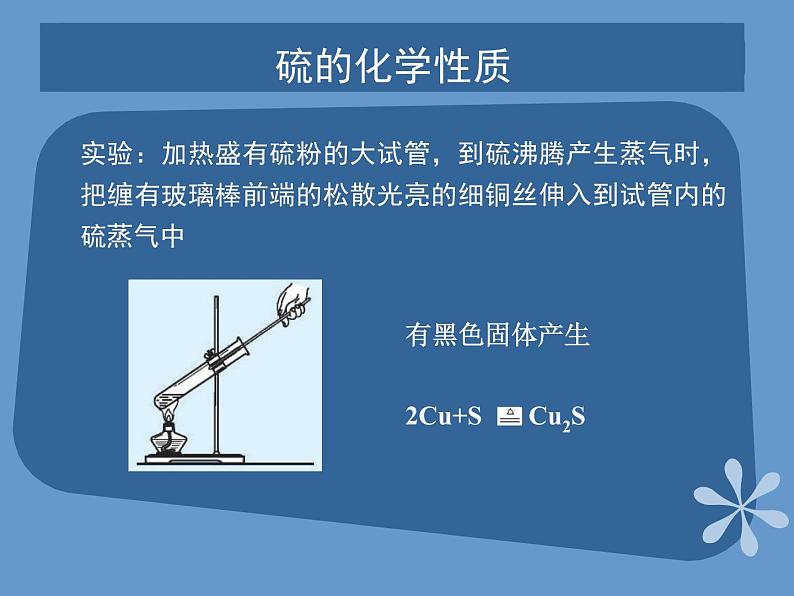
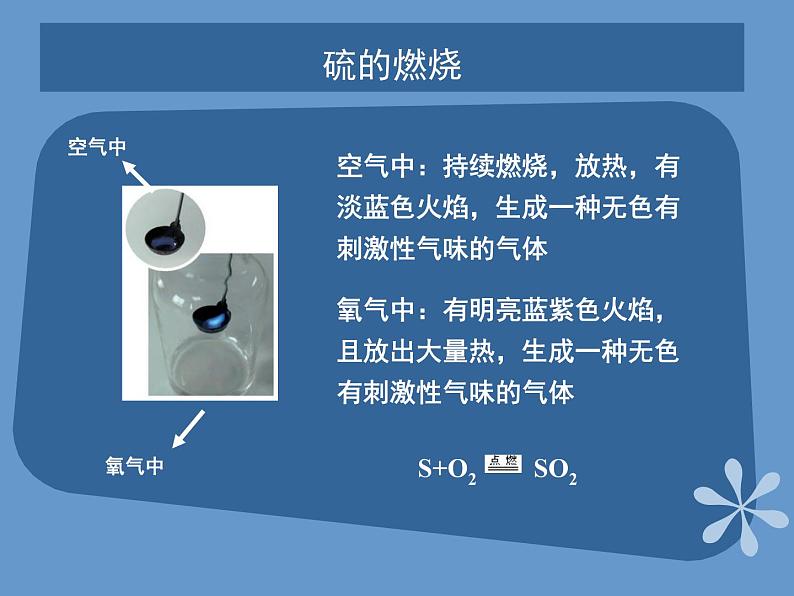
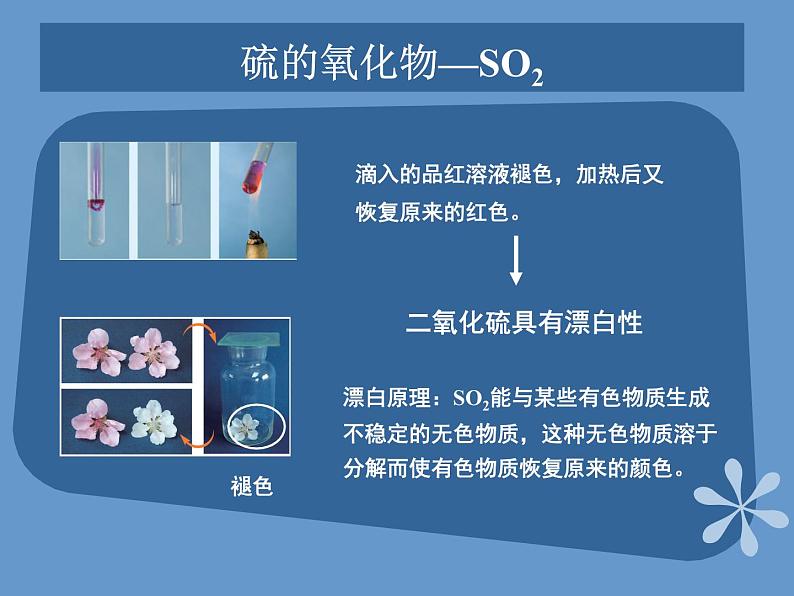
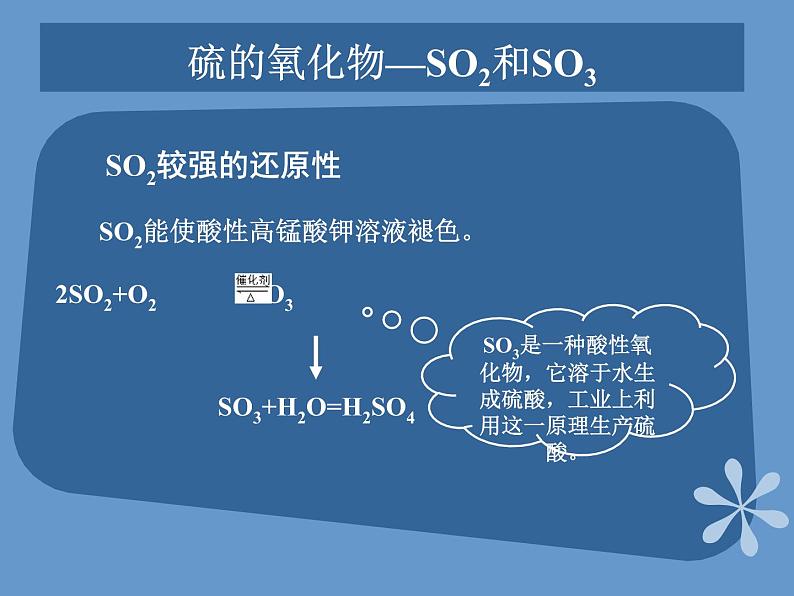
展开课题2 来自地层深处的元素—硫第四单元 自然界中的非金属元素教学目标了解硫的物理性质和存在,掌握硫的化学性质;了解二氧化硫和三氧化硫的性质;掌握硫酸的重要性质及用途;了解硫化氢的性质;掌握硫酸根离子的检验方法。硫的单质硫是一种淡黄色的晶体,俗称硫黄。不溶于水,微溶于酒精,易溶于二硫化碳(CS2) 硫粉常见金属物理性质对照表 硫的化学性质实验:加热盛有硫粉的大试管,到硫沸腾产生蒸气时,把缠有玻璃棒前端的松散光亮的细铜丝伸入到试管内的硫蒸气中硫的燃烧空气中:持续燃烧,放热,有淡蓝色火焰,生成一种无色有刺激性气味的气体空气中氧气中氧气中:有明亮蓝紫色火焰,且放出大量热,生成一种无色有刺激性气味的气体硫的氧化物—SO2SO2是一种无色、有刺激性气味、有毒的气体,其密度比空气大、易液化、易溶于水。 SO2是酸性氧化物,溶于水生成亚硫酸,亚硫酸是一种弱酸,不稳定,容易分解成水和二氧化硫 。硫的氧化物—SO2二氧化硫具有漂白性 滴入的品红溶液褪色,加热后又恢复原来的红色。 漂白原理:SO2能与某些有色物质生成不稳定的无色物质,这种无色物质溶于分解而使有色物质恢复原来的颜色。 褪色硫的氧化物—SO2和SO3 SO2较强的还原性SO2能使酸性高锰酸钾溶液褪色。SO3+H2O=H2SO4 SO3是一种酸性氧化物,它溶于水生成硫酸,工业上利用这一原理生产硫酸。浓硫酸的特性 脱水性按水的组成比脱去纸、棉布、木条、蔗糖等有机物中的氢、氧元素。 浓硫酸的特性 吸水性:能够干燥SO2、H2等气体强氧化性:浓硫酸的特性 在常温下,浓硫酸接触铁、铝等金属时易钝化,即能够使金属表面生成一薄层致密的氧化物保护膜,这层保护膜阻止了内部金属继续与硫酸反应。硫酸钙 硫酸钙是白色固体。带两分子结晶水的硫酸钙(CaSO4·2H2O)叫做石膏石膏在自然界中以石膏矿的形式存在。将石膏加热到150℃时,就会失去所含大部分结晶水而变成熟石膏(2CaSO4·H2O)。熟石膏与水泥合成糊状物后很快凝固,重新变成石膏。石膏可做各种模型和医疗上用的石膏绷带。硫酸钡 天然的硫酸钡叫做重晶石。重晶石是制造其他钡盐的原料。硫酸钡不溶于水,也不溶于酸。利用这一性质以及它不容易被X射线透过的性质,医疗上常用硫酸钡作X射线透视肠胃的内服药剂,俗称“钡餐”。硫酸钡还可以作白色颜料。硫化氢的性质 硫化氢是一种无色、有臭鸡蛋气味的剧毒气体,能溶于水,密度比空气大。硫化氢的水溶液是一种酸,能使石蕊溶液变红。硫酸根离子的检验 CO32-+Ba2+=BaCO3↓BaCO3+2H+= Ba2++CO2↑+H2O 再加入少量HCl向盛有3mLNa2CO3溶液的试管中加入3mLBaCl2溶液 再加入少量HCl产生白色沉淀向盛有3mLNa2SO4溶液的试管中加入3mLBaCl2溶液 SO42-+Ba2+=BaSO4↓ 白色沉淀不消失再加入少量HCl 产生白色沉淀向盛有3 mL H2SO4溶液的试管中加入3mLBaCl2溶液反应方程式 现象实验现象实验白色沉淀不消失白色沉淀消失产生白色沉淀SO42-+Ba2+=BaSO4↓ 硫酸根离子的检验 SO42-的检验:盐酸酸化原溶液后,加入BaCl2溶液,若有白色沉淀出现,说明原溶液中有SO42-存在。 Thank you!
中职课题1 糖类优秀ppt课件: 这是一份中职课题1 糖类优秀ppt课件
中职化学人教版通用类课题4 乙酸完美版课件ppt: 这是一份中职化学人教版通用类课题4 乙酸完美版课件ppt
人教版通用类课题3 乙醛试讲课ppt课件: 这是一份人教版通用类课题3 乙醛试讲课ppt课件












