



还剩7页未读,
继续阅读
所属成套资源:中职化学通用类课件PPT人教版
成套系列资料,整套一键下载
人教版通用类第三单元 化学反应的探寻课题2 离子反应精品ppt课件
展开
这是一份人教版通用类第三单元 化学反应的探寻课题2 离子反应精品ppt课件
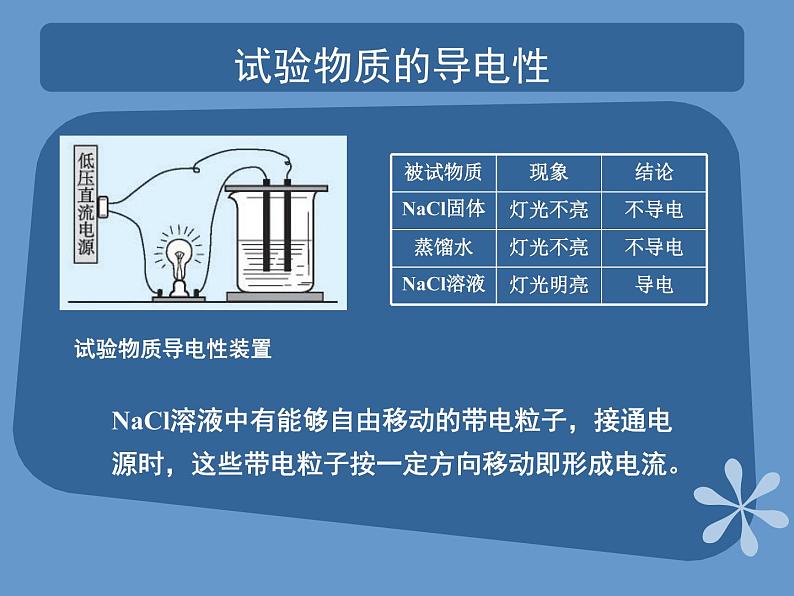
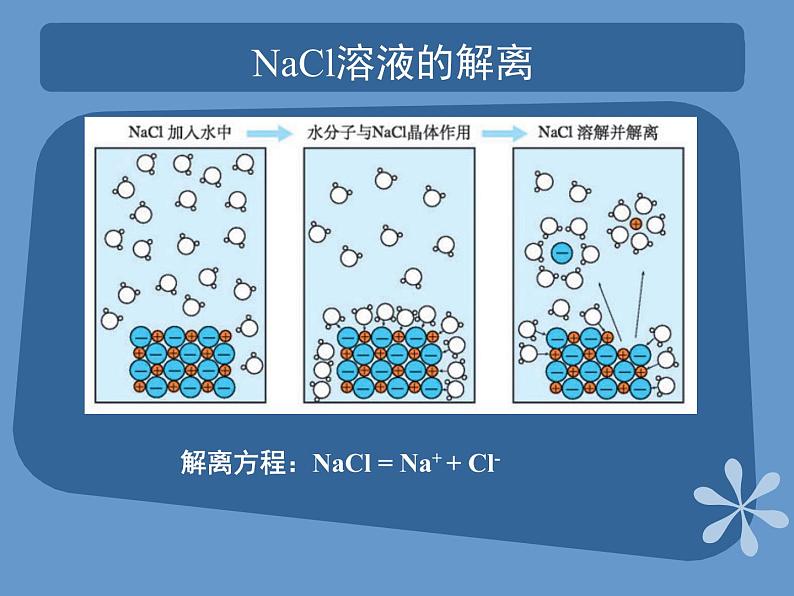
课题2 离子反应第三单元 化学反应的探寻教学目标通过试验物质导电性实验演示,了解电解质的概念及解离过程;能够区分弱电解质与强电解质;理解离子反应及其发生的条件;掌握离子方程式的书写方法。试验物质的导电性NaCl溶液中有能够自由移动的带电粒子,接通电源时,这些带电粒子按一定方向移动即形成电流。试验物质导电性装置常见金属物理性质对照表 NaCl溶液的解离解离方程:NaCl = Na+ + Cl-电解质和非电解质概念:酸、碱、盐不仅在水溶液里可以导电,在熔融 状态下也可以导电的化合物KNO3 = K+ + NO3-HCl = H+ + Cl-NaOH = Na+ + OH-在水溶液里或熔融状态下不能导电的化合物叫非电解质。如:C2H5OH、蔗糖等。电解质的分类根据导电能力的不同,电解质分为强电解质和弱电解质强电解质:在融熔状态或水溶液中完全电离成自由移动离子的电解质,如NaCl溶液。弱电解质:在水溶液中只有一部分分子电离成离子的电解质叫做弱电解质,如CH3COOH。课堂练习 归类下列物质: H2SO4,NaCl晶体,Cu片,蔗糖,Cl2,石墨,CO2, 盐酸,氨水,CH3COOH 电解质:非电解质: 能导电: 强电解质: 弱电解质: H2SO4、盐酸、氨水,CH3COOH NaCl晶体、Cu片、Cl2、石墨、CO2H2SO4、Cu片、蔗糖、石墨、盐酸、氨水、CH3COOH H2SO4、盐酸氨水,CH3COOH 离子反应 概念:有离子参加或离子生成的反应。白色沉淀产生向盛有2 mLNa2SO4溶液的试管中加入等量BaCl2溶液2Na+、SO42-无现象向盛有2 mLNa2SO4溶液的试管中加入等量KCl溶液1混合后溶液中的粒子混合前溶液中的粒子分析实验现象实验步骤序号Na+、K+、SO42-、Cl-Na+、SO42-Na+、 Cl- 、BaSO4SO42-+Ba2+=BaSO4↓离子反应方程式 概念:用实际参加反应的离子符号表示离子反应的式子 NaCl +AgNO3 = AgCl↓+ NaNO3 KCl +AgNO3 = AgCl↓+ KNO3 实质相同Ag+ + Cl- = AgCl↓ 离子反应方程式的书写步骤 第一步,写出反应的化学方程式: Na2SO4+BaCl2=2NaCl+BaSO4↓第二步,将易溶于水、易解离的物质写成离子形式,难溶 的物质或难解离的物质以及气体等写化学式 。弱电解质、气体、沉淀第三步,删去方程式两边不参加反应的离子 :2Na+ + SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4↓SO42-+Ba2+=BaSO4↓第四步,检查离子方程式两边各元素的原子个数和电荷总数是否相等。离子方程式的意义 离子方程式不仅可以表示物质间的某个反应,而且还可以表示同一类型离子反应的实质,不同于一般的化学方程式,H+ + OH- = H2O不仅可以表示HCl溶液与NaOH溶液的反应,而且还可以表示其他强酸与强碱发生的中和反应课堂练习 P631~4题Thank you!
课题2 离子反应第三单元 化学反应的探寻教学目标通过试验物质导电性实验演示,了解电解质的概念及解离过程;能够区分弱电解质与强电解质;理解离子反应及其发生的条件;掌握离子方程式的书写方法。试验物质的导电性NaCl溶液中有能够自由移动的带电粒子,接通电源时,这些带电粒子按一定方向移动即形成电流。试验物质导电性装置常见金属物理性质对照表 NaCl溶液的解离解离方程:NaCl = Na+ + Cl-电解质和非电解质概念:酸、碱、盐不仅在水溶液里可以导电,在熔融 状态下也可以导电的化合物KNO3 = K+ + NO3-HCl = H+ + Cl-NaOH = Na+ + OH-在水溶液里或熔融状态下不能导电的化合物叫非电解质。如:C2H5OH、蔗糖等。电解质的分类根据导电能力的不同,电解质分为强电解质和弱电解质强电解质:在融熔状态或水溶液中完全电离成自由移动离子的电解质,如NaCl溶液。弱电解质:在水溶液中只有一部分分子电离成离子的电解质叫做弱电解质,如CH3COOH。课堂练习 归类下列物质: H2SO4,NaCl晶体,Cu片,蔗糖,Cl2,石墨,CO2, 盐酸,氨水,CH3COOH 电解质:非电解质: 能导电: 强电解质: 弱电解质: H2SO4、盐酸、氨水,CH3COOH NaCl晶体、Cu片、Cl2、石墨、CO2H2SO4、Cu片、蔗糖、石墨、盐酸、氨水、CH3COOH H2SO4、盐酸氨水,CH3COOH 离子反应 概念:有离子参加或离子生成的反应。白色沉淀产生向盛有2 mLNa2SO4溶液的试管中加入等量BaCl2溶液2Na+、SO42-无现象向盛有2 mLNa2SO4溶液的试管中加入等量KCl溶液1混合后溶液中的粒子混合前溶液中的粒子分析实验现象实验步骤序号Na+、K+、SO42-、Cl-Na+、SO42-Na+、 Cl- 、BaSO4SO42-+Ba2+=BaSO4↓离子反应方程式 概念:用实际参加反应的离子符号表示离子反应的式子 NaCl +AgNO3 = AgCl↓+ NaNO3 KCl +AgNO3 = AgCl↓+ KNO3 实质相同Ag+ + Cl- = AgCl↓ 离子反应方程式的书写步骤 第一步,写出反应的化学方程式: Na2SO4+BaCl2=2NaCl+BaSO4↓第二步,将易溶于水、易解离的物质写成离子形式,难溶 的物质或难解离的物质以及气体等写化学式 。弱电解质、气体、沉淀第三步,删去方程式两边不参加反应的离子 :2Na+ + SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4↓SO42-+Ba2+=BaSO4↓第四步,检查离子方程式两边各元素的原子个数和电荷总数是否相等。离子方程式的意义 离子方程式不仅可以表示物质间的某个反应,而且还可以表示同一类型离子反应的实质,不同于一般的化学方程式,H+ + OH- = H2O不仅可以表示HCl溶液与NaOH溶液的反应,而且还可以表示其他强酸与强碱发生的中和反应课堂练习 P631~4题Thank you!












