苏教版高中化学必修第二册模块综合检测含答案
展开模块综合检测
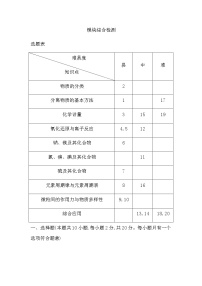
选题表
难易度 知识点 | 易 | 中 | 难 |
化学反应速率与限度 | 2,8,9 | 15 | 20 |
化学反应中能量变化 | 4 | 14 | 17 |
氮及其化合物的性质 | 6 |
| 19 |
简单有机化合物 | 1,5,7,11 |
| 18 |
铁及其化合物的性质 |
| 12,13 | 16 |
金属材料及金属冶炼 | 3,10 |
|
|
一、单项选择题(共10小题,每小题2分,共20分,每小题只有一个正确选项)
1.下列化学用语正确的是( C )
A.乙酸的分子式:CH3COOH
B.丙烷分子的空间填充模型:
C.乙烷的电子式:H
D.乙烯的结构简式:CH2CH2
解析:乙酸的分子式为C2H4O2,CH3COOH表示的是乙酸的结构简式,A错误;表示的是丙烷分子的球棍模型,B错误;电子式是在元素符号周围用“·”或“×”表示最外层电子的式子,乙烷分子中碳碳、碳氢之间形成共价键,用共用电子对来表示,C正确;有机物的结构简式指在分子式的基础上,要写出主要官能团的组成的式子,乙烯的官能团为,必须写明碳碳双键,因此乙烯的结构简式为CH2CH2,D错误。
2.工业合成氨的反应为N2+3H22NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( B )
A.达到平衡时,反应速率:v(正)=v(逆)=0
B.使用催化剂可加快反应速率,提高生产效率
C.为了提高H2的转化率,应适当增大H2的浓度
D.若在密闭容器中加入1 mol N2和过量的H2,最后能生成2 mol NH3
解析:化学平衡状态是动态平衡,达到平衡时反应速率:v(正)=v(逆)≠0,A错误;使用催化剂可加快反应速率,提高生产效率,B正确;为了提高H2的转化率,可增加氮气的浓度或减小氨气的浓度,C错误;此反应为可逆反应,反应有一定限度,氢气和氮气不能完全转化成氨气,D错误。
3.下列说法不正确的是( C )
A.钢是用量最大、用途最广的合金,青铜是我国使用最早的合金
B.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化物的材料
C.合金的硬度大于它的纯金属成分,熔点高于它的成分金属
D.钛合金、形状记忆合金、耐热合金以及储氢合金都属于新型合金
解析:钢是目前世界上用量最大、用途最广的合金,青铜是我国历史上使用最早的合金,A正确;储氢合金是指能与H2结合成金属氢化物的材料,能大量储存H2,B正确;一般地,合金的硬度大于它的纯金属成分,但熔点低于它的成分金属,C不正确;新型合金种类很多,像钛合金、形状记忆合金、耐热合金以及储氢合金都属于新型合金,D正确。
4.根据热化学方程式2H2(g)+O2(g)2H2O(g)
ΔH=-483.6 kJ· mol-1,下列说法或表达正确的是( A )
A.2 mol水蒸气分解生成2 mol氢气与1 mol氧气需吸收483.6 kJ的热量
B.2H2(g)+O2(g)2H2O(l) ΔH>-483.6 kJ· mol-1
C.H2(g)+O2(g)H2O(g) ΔH=241.8 kJ· mol-1
D.1 mol氢气与0.5 mol氧气总能量小于1 mol水蒸气的总能量
解析:互为逆反应的两个反应,热量的吸收或放出正好相反,但吸收或放出的热量的数值相等,表现在热化学方程式中就是热量的绝对值相等,符号相反,A正确;气态水变成液态水要放出热量,故等量的氢气与氧气反应生成液态水,放出的热量要多于生成气态水放出的热量,B错误;氢气与氧气反应为放热反应,ΔH为负号,C错误;1 mol氢气与0.5 mol 氧气总能量大于1 mol水蒸气的总能量,D错误。
5.下列反应属于取代反应的是( D )
A.CH4+2O2CO2+2H2O
B.CH2CH2+H2CH3CH3
C.2CH3CH2OH+O22CH3CHO+2H2O
D.+HO-NO2+H2O
解析:CH4+2O2CO2+2H2O,属于氧化反应,A错误;CH2CH2+H2CH3CH3,属于加成反应或还原反应,B错误;2CH3CH2OH+O22CH3CHO+
2H2O,属于氧化反应,C错误;+HO—NO2+H2O,属于取代反应,D正确。
6.用下列实验装置及药品制备相应气体,能达到实验目的的是( C )
选项 | 装置及药品 | 目的 |
A | 制备H2S | |
B | 制备NH3 | |
C | 制备NO2 | |
D | 制备Cl2 |
解析:HNO3具有强氧化性,与FeS反应不能产生H2S,应该使用稀H2SO4或稀HCl,A错误;NH4Cl受热分解产生NH3、HCl,两者在试管口遇冷又重新变为NH4Cl,因此不能用于制取NH3,B错误;Cu与浓硝酸混合发生反应产生Cu(NO3)2、NO2、H2O,因此可用来制取NO2气体,C正确;浓盐酸与MnO2混合加热反应可制取Cl2,而稀盐酸不能反应制取得Cl2,D错误。
7.下列说法正确的是( D )
A.CH4和Cl2按体积比1∶1混合,发生取代反应生成的产物只有两种
B.在光照条件下,烷烃易与溴水发生取代反应
C.酸性KMnO4溶液既可以验证乙烷和乙烯,还可以除去乙烷中混有的乙烯
D.乙烯与Br2的加成,乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
解析:CH4和Cl2按体积比1∶1混合,在光照条件下发生取代反应生成的产物有HCl、CH3Cl、CH2Cl2、CHCl3、CCl4,产物不止两种,A错误;在光照条件下,烷烃易与溴蒸气发生取代反应,与溴水不反应,B错误;乙烯可以被酸性高锰酸钾溶液氧化,高锰酸钾溶液褪色,而乙烷不能被氧化,所以酸性KMnO4溶液可以验证乙烷和乙烯;乙烯能够被酸性高锰酸钾溶液氧化生成二氧化碳,引入新杂质气体二氧化碳,因此不能用酸性KMnO4溶液除去乙烷中混有的乙烯,C错误;乙烯分子结构中存在碳碳双键,乙烯与Br2可以发生加成反应,乙烯可以被酸性KMnO4溶液氧化,导致高锰酸钾溶液褪色,故D正确。
8.下表中产生H2的反应速率最大的是( D )
编号 | 金属(粉 末状) | 金属物 质的量 / mol | 酸及酸 的浓度/ (mol·L-1) | 酸的体 积/ mL | 反应温 度/ ℃ |
A | Al | 0.2 | H2SO4 18.4 | 20 | 30 |
B | Mg | 0.2 | H2SO4 3 | 10 | 30 |
C | Fe | 0.1 | HNO3 6 | 20 | 60 |
D | Mg | 0.1 | H2SO4 3 | 10 | 60 |
解析:18.4 mol·L-1的硫酸是浓硫酸,Al遇浓硫酸会发生钝化,不产生H2,A不符合题意;铁会被硝酸氧化,该反应不产生H2,C不符合题意;B、D中,固体的物质的量不影响反应速率,温度高的反应速率较大,D符合题意。
9.在一密闭烧瓶中注入NO2,在25 ℃时建立下列平衡:2NO2(g)N2O4(g) ΔH=-55.3 kJ·mol-1,若把烧瓶置于100 ℃的沸水中,下列情况不变,能表示该反应达到平衡状态的是( A )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①②④ B.①③④
C.③⑤ D.①③
解析:①混合气体的颜色不变,则NO2气体的浓度不变,反应达到平衡状态;②混合气体的质量不变,但随反应的进行,物质的量在不断改变,当平均相对分子质量不变时,气体的物质的量不变,则反应达到平衡状态;③反应物与生成物都呈气态,质量始终不变,所以质量不变时,不能表明反应达到平衡状态;④反应前后气体的分子数不等,随着反应的不断进行,压强在不断改变,当压强不变时,反应达到平衡状态;⑤混合气体的质量和体积都不发生改变,密度始终不变,所以密度不变时,反应不一定达到平衡状态。综合以上分析,①②④正确。
10.金属冶炼的方法分为以下四种:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。古代有:a.火烧孔雀石炼铜;b.湿法炼铜。现代有:c.铝热法炼铬;d.从光卤石(KCl·MgCl2·6H2O)中炼镁。下列对它们冶炼方法的分析,不正确的是( B )
A.a属于① B.b属于②
C.c属于③ D.d属于④
解析:火烧孔雀石炼铜是利用焦炭法,A正确;湿法炼铜、铝热法炼铬是利用活泼金属置换法,B不正确、C正确;从光卤石中炼镁是利用电解法,D正确。
二、不定项选择题(共5小题,每小题4分,共20分,每小题有1~2个选项符合题意)
11.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述中,不正确的是( CD )
A.植物油能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.糖类、油脂和蛋白质都是高分子化合物
D.蛋白质遇浓硝酸变黄色
解析:植物油分子中有碳碳双键,能使溴的四氯化碳溶液褪色,A正确;淀粉在催化剂作用下水解,最终产物是葡萄糖,B正确;葡萄糖是单糖,油脂是高级脂肪酸甘油酯,两者均是小分子物质,不属于高分子化合物,C错误;含有苯环的蛋白质遇浓硝酸变黄色,不含苯环的蛋白质遇浓硝酸不变黄,D错误。
12.某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜,并制备氯化铁晶体,设计流程如下:
下列说法正确的是( BC )
A.试剂a是铁、试剂b是稀硫酸
B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒
C.若试剂c是过氧化氢和盐酸,相应的反应为2Fe2++H2O2+2H+2Fe3++2H2O
D.用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
解析:试剂b应为HCl,若用硫酸,则会引入杂质S,A错误;操作Ⅰ、Ⅱ为过滤,需用玻璃棒引流液体,操作Ⅲ涉及蒸发操作,需用玻璃棒搅拌,防止液体飞溅,B正确;H2O2可将Fe2+氧化为Fe3+,根据HCl添加H+配平电荷守恒,相应离子方程式为2Fe2++H2O2+2H+2Fe3++2H2O,C正确;溶液W中过量的HCl与KMnO4也反应,故此处不能用KMnO4检验Fe2+,D错误。
13.用CO还原2.40 g氧化铁,当固体质量变成2.28 g时,测得此固体中只存在2种氧化物。则此固体成分和它们的物质的量之比可能的是( A )
A.n(FeO)∶n(Fe3O4)=1∶1
B.n(Fe2O3)∶n(FeO)=2∶1
C.n(Fe2O3)∶n(FeO)=1∶1
D.n(Fe2O3)∶n(Fe3O4)=1∶1
解析:n(Fe2O3)==0.015 mol,所以所得固体中n(Fe)∶n(O)=
(0.015×2)∶(0.015×3-)=4∶5。当n(FeO)∶n(Fe3O4)=1∶1时,Fe、O原子数目之比为(1+3)∶(1+4)=4∶5,A符合题意;当n(Fe2O3)∶n(FeO)=2∶1时,Fe、O原子数目之比为(1+2×2)∶(1+3×2)=5∶7,B不符合题意;当n(Fe2O3)∶n(FeO)=1∶1时,Fe、O原子数目之比为(1+2)∶(1+3)=3∶4,C不符合题意;当n(Fe2O3)∶n(Fe3O4)=1∶1时,Fe、O原子数目之比为(3+2)∶(4+3)=5∶7,D不符合题意。
14.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2OCu2O+2Ag。下列有关说法正确的是( B )
A.2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与2 mol Ag具有的总能量
B.负极的电极反应式为2Cu+2OH--2e-Cu2O+H2O
C.测量原理示意图中,电流方向从Cu流向Ag2O
D.电池工作时,OH-向正极移动
解析:由题意知,该装置组成了原电池,反应过程中化学能转化为电能,反应物的总能量高于生成物的总能量,A错误;Cu在反应中失电子,为原电池的负极,故电流方向为Ag2O→Cu,C错误;电池工作时,电池内部OH-移向负极,D错误。
15.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:实验原理为2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+
8H2O,实验内容及记录如下:
实 验 编 号 | 室温下,试管中所加试剂及其用量/mL | 溶液紫 色褪去 所需时 间/min | |||
0.6 mol·L-1 H2C2O4溶液 | H2O | 3 mol·L-1 H2SO4溶液 | 0.05 mol·L-1 KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | a | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | b | 3.9 |
下列说法错误的是( BD )
A.a=3.0
B.b=5.0
C.根据上表中的实验数据可知,其他条件不变时,H2C2O4浓度越大,反应速率越快
D.忽略混合前后溶液体积的微小变化,实验1这段时间内平均反应速率v(H2C2O4)=0.15 mol·L-1·min-1
解析:由实验1可知,反应体系的总体积为10.0 mL,则实验2中总体积也应为10 mL,则表中a=10.0-2.0-2.0-3.0=3.0,A正确;b=10.0-
1.0-4.0-2.0=3.0,B错误;根据上表中的实验数据可知,其他条件不变时,H2C2O4浓度越大,溶液紫色褪去所需时间越少,即反应速率越快,C正确;紫色褪去说明高锰酸钾完全反应,该时间段内Δc(KMnO4)=
=0.015 mol·L-1,
所以v(KMnO4)==0.01 mol·L-1·min-1,根据反应方程式可知v(H2C2O4)=v(KMnO4)=0.025 mol·L-1·min-1,D错误。
三、非选择题(共5小题,共60分)
16.(10分)铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程式为 ;观察到的现象为 ;为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(2)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入 。
(3)除去蒸馏水中溶解的O2常采用 的方法。
(4)生成白色Fe(OH)2沉淀的操作是,用长胶头滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
。解析:(1)Fe(OH)2很不稳定,露置在空气中容易被氧化生成Fe(OH)3,化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3;观察到的现象为白色沉淀迅速变为灰绿色,最终变为红褐色。
(2)FeSO4溶液中Fe2+易被氧化为Fe3+,加入铁粉可以防止Fe2+被氧化。
(3)氢氧化亚铁的制备要隔绝空气,除去蒸馏水中溶解的O2常采用加热至沸腾的方法。
(4)长胶头滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,可以防止空气随着NaOH溶液的加入进入溶液,防止生成的Fe(OH)2被氧化。
答案:(1)4Fe(OH)2+O2+2H2O4Fe(OH)3 白色沉淀迅速变为灰绿色,最终变为红褐色 (2)铁粉 (3)加热至沸腾 (4)防止生成的Fe(OH)2被氧化
17.(12分)依据化学能与热能的相关知识回答下列问题:
(1)下列过程不一定属于放热过程的是 (填字母)。
A.形成化学键 B.燃料燃烧
C.化合反应 D.葡萄糖的氧化分解
E.酸碱中和 F.炸药爆炸
(2)已知A和B是同种元素形成的两种单质,A转化为B时需要吸收能量,则A和B中较稳定的是 (填“A”或“B”)。
(3)图中所示反应N2(g)+H2(g)NH3(g)为 (填“吸热”或“放热”)反应。
(4)1 mol NH3(g)生成1 mol N原子和3 mol H原子的过程 (填“吸收”或“放出”) kJ能量。
解析:(1)形成化学键、物质的燃烧、炸药爆炸、中和反应、葡萄糖的氧化分解均放出能量,只有C中化合反应可能为吸热反应,如碳与二氧化碳化合生成CO。(2)A转化为B时需吸收能量,可知A的能量低,B的能量较高,则较稳定的为A。(3)根据图示,反应物N2(g)+H2(g)的总能量高于生成物NH3(g)的总能量,反应放热。(4)1 mol NH3(g)生成
1 mol N原子和3 mol H原子的过程中发生了化学键的断裂,需要吸收能量;根据图示,吸收的能量为b kJ。
答案:(1)C (2)A (3)放热 (4)吸收 b
18.(12分)从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12∶1,H的相对分子质量为78。下列是有机物A~G之间的转化关系:
请回答下列问题:
(1)D中所含官能团的名称是 。
(2)写出反应③的化学方程式: 。
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,其结构简式: 。
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27 ℃)进行应急处理。写出由A制备F的化学方程式: 。
(5)下列关于B的一种同系物甲醇的说法不正确的是 (填字母)。
a.甲醇的结构简式为CH3OH,官能团为—OH
b.甲醇完全燃烧后的产物为CO2和H2O
c.B与甲醇都极易溶于水,是因为它们都含有与水分子结构相似的官能团:—OH
d.甲醇与钠反应可以产生氢气,所以甲醇显酸性
(6)等质量的A、H完全燃烧时消耗O2的物质的量 (填“A>H”“A<H”或“A=H”)。
解析:根据题意分析可知,A是CH2CH2,B是CH3CH2OH,C是CH3CHO,D是CH3COOH,E是CH3COOC2H5,F是CH3CH2Cl,H是苯。
(1)D是乙酸,其中所含官能团的名称是羧基。
(2)反应③是乙醇的催化氧化,化学方程式为
2CH3CH2OH+O22CH3CHO+2H2O。
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,因此G是聚乙烯,其结构简式为CH2—CH2。
(4)乙烯和氯化氢发生加成反应生成氯乙烷,反应的化学方程式为
CH2CH2+HClCH3CH2Cl。
(5)甲醇的结构简式为CH3OH,官能团为—OH,a正确;甲醇完全燃烧后的产物为CO2和H2O,b正确;B与甲醇都极易溶于水,是因为它们都含有官能团—OH,c正确;甲醇含有羟基,与钠反应可以产生氢气,甲醇是非电解质,不显酸性,d不正确。
(6)等质量的乙烯和苯,乙烯分子中氢元素含量高于苯中氢元素含量,含氢量越高,消耗的氧气越多,则等质量的A、H完全燃烧时消耗O2的物质的量A>H。
答案:(1)羧基
(2)2CH3CH2OH+O22CH3CHO+2H2O
(3)CH2—CH2
(4)CH2CH2+HClCH3CH2Cl
(5)d (6)A>H
19.(12分)工业上制取硝酸铵的流程如图,回答下列问题:
(1)NH3的电子式为 。
(2)设备Ⅱ中发生反应的化学方程式为
。
(3)设备Ⅲ中生成HNO3的化学方程式为 ,设备Ⅲ在工作时不断通入空气的目的是 。
(4)设备Ⅳ中的尾气主要为NO,可以用NaClO溶液吸收,其他条件相同,NO转化为N的转化率随NaClO溶液初始pH的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和N,其离子方程式为 。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是 。
解析:(1)NH3属于共价化合物,其电子式为
H。
(2)由框图可知:设备Ⅱ是氨气和氧气在催化剂的条件下发生反应,生成一氧化氮和水,其反应的化学方程式为4NH3+5O24NO+6H2O。
(3)由框图可知:设备Ⅲ中是一氧化氮和氧气反应生成二氧化氮,二氧化氮再和水反应生成一氧化氮和HNO3,该反应的化学方程式为2NO+
O22NO2,3NO2+H2O2HNO3+NO或4NO+3O2+2H2O4HNO3。设备Ⅲ在工作时不断通入空气的目的是使NO循环利用,最终NO全部转化成HNO3。
(4)①在酸性NaClO溶液中,HClO氧化NO生成Cl-和N,其离子方程式为3HClO+2NO+H2O3Cl-+2N+5H+或3ClO-+2NO+H2O3Cl-+2N+
2H+。②pH越小,溶液的酸性越强,溶液中HClO的浓度越大,氧化NO的能力越强,NO转化率越高。
答案:(1)H
(2)4NH3+5O24NO+6H2O (3)4NO+3O2+2H2O4HNO3(或2NO+O22NO2,3NO2+H2O2HNO3+NO) 可使NO循环利用,将NO全部转化成HNO3 (4)①3HClO+2NO+H2O3Cl-+2N+5H+(或3ClO-+2NO+H2O3Cl-+
2N+2H+) ②溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强
20.(14分)按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向 (填“正”或“负”,下同)极移动。
②电子流动方向由 极流向 极。
③若有1 mol e-流过导线,则理论上负极质量减少 g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是 (填“锌极”或“铜极”),原因是 (用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
①反应化学方程式中各物质的化学计量数之比为a∶b∶c= 。
②1 min到3 min这段时间,以M的浓度变化表示的平均反应速率为 。
③下列叙述中能说明上述反应达到平衡状态的是 (填字母)。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
解析:(1)①在原电池工作的过程中,阳离子向正极移动。②在原电池中,电子由负极流出,流入正极。③负极的电极反应为Zn-2e-Zn2+,当转移1 mol e-时,消耗0.5 mol Zn,质量为0.5 mol×65 g·mol-1=
32.5 g。④稀硫酸换成硫酸铜溶液后,在正极为铜离子得电子被还原。
(2)①由图示信息可知:N、M、P的物质的量在0~6 min内的变化量分别为6 mol、3 mol、3 mol,因其物质的量变化量之比等于化学计量数之比,故a∶b∶c=2∶1∶1。②1 min到3 min这段时间,M的浓度变化量为=0.5 mol·L-1,则速率为0.25 mol·L-1·min-1。
③反应中当M与N的物质的量相等时,并不能说明M或N的浓度保持不变,不一定平衡,A错误;P的质量不随时间变化而变化,说明P的浓度保持不变,处于平衡状态,B正确;由于该反应是一个反应前后等体积的可逆反应,混合气体的总物质的量并不随反应的进行而变化,不一定平衡,C错误;单位时间内每消耗a mol N,同时消耗b mol M,说明反应的正、逆反应速率相等,处于平衡状态,D正确;由于该反应是一个反应前后等体积的可逆反应,混合气体的压强不随反应的进行而发生改变,不一定平衡,E错误;M的物质的量浓度保持不变,说明反应处于平衡状态,F正确。
答案:(1)①正 ②负 正 ③32.5 ④铜极 Cu2++2e-Cu
(2)①2∶1∶1 ②0.25 mol·L-1· min-1 ③BDF
苏教版必修一 化学 模块综合试卷(含答案)—2023-2024学年(苏教版2019)高中化学必修1: 这是一份高中化学苏教版 (2019)必修 第一册本册综合同步测试题,共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
鲁科版高中化学必修第二册模块综合测评含答案: 这是一份鲁科版高中化学必修第二册模块综合测评含答案,共14页。
苏教版高中化学选择性必修2模块综合测评含答案: 这是一份苏教版高中化学选择性必修2模块综合测评含答案,共18页。