

苏教版高中化学必修第一册模块综合检测含答案
展开模块综合检测
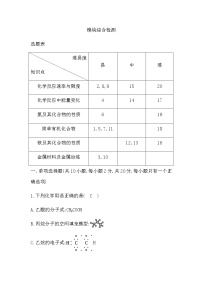
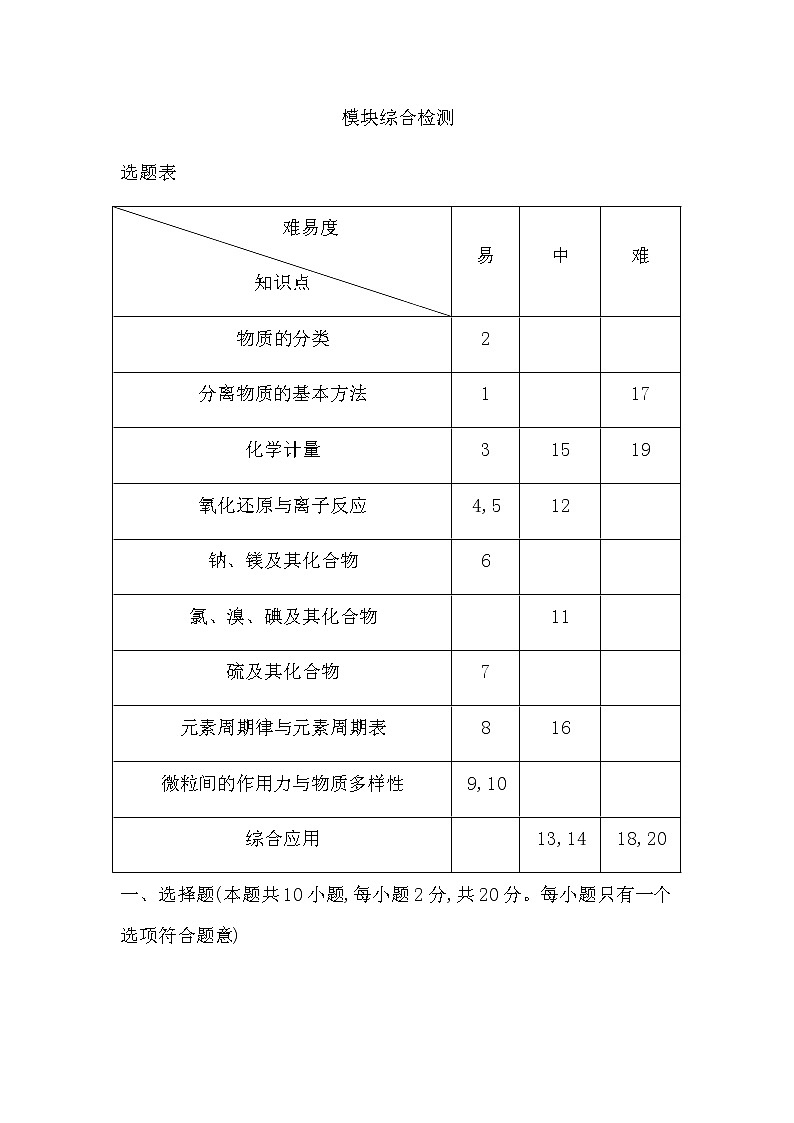
选题表
难易度 知识点 | 易 | 中 | 难 |
物质的分类 | 2 |
|
|
分离物质的基本方法 | 1 |
| 17 |
化学计量 | 3 | 15 | 19 |
氧化还原与离子反应 | 4,5 | 12 |
|
钠、镁及其化合物 | 6 |
|
|
氯、溴、碘及其化合物 |
| 11 |
|
硫及其化合物 | 7 |
|
|
元素周期律与元素周期表 | 8 | 16 |
|
微粒间的作用力与物质多样性 | 9,10 |
|
|
综合应用 |
| 13,14 | 18,20 |
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( B )
A.蒸馏 B.升华 C.蒸发 D.萃取
解析:砒霜样品受热,其有效成分三氧化二砷变成蒸气(升华),降温,蒸气凝华成固体,从而达到分离提纯砒霜的目的。
2.下列关于物质分类的说法正确的是( A )
A.烟、云、雾都属于胶体
B.氯化铵、次氯酸都属于强电解质
C.SO2、SiO2、CO均为酸性氧化物
D.胶体区别于其他分散系的本质原因是丁达尔效应
解析:烟、云、雾都属于胶体,A正确;次氯酸属于弱电解质,B错误;CO为不成盐氧化物,C错误;胶体区别于其他分散系的本质原因是分散质粒子直径大小,D错误。
3.用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是( A )
A.常温常压下,1.6 g臭氧中含有6.02×1022个氧原子
B.标准状况下,2.24 L水中含有6.02×1022个水分子
C.2.24 L氨气分子中含6.02×1023个电子
D.2.4 g金属镁变为镁离子时失去6.02×1022个电子
解析:A项,n(O3)== mol,n(O)=0.1 mol,故含有6.02×1022个氧原子;B项,标准状况下,水不是气体;C项,没有说明在标准状况下,NH3的物质的量不能确定;D项,2.4 g Mg变为Mg2+,失去2×6.02×
1022个电子。
4.已知常温下,溶液中能发生如下反应:①2R-+Z2R2+2Z-;②16H++
10Z-+2X2X2++5Z2+8H2O;③2M2++R22M3++2R-。由此判断,下列说法中正确的是( D )
A.Z2+2M2+2M3++2Z-不可以进行
B.Z元素在①②反应中都发生还原反应
C.反应②中X是还原剂,X2+是还原产物
D.各粒子氧化性由强到弱的顺序是X>Z2>R2>M3+
解析:反应①中,氧化性Z2>R2,还原性Z-<R-;反应②中,氧化性X>Z2,还原性X2+<Z-;反应③中,氧化性R2>M3+,还原性R-<M2+;则氧化性强弱顺序是X>Z2>R2>M3+,还原性强弱顺序为X2+<Z-<R-<M2+。根据还原性Z-<M2+,常温下可发生反应Z2+2M2+2M3++2Z-,A错误;反应②中,Z元素化合价升高,被氧化,发生氧化反应,在反应①中,Z元素化合价降低,被还原,发生还原反应,B错误;反应②中,X作氧化剂,C错误;由上述分析可知,氧化性强弱顺序是X>Z2>R2>M3+,D正确。
5.下列反应的离子方程式正确的是( B )
A.用稀盐酸除水垢中的碳酸钙:
Ca2++C+2H+Ca2++H2O+CO2↑
B.用稀盐酸除水垢中的氢氧化镁:
Mg(OH)2+2H+Mg2++2H2O
C.用碳酸氢钠作为抗酸药中和胃酸:
2H++CH2O+CO2↑
D.用H2SO4中和碱性废水:
H2SO4+2OH-2H2O+S
解析:用稀盐酸除水垢中的碳酸钙:CaCO3+2H+Ca2++H2O+CO2↑,故A错误;用稀盐酸除水垢中的氢氧化镁:Mg(OH)2+2H+Mg2++2H2O,故B正确;用碳酸氢钠作为抗酸药中和胃酸:H++HCH2O+CO2↑,故C错误;用H2SO4中和碱性废水:H++OH-H2O,故D错误。
6.下列关于Na2O和Na2O2的说法正确的是( C )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在与CO2的反应中既是氧化剂又是还原剂
D.Na2O2与足量水反应时,1 mol Na2O2转移2 mol电子
解析:A项,Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,不是碱性氧化物;B项,Na2O2是淡黄色固体;D项, Na2O2与H2O反应时,Na2O2中-1价的O变成了-2价的O和0价的O,故
1 mol Na2O2转移1 mol电子。
7.下列关于硫及其化合物的说法正确的是( D )
A.浓硫酸具有脱水性,可用于干燥氨气
B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有S
C.二氧化硫能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
D.如图装置中血红色褪去,可以验证SO2的还原性
解析:浓硫酸具有酸性,不可用于干燥氨气,A错误;加氯化钡溶液有白色沉淀产生,可能是钡盐沉淀,也可能是氯盐沉淀,加入盐酸不溶解,不能说明一定有S,B错误;二氧化硫具有还原性,能跟溴水、酸性高锰酸钾溶液发生氧化还原反应而使其褪色,不是漂白性,C错误;硫酸铁溶液遇KSCN溶液变为血红色,通入二氧化硫,发生反应:SO2+
2Fe3++2H2OS+2Fe2++4H+,血红色褪去,证明SO2具有还原性,D正确。
8.下列关于金属铷的说法不正确是( D )
A.金属铷与氧气反应,能够生成复杂的氧化物
B.金属铷与水剧烈反应,可能会发生爆炸
C.金属铷的密度大于钠,故可保存在煤油中
D.铷的最高价氧化物对应的水化物难溶于水
解析:金属铷为第五周期ⅠA族元素,金属性较强,与钠性质相似。金属铷与氧气反应,反应条件不同,产物不同,能够生成复杂的氧化物,A正确;金属铷金属性较强,与水剧烈反应,可能会发生爆炸,B正确;金属铷的密度大于钠,且不与煤油反应,故可保存在煤油中,C正确;铷的最高价氧化物对应的水化物为强碱,易溶于水,D错误。
9.下列说法正确的是( D )
A.石英、金刚石、冰都是通过共价键形成的共价晶体
B.干冰气化时吸收的热量用于克服分子内碳、氧原子间的作用力
C.氯化氢和氯化钠溶于水都能电离出Cl-,所以氯化氢和氯化钠均是离子化合物
D.CO2和H2O分子中氧原子的最外电子层都具有8电子的稳定结构
解析:冰属于分子晶体,A错误;干冰气化时只破坏分子间作用力,B错误;HCl属于共价化合物,C错误;根据CO2和H2O的电子式可知,氧原子的最外电子层都达到了8电子稳定结构,D正确。
10.关于化学键的各种叙述中,下列说法正确的是( B )
A.在离子晶体中,只存在离子键
B.共价化合物中,一定不存在离子键
C.仅由非金属元素形成的化合物中不可能有离子键
D.由不同种元素组成的多原子分子里,一定只存在极性键
解析:离子晶体中可能存在共价键,如NaOH为离子晶体,晶体中存在离子键、共价键,A错误;含离子键的化合物一定为离子化合物,在共价化合物中一定不存在离子键,B正确;仅由非金属元素形成的化合物可能为离子化合物,含有离子键,如氯化铵等铵盐都是由非金属元素组成的离子化合物,C错误;由不同种元素组成的多原子分子里,一定存在不同非金属元素之间的极性键,也可能存在非极性键,如过氧化氢分子(H—O—O—H)中存在极性键和非极性键,D错误。
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分)
11.漂白粉和漂粉精是常用的消毒清洁用品,有效成分均为Ca(ClO)2,相应的生产流程如下。
下列说法错误的是( AD )
A.①中电解饱和食盐水制氯气的过程中,没有元素化合价发生变化
B.②中反应的化学方程式为2Cl2+2Ca(OH)2Ca(ClO)2+CaCl2+2H2O
C.④中反应:Cl2O+H2O2HClO,氯元素的价态未发生改变
D.制备漂粉精过程中,Cl2转化为Ca(ClO)2时,Cl的原子利用率为100%
解析:饱和食盐水通电电解得到氯气,氯气与石灰乳反应生成氯化钙和次氯酸钙,干燥后即得漂白粉;氯气与湿润的碳酸钠反应得到Cl2O气体,溶于水得到HClO,次氯酸再与石灰乳反应得到次氯酸钙,干燥后即为漂粉精。①中氯元素由化合态变为游离态,一定有元素化合价的变化,A错误;②中反应为氯气与石灰乳的反应,生成氯化钙、次氯酸钙和水,化学方程式为2Cl2+2Ca(OH)2Ca(ClO)2+CaCl2+2H2O,B正确;Cl2O和HClO中氯元素的化合价均为+1价,C正确;氯气与湿润的碳酸钠反应时发生的是歧化反应:2Cl2+Na2CO3Cl2O+2NaCl+CO2,NaCl中的氯元素没有用于制取漂粉精,氯原子的利用率不是100%,D错误。
12.能正确表示下列化学反应的离子方程式的是( D )
A.氢氧化钡溶液与稀硫酸的反应:OH-+H+H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+Cu2++Ag
D.石灰石溶于稀盐酸中:CaCO3+2H+Ca2++H2O+CO2↑
解析:氢氧化钡溶液与稀硫酸反应生成水和难溶物硫酸钡,反应的离子方程式为Ba2++S+2H++2OH-BaSO4↓+2H2O,A错误;澄清的石灰水中Ca(OH)2全部电离成Ca2+、OH-,其与盐酸反应的离子方程式为OH-+
H+H2O,B错误;铜单质金属活泼性强于银,铜片与硝酸银溶液发生置换反应生成银和硝酸铜,反应的离子方程式为Cu+2Ag+Cu2++2Ag,C错误;石灰石主要成分为碳酸钙,碳酸钙属于难溶盐,其与盐酸反应生成氯化钙、水、二氧化碳,反应的离子方程式为CaCO3+2H+Ca2++ H2O+CO2↑,D正确。
13.已知草酸(H2C2O4)是一种弱酸,157 ℃升华,170 ℃以上分解可放出CO2和CO;可与酸性KMnO4溶液反应;其钠盐易溶于水,钙盐难溶于水。下列说法正确的是( D )
A.草酸受热产生的气体,用足量的NaOH溶液充分吸收后,可收集得到纯净的CO
B.草酸受热产生的气体通过灼热的氧化铜,若出现黑色变红色现象,则说明产生的气体中一定有CO
C.草酸受热产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,则说明产生的气体中一定有CO2
D.H2C2O4与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2Mn+6H+2Mn2++10CO2↑+8H2O
解析:草酸受热产生的气体,用足量的NaOH溶液充分吸收后,收集到的CO还含有水蒸气,不可能得到纯净的CO,A错误;草酸能被酸性高锰酸钾氧化,自身具有还原性,可以还原灼热的氧化铜,所以出现黑色变红色现象,不一定是CO的作用,B错误;草酸受热产生的气体直接通入足量的澄清石灰水中,产生白色浑浊现象,还可能是草酸与氢氧化钙生成草酸钙沉淀,不能说明产生的气体中一定有CO2,C错误。
14.X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( AC )
A.简单阳离子半径R最小
B.M的氢化物常温常压下为气体,分子间无氢键
C.最高价氧化物的水化物的酸性:Z<Y
D.X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
解析:同周期元素原子序数越大,原子半径越小,同主族元素原子序数越大,原子半径越大,根据图中规律得出X、Y、Z、M、R分别为H、C、N、S、Na。氢离子的离子半径最小,A不正确;S的氢化物为H2S,常温常压下为气体,分子间无氢键,B正确;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:C<N,所以酸性:H2CO3<HNO3,C不正确;H与C可以形成C2H4,C2H4为平面形结构的分子,分子中存在极性共价键和非极性共价键,D正确。
15.标准状况下,V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为
c mol·L-1,则下列关系中不正确的是( A )
A.ρ= B.w=
C.w= D.c=
解析:选项A中溶液的体积错误,故A项关系不成立。
三、非选择题(本题共5小题,共60分)
16.(14分)如图是部分短周期元素的常见化合价与原子序数的关系:
(1)元素A在周期表中的位置为 。
(2)用电子式表示D2G的形式过程: ,其所含化学键类型为 。
(3)C2-、D+、G2-半径由大到小的顺序是 (填离子符号)。
(4)C、G的简单氢化物中,沸点较低的是 (填化学式),原因是 。两种气态氢化物的稳定性:C (填“>”或“<”)G。
(5)C与D形成的具有强氧化性的化合物的电子式为 。
解析:由图中化合价可知,A、F的化合价都为+4、-4,两者位于同主族,且F的原子序数较大,故A为C元素、F为Si元素;C的化合价为-2,没有正化合价,故C为O元素;D的化合价为+1,处于第ⅠA族,原子序数大于O元素,故D为Na元素;E的化合价为+3,为Al元素;G的最高正价为+6、最低负价为-2,为S元素;B的化合价有+5、-3,处于第ⅤA族,原子序数介于C、O之间,则B为N元素。
(1)A为C元素,位于周期表中第二周期ⅣA族。
(2)Na2S属于离子化合物,含有离子键。
(3)电子层结构相同时,核电荷数越大,离子半径越小;电子层结构不同时,电子层数越多,离子半径越大,即离子半径:S2->O2->Na+。
(4)H2O分子间存在氢键,所以水的沸点高于H2S;非金属性:O>S,所以H2O的稳定性强于H2S。
(5)C与D形成的具有强氧化性的化合物是Na2O2,Na2O2是由2个Na+与1个]2-通过离子键结合形成的离子化合物,电子式为Na+]2-Na+。
答案:(1)第二周期ⅣA族
(2) 离子键
(3)S2->O2->Na+ (4)H2S 水分子间存在氢键 >
(5)Na+]2-Na+
17.(5分)已知A、B、C、D四种物质的一些物理性质如下表所示。
物质 | A | B | C | D |
分散到水中 | 悬浊液 | 无色溶液 | 液体分层,且下层为无色油状液体 | 无色 溶液 |
熔点/℃ | 1 452 | -21.3 | -11.5 | 801 |
沸点/℃ | 1 703 | 78.9 | 117 | 1 210 |
根据上述信息,回答下列问题:
(1)若已知A与D不发生反应,且均不与水反应。
①欲从A、D的混合物中分离提纯D,需进行的操作:a溶解;b (填操作名称,下同);c 。
②上述a、b、c操作过程中均需用到的一种玻璃仪器为 。
(2)从B的水溶液中分离出B的操作名称为 。
(3)从C与水的混合物中分离提纯C,所需的玻璃仪器有 。
解析:(1)①根据题中信息可知,A不溶于水,D溶于水,因此,欲从A、D的混合物中分离提纯D,首先要进行溶解、过滤,得到D的溶液,再蒸发结晶即可得到D。②溶解、过滤和蒸发结晶操作中都要用到玻璃棒。(2)B与水互溶,但其沸点与水的沸点相差较大,因此可用蒸馏的方法分离。(3)C与水不互溶,因此从C与水的混合物中分离提纯C,可采取分液的方法。分液时需要用到分液漏斗和烧杯。
答案:(1)①过滤 蒸发结晶 ②玻璃棒 (2)蒸馏 (3)分液漏斗、
烧杯
18.(12分)绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。
材料一 《唐本草》和《天工开物》等古籍都记载中国很早就能焙烧绿矾制备铁红(主要成分是Fe2O3)。铁红颜色鲜艳,稳定无毒,是中国传统红色颜料的重要着色剂。
材料二 公元8世纪,阿拉伯炼金家查比尔曾提出,把绿矾焙烧可以蒸馏出“矾精”,它具有比较大的溶解力。绿矾焙烧是一种生产硫酸的古老方法。
(1)某研究性学习小组用如图所示实验装置对绿矾的焙烧反应进行
探究。
①实验过程中,装置A硬质玻璃管中可观察到的实验现象是 。
②装置C的作用是 。
③该小组学生设计如下实验方案验证“矾精”是硫酸溶液:取U形管中的溶液少许于试管中,滴入 (填试剂名称),溶液呈红色,说明“矾精”中含有H+;检验“矾精”中含有S的方法是 。
(2)某工厂计划用绿矾焙烧工艺生产高纯度铁红(Fe2O3)160 kg,计算理论上所需绿矾的质量为 。
解析:(1)①焙烧绿矾制备铁红(主要成分是Fe2O3),实验过程中,装置A硬质玻璃管中可观察到的实验现象是绿色晶体变成红棕色粉末。②在空气中加热绿矾,会生成二氧化硫,二氧化硫会污染空气,不能任意排放,所以装置C的作用是吸收二氧化硫,防止污染空气。③检验氢离子用紫色石蕊试液,溶液变红色;检验“矾精”中含有S的方法是取U形管中的溶液少许于试管中,滴加稀盐酸,没有现象,再加入氯化钡溶液,如果有白色沉淀生成,说明含有S。
(2)利用铁原子守恒得:m(绿矾)=×2×M(绿矾)=×
2×278 g/mol=556 kg。
答案:(1)①绿色晶体变成红棕色粉末 ②吸收尾气SO2,防止污染环境 ③紫色石蕊试液 取U形管中的溶液少许于试管中,滴加稀盐酸,没有现象,再加入氯化钡溶液,如果有白色沉淀生成,说明含有S
(2)556 kg
19.(16分)将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g· mL-1。
(1)该溶液中NaOH的物质的量浓度为 。
(2)该溶液中NaOH的质量分数为 。
(3)从上述溶液中取出10 mL,其中NaOH的物质的量浓度为 ,
NaOH的质量分数为 ,溶液的密度为 ,含NaOH的质量为 ,含NaOH的物质的量为 。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为 。
解析:(1)n(NaOH)==0.61 mol,c(NaOH)===
6.1 mol·L-1。
(2)100 mL NaOH溶液的质量为100 mL×1.219 g· mL-1=121.9 g。w(NaOH)=×100%≈20%。
(3)从原溶液中取出10 mL溶液,其中物质的量浓度、质量分数、密度均不会改变,但所含NaOH的质量、物质的量均变为原来的。
(4)这10 mL NaOH溶液的物质的量浓度为6.1 mol·L-1,稀释到100 mL以后,NaOH的物质的量浓度缩小为=0.61 mol·L-1。
答案:(1)6.1 mol·L-1
(2)20%
(3)6.1 mol·L-1 20% 1.219 g· mL-1 2.44 g 0.061 mol
(4)0.61 mol·L-1
20.(13分)消毒剂在生产、生活中有极其重要的作用,开发具有广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是 (填字母)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业废液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2OA+NH3↑,则生成物A的化学式为 ,H2O2被称为“绿色氧化剂”的理由是 。
(3)漂白剂亚氯酸钠(NaClO2)在常温下于黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数约为 。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是 (用离子方程式表示)。
利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式: 。
解析:(1)1 mol Cl2、H2O2、ClO2、O3转移的电子依次为1 mol、1 mol、5 mol、2 mol,因此等物质的量的上述物质,ClO2的消毒效率最高。
(2)根据元素守恒原理,可知反应KCN+H2O2+H2OA+NH3↑,A为KHCO3。过氧化氢作氧化剂,还原产物是水,没有污染。
(3)该反应为歧化反应,HClO2中的氯元素+3价一部分升高到ClO2中的+4价,一部分降到-1价,当有1 mol ClO2生成,转移1 mol电子,电子数约为6.02×1023。
(4)原因是Cl-+ClO-+2H+H2O+Cl2↑。化学方程式为2NaOH+Cl2NaCl+NaClO+H2O。
答案:(1)C
(2)KHCO3 过氧化氢作氧化剂,还原产物是水,没有污染
(3)6.02×1023
(4)Cl-+ClO-+2H+H2O+Cl2↑ 2NaOH+Cl2NaCl+NaClO+H2O
江苏专版2023_2024学年新教材高中化学模块综合测评苏教版必修第一册: 这是一份苏教版 (2019)必修 第一册本册综合复习练习题,共14页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
苏教版必修一 化学 模块综合试卷(含答案)—2023-2024学年(苏教版2019)高中化学必修1: 这是一份高中化学苏教版 (2019)必修 第一册本册综合同步测试题,共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
苏教版高中化学选择性必修2模块综合测评含答案: 这是一份苏教版高中化学选择性必修2模块综合测评含答案,共18页。