






2020-2021学年第2节 共价键与分子的空间结构教学ppt课件
展开学习任务一 分子中的原子排布与对称性任务驱动: 雪花和树叶的对称性与构成它的微粒有关吗?微粒也是对称的吗? 1.对称分子(1)内涵依据_______的旋转或借助_______的反映能够复原的分子。(2)性质具有_____性。
(3)与分子性质的关系分子的_____、旋光性及_____性质等都与分子的对称性有关。2.手性分子(1)手性一种分子和它在镜中的像,就如同人的左手和右手,相似而不完全相同,即它们不能_____。(2)手性分子具有_____的分子,一个手性分子和它的镜像分子构成一对对映异构体。(3)手性碳原子___个不同的原子或基团连接的碳原子。
(4)应用①手性分子缩合制_______和核酸。②分析药物有效成分异构体的活性和_____作用。③药物的_______合成。【想一想】手性分子具备的条件是什么?手性分子和它的镜像分子的关系是什么?提示:分子中含有同时连接四个不同原子或原子团的原子,如A原子: 。手性分子和它的镜像分子互为同分异构体。
学习任务二 分子中的电荷分布与极性任务驱动: 分子的极性跟共价化学键的极性有什么关系?
1.分子极性的实验探究
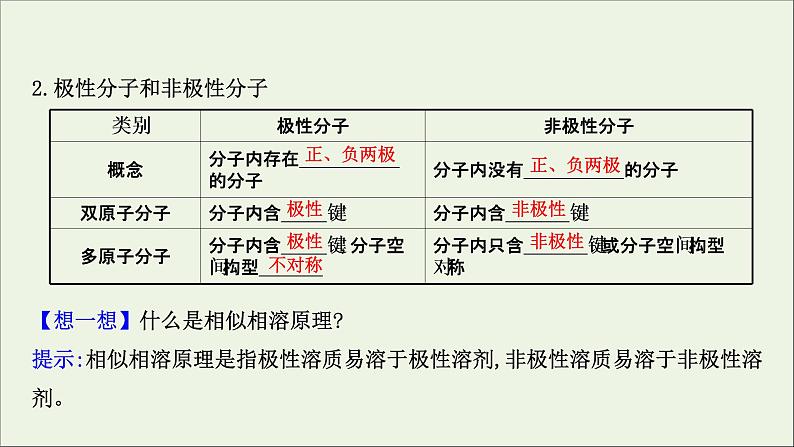
2.极性分子和非极性分子【想一想】什么是相似相溶原理?提示:相似相溶原理是指极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。
3.分子极性的判断(1) (2)
【想一想】(1)双原子形成的分子一定是非极性分子吗?提示:不是。两个原子形成的单质一定是非极性分子,但是由两个原子形成的化合物分子一定是极性分子。(2)极性分子的电荷分布不均匀,非极性分子的电荷分布是均匀的吗?提示:是。非极性分子的空间结构对称,因此电荷分布均匀,因此不显极性;极性分子的空间结构不对称,因此电荷分布不均匀,显示极性。
【做一做】(1)下列分子为手性分子的是________。 答案:B
(2)用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示,据此分析,A、B两种液体分子的极性情况是________。 答案:A是非极性分子,B是极性分子
探究任务一 手性和手性分子 图片情境 观察以下手性分子和它的镜像:
【问题探究】1.有人说“手性分子和镜像分子完全相同,能重合”,对吗?二者什么关系?提示:手性分子,是化学中结构上镜像对称而又不能完全重合的分子。一个手性分子和它的镜像分子拥有完全一样的物理、化学性质。但是从分子的组成形状来看,它们依然是两种分子。这种情形像是镜子里和镜子外的物体那样,看上去互为镜像。由于是三维结构,它们不管怎样旋转都不会重合,就像左手和右手那样,称这两种分子具有手性,又叫手性分子。因此一个手性分子和它的镜像分子互为同分异构体。2.构成不对称碳原子的条件是什么?提示:与碳原子连接的四个原子或基团均不相同。
【探究总结】分子是否表现手性的判断方法分子表现手性,是因为其含有不对称碳原子。如果一个碳原子所连接的四个原子或基团各不相同,那么该碳原子称为不对称碳原子,用*C来表示。例如 ,R1、R2、R3、R4是互不相同的原子或基团。所以,判断一种有机物分子是否具有手性,就看其是否含有不对称碳原子。
【探究训练】下列分子含有“手性”碳原子,属于手性分子的是( ) 【解析】选C。抓住“手性”的含义,碳原子上连接有四个不同的原子或原子团,即为手性碳原子。
探究任务二 分子极性的判断实验情境用酸式滴定管分别盛装CCl4和H2O,打开活栓,让CCl4和H2O慢慢流下如线状。把摩擦带电的玻璃棒分别接近CCl4和H2O流,四氯化碳不偏转,而水流偏转。
【问题探究】1.本实验现象说明什么问题?提示:证明四氯化碳是非极性分子,而水分子是极性分子。2.如何判断分子的极性?提示:(1)双原子分子的极性:双原子分子的极性取决于成键原子之间的共价键是否有极性,以极性键结合的双原子分子是极性分子;以非极性键结合的双原子分子为非极性分子。由此可知,对双原子分子来说,键的极性与分子的极性是一致的:化学键有极性,分子就有极性;反之,化学键无极性,通常分子也无极性。(2)多原子分子的极性:多原子分子的极性与分子中的键的极性关系比较复杂。如果组成分子的所有化学键均为非极性键,则分子通常为非极性分子。
【探究总结】1.分子的极性与共价键的极性的关系(1)以极性键结合而形成的异核双原子分子都是极性分子,如HCl。(2)以非极性键结合而形成的同核双原子分子都是非极性分子,如Cl2。还有某些同核多原子分子也是非极性分子,如P4,应注意:O3(角形)是极性分子。(3)以极性键结合而形成的多原子分子,既有极性分子,又有非极性分子。
2.分子的极性与分子的空间构型的关系对于复杂的多原子分子来说,如果组成原子相同(如:S8、P4等分子),那么原子间的化学键一定是非极性键。这样的多原子分子无疑是非极性分子(O3分子有微弱的极性,是一个例外)。但是,如果组成原子不相同(如:SO2、CO2、CCl4、CHCl3等),那么分子的极性,不仅决定于元素的键的极性而且还决定于分子的空间构型。分子的空间构型均匀对称是非极性分子,如AB2型的直线形分子CO2;AB3型的平面正三角形分子BF3,AB4型的正四面体形结构分子CH4等。分子的空间构型不对称或中心原子具有孤电子对或配位原子不完全相同的多原子分子为极性分子,如角形的H2O;三角锥形的NH3;不规则四面体分子CH3Cl等。
例如,在SO2和CO2分子中,虽然都有极性键(SO2中有S==O键;CO2中有C==O键),但是,因为CO2分子具有直线形结构,键的极性互相抵消,它的正负电荷重心互相重合,所以CO2是一个非极性分子。相反,SO2分子具有角形结构,键的极性不能抵消,它的正负电荷重心没有重合,因而SO2是一个极性分子。
3.键的极性和分子极性的关系
4.判断ABn型分子是极性分子还是非极性分子可参考以下经验规律:①若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子;②若中心原子有孤电子对(未参与成键的电子对),则为极性分子;若无孤电子对,则为非极性分子。小结:由以下两方面判断分子的极性:
【典例】(双选)已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )A.ABn型分子中A的化合价的绝对值等于A所在的主族序数B.在ABn型分子中A原子没有孤电子对(或A原子最外层电子均已成键)C.在ABn型分子中每个共价键的键长和键能都相等D.分子中所有原子在同一平面内【解题指南】解答本题需要注意以下两点:(1)分子的极性与化学键的极性不一定一致。(2)分子的极性与分子的对称性有关。
【解析】选A、B。CO2、BF3、CH4、SO3中所有电子都参与形成了共价键,中心原子的化合价的绝对值等于所在的主族序数;都不含孤电子对,分子都是对称结构,为非极性分子。H2S、SO2、H2O、NH3都含有孤电子对,分子都是不对称结构,为极性分子。ABn型分子的极性取决于分子的空间构型是否对称,而对称性与分子是否含有孤电子对有关,与其他因素无关。【方法规律】含极性键的多原子分子极性的判断方法空间构型对称:非极性分子;空间构型不对称:极性分子。
【探究训练】下列叙述正确的是( )A.NH3是极性分子,分子中氮原子处在3个氢原子所组成的三角形的中心B.CCl4是非极性分子,分子中碳原子处在4个氯原子所组成的正方形的中心C.H2O是非极性分子,分子中氧原子处在2个氢原子连线的中央D.CO2是非极性分子,分子中碳原子处在2个氧原子连线的中央
【解析】选D。NH3中的氮原子采取sp3杂化,形成三角锥形结构,电荷分布不对称,是极性分子;CCl4分子中C—Cl键为极性键,碳原子采取sp3杂化,且无孤电子对,分子构型为正四面体形,碳原子位于正四面体的中心,是非极性分子;水分子中H—O 键为极性键,氧采取sp3杂化,且有两对孤电子对,分子构型为角形,整个分子电荷分布不对称,为极性分子;CO2分子中碳采取sp杂化,分子构型为直线形,分子为非极性分子,碳原子位于2个氧原子连线的中央。
1.(双选)已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如图所示,则下列判断错误的是( )A.G是最活泼的非金属单质B.L是极性分子C.E能使紫色石蕊试液变红色D.M化学性质活泼
【解析】选C、D。本题主要考查用球棍模型表示物质的方法及氮气、氨气的化学性质等。由组成E、G、L、M分子的元素原子序数均小于10及E为三角锥形分子可知E为NH3,能使紫色石蕊溶液变蓝色;组成L的元素除氢外另一元素为-1价的氟,故G为F2,L为HF,M为N2,故本题答案为C、D。
2.(2020·临沂高二检测) 下列推断中正确的是( )A.含有非极性键的分子不一定是非极性分子B.非极性分子中一定含有非极性键C. 等分子的立体构型都是对称的,它们都是非极性分子D.只含有极性键的分子一定是极性分子
【解析】选A。H2O2分子中含有O—O非极性键,但它是极性分子,A对;CO2分子是非极性分子,但分子中含有极性键,B错;H2O分子中有对称轴但其立体构型是不对称的(四面体的 分子中正负电荷重心不重合),是极性分子,C错;只含有极性键的分子不一定是极性分子,如甲烷,D错。
3.微波炉加热,具有使受热物质均匀、表里一致、速度快、热效高等优点。其工作原理是通电炉内的微波场以几亿的高频改变电场的方向,水分子因而能迅速摆动,产生热效应。这是因为( )A.水分子具有极性共价键 B.水分子中有共用电子对C.水由氢、氧两元素组成D.水分子是极性分子【解析】选D。只有极性分子才能在电场中定向移动,非极性分子几乎不发生定向移动。水分子是由极性键构成的极性分子,故选D。
4.三聚氰胺俗称密胺、蛋白精,是一种致癌物质,由于其含氮百分比高,不法商贩常在奶粉中添加三聚氰胺。关于三聚氰胺( )分子的说法中正确的是( )A.所有氮原子均采用sp3杂化B.一个三聚氰胺分子中共含有15个σ键C.属于极性分子D.三聚氰胺分子中同时含有极性键和非极性键
【解析】选B。三聚氰胺分子中,处于环上的氮原子是sp2杂化,A项错误;由三聚氰胺分子的结构知,它是对称结构,为非极性分子,C项错误;三聚氰胺分子中不存在由同种元素的原子形成的共价键,故不存在非极性键,D项错误。
5.(2020·盐城高二检测)三氯化硼是平面正三角形结构,因此是非极性分子,推断三氯甲烷(碳原子位于分子结构中心)的结构和分子的极性情况是( )A.正四面体,非极性分子 B.平面三角形,非极性分子C.四面体,极性分子 D.平面三角形,极性分子【解析】选C。甲烷为正四面体结构是由于四个碳氢键完全相同且互相排斥,而三氯甲烷(CHCl3)中由于氯原子有较强的吸引电子能力,故C—Cl键中的共用电子对偏向于Cl,使整个分子结构成为变形的四面体结构,因而正负电荷重心不能重合,是极性分子。
6.(改编)白磷可被用作化学武器,其单质是四原子分子,空间结构示意图如图Ⅰ。六氧化四磷(P4O6)和十氧化四磷(P4O10)都是磷的氧化物。
(1)下列说法正确的是(用序号填空)__________。 ①白磷分子中的化学键是非极性键 ②白磷分子中的化学键是σ键 ③白磷分子是非极性分子 ④白磷分子中的键角是90°(2)图Ⅱ是一种磷的氧化物分子的空间结构示意图,它的化学式是__________,该分子__________(填“有”或“无”)极性,主要原因是________________(从分子极性原理的角度进行说明)。
【解析】(1)由题意可知白磷分子的4个磷原子应位于四面体的四个顶点,形成正四面体结构;磷原子之间形成单键,为σ键,也是非极性键;正四面体为对称结构,故为非极性分子;每个面均为正三角形,键角为60°。(2)由图可知白球均形成两条键,黑球形成五条键,故白球为氧,有10个,黑球为磷,有4个,分子式P4O10,由于该分子呈对称结构,故无极性。答案:(1)①②③ (2)P4O10 无 该分子正、负电荷重心重合
7.(2020·潍坊高二检测)有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:(1)写出A、B、C、D、E五种元素的元素符号:A是________,B是________,C是________,D是________,E是________。 (2)D元素在周期表中的位置为__________________________________。
(3)B元素的价电子排布为______________________________________。 (4)元素的电负性的大小关系是B________D(填“>”“<”或“=”),C与E的第一电离能的大小关系是C________E(填“>”“<”或“=”)。 (5)A2D属于________(填“极性”或“非极性”)分子,其分子的空间构型为________,其中所含化学键类型为_______(填“极性键”或“非极性键”)。(6)D、E元素形成的化合物的电子式为______________________________。
鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第4节 分子间作用力教学课件ppt: 这是一份鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第4节 分子间作用力教学课件ppt,共49页。PPT课件主要包含了课前自主学习,相互作用力,小得多,方向性,饱和性,组成和结构,电负性,XHY,共价键,原子半径等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构示范课课件ppt: 这是一份鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构示范课课件ppt,共45页。PPT课件主要包含了内容索引,自主梳理,手性分子,自我检测,问题探究,归纳拓展,应用体验,答案D,答案C等内容,欢迎下载使用。
2021学年微项目 甲醛的危害与去除——利用电负性分析与预测物质性质备课ppt课件: 这是一份2021学年微项目 甲醛的危害与去除——利用电负性分析与预测物质性质备课ppt课件,共41页。PPT课件主要包含了课前自主学习,对称轴,对称面,蛋白质,不对称,发生改变,负两极,非极性,课堂合作探究,课堂素养达标等内容,欢迎下载使用。













