


- 6.1 化学反应与能量变化(第1课时) (课件)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 课件 1 次下载
- 6.1 化学反应与能量变化(第2课时) (课件)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 课件 1 次下载
- 6.2 化学反应速率与限度(第2课时) (课件)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 课件 1 次下载
- 6.2 化学反应速率和限度(第1课时) (课件)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 课件 1 次下载
- 6.1 化学反应与能量变化(第1课时)(练习)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 试卷 2 次下载
人教版 (2019)必修 第二册第一节 化学反应与能量变化备课ppt课件
展开一、原电池电极反应式的书写方法
(3)原子守恒(质量守恒)
(1)得失电子守恒
(1)列物质, 标得失 负极: 还原剂- ne- → 氧化产物 正极: 氧化剂+ne- →还原产物
(2)看环境,配守恒。
注意电解质溶液的酸碱性,以及离子共存问题;如酸性不可以存在OH-,碱性环境不能存在H+、、H2O,以遵循电荷守恒和质量守恒。
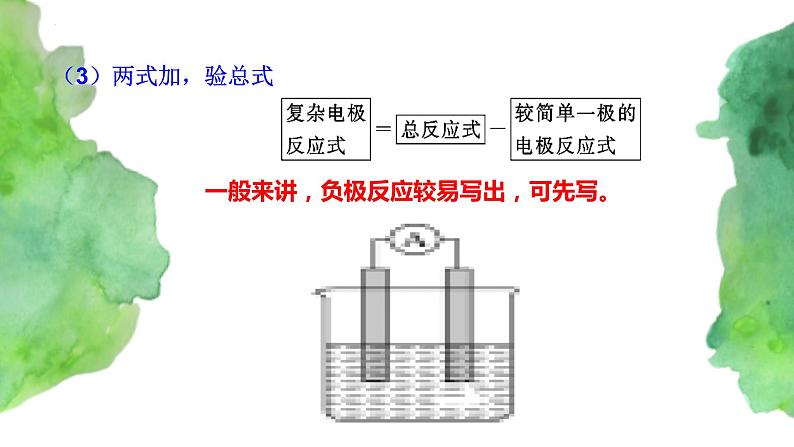
一般来讲,负极反应较易写出,可先写。
Zn+H2SO4=ZnSO4+H2
Zn-2e-=Zn2+
2H++2e-=H2
2Al+6HCl=2AlCl3+3H2
2Al-6e-=2Al3+
6H+6e-=3H2
Cu+2AgNO3=2Ag+Cu(NO3)2
Cu-2e-=Cu2+
2Ag+2e-=2Ag+
Fe+2FeCl3=3FeCl2
Fe-2e-=Fe2+
2Fe3++2e-=2Fe2+
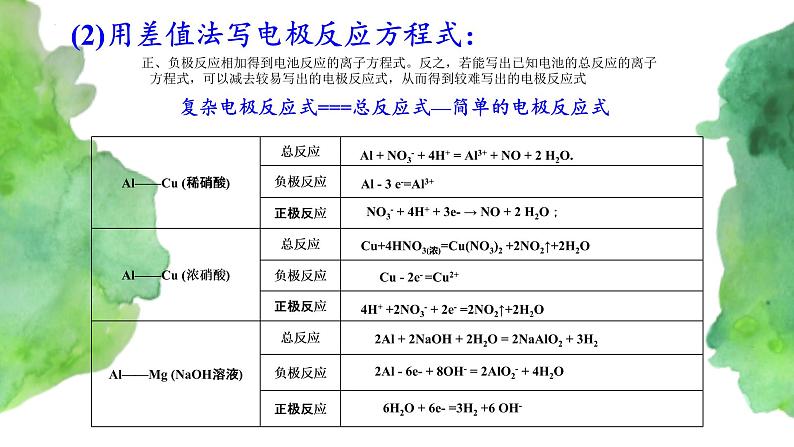
正、负极反应相加得到电池反应的离子方程式。反之,若能写出已知电池的总反应的离子方程式,可以减去较易写出的电极反应式,从而得到较难写出的电极反应式
(2)用差值法写电极反应方程式:
复杂电极反应式===总反应式—简单的电极反应式
Al + NO3- + 4H+ = Al3+ + NO + 2 H2O.
Al - 3 e-=Al3+
NO3- + 4H+ + 3e- → NO + 2 H2O;
Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O
Cu - 2e- =Cu2+
4H+ +2NO3- + 2e- =2NO2↑+2H2O
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
2Al - 6e- + 8OH- = 2AlO2- + 4H2O
6H2O + 6e- =3H2 +6 OH-
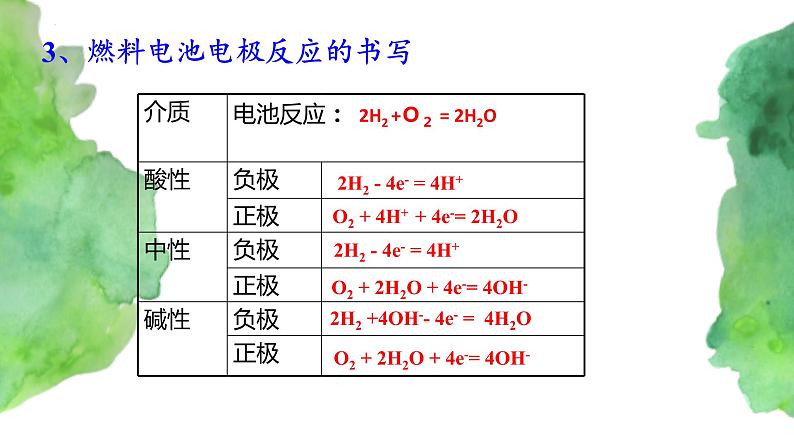
3、燃料电池电极反应的书写
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
O2 + 2H2O + 4e-= 4OH-
2H2 +4OH-- 4e- = 4H2O
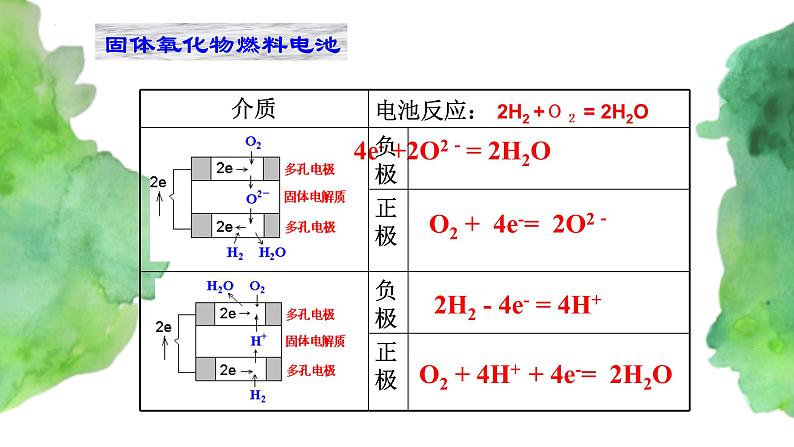
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
O2 + 4H+ + 4e-= 2H2O
3、氢氧燃料电池是符合绿色化学理念的新型发电装置。关于以KOH为电解质的氢氧燃料电池叙述错误的是( ) A、氢氧燃料电池直接把热能转化为电能 B、电子从负极出发,沿导线流向正极 C、负极反应式为H2+2OH--2e- =2H2O D、电解质 KOH的物质的量不发生变化
负极: Zn - 2e- = Zn2+
正极:2MnO2+2NH4++2e- =Mn2O3+ 2NH3+H2O
总反应:Zn+2MnO2+2NH4+=Zn2++ Mn2O3+2NH3+H2O
Zn + 2OH- -2e- =Zn(OH)2
正极:2MnO2 + 2H2O+2e-=2MnOOH+2OH-
(二)二次电池(充电电池或蓄电池):
电解质溶液:H2SO4(aq)
1.放电时电极反应式: 负极:Pb + SO42- -2e-=PbSO4 正极:PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O
负极:C2H5OH+3H2O-12e-=2CO2↑+12H+
正极:3O2+6H2O+12e-=12OH-
正极:3O2+12H++12e-=6H2O
负极:C2H5OH +16OH--12e-=2CO32-+11H2O
C2H5OH +3O2+4OH-=2CO32-+5H2O
C2H5OH+3O2=2CO2+3H2O
负极:CH4+2H2O-8e-=CO2+8H+
正极:2O2+4H2O+8e-=8OH-
正极:2O2+8H++8e-=4H2O
负极:CH4+10OH--8e-=CO32-+7H2O
CH4+2O2=CO2+2H2O
CH4+2O2+2OH-=CO32-+3H2O
总反应: 2CO+O2=2CO2
正极:O2+2CO2+4e-=2CO32-
负极:2CO+2CO32--4e-=4CO2;
高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质备课课件ppt: 这是一份高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质备课课件ppt,共21页。PPT课件主要包含了分子式,C2H4O2,结构简式,结构式,官能团,乙酸的结构,乙酸的物理性质,NaHCO3,澄清石灰水,探究乙酸的弱酸性等内容,欢迎下载使用。
人教版 (2019)必修 第二册第七章 有机化合物实验活动9 乙醇、乙酸的主要性质备课课件ppt: 这是一份人教版 (2019)必修 第二册第七章 有机化合物实验活动9 乙醇、乙酸的主要性质备课课件ppt,共20页。PPT课件主要包含了烃的衍生物,对点训练1,物理性质,对点训练2,乙醇的化学性质,实验现象,实验结论,微点拨,乙醇的氧化反应,①实验探究等内容,欢迎下载使用。
人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课ppt课件: 这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课ppt课件,共19页。PPT课件主要包含了可逆反应的特点,可逆反应的定义,对点训练1,典型的可逆反应有,微点拨,保持一定,化学平衡的移动,对点训练2,直接标志,①同种物质等内容,欢迎下载使用。














