





初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子示范课ppt课件
展开复习1.原子的特性;2.整个原子不显电性的原因;
原子是构成物质的一种微粒,可直接构成某些物质;原子可以构成分子;原子是化学变化中最小的微粒;原子的质量和体积都很小;原子是不断运动的。
同一原子中,其原子核里的质子数和核外电子数相等,所带的电量相等且电性相反;因此,整个原子不显电性。
3.金属原子、非金属原子的特点。
金属原子:最外层的电子一般少于4个,反应中容易失去电子;非金属原子:非金属原子最外层的电子一般多于4个,反应中容易得到电子。
思考:金属原子在化学反应中失去电子、非金属原子在化学反应中得到电子,它们还会电性吗?它们还是原子吗?
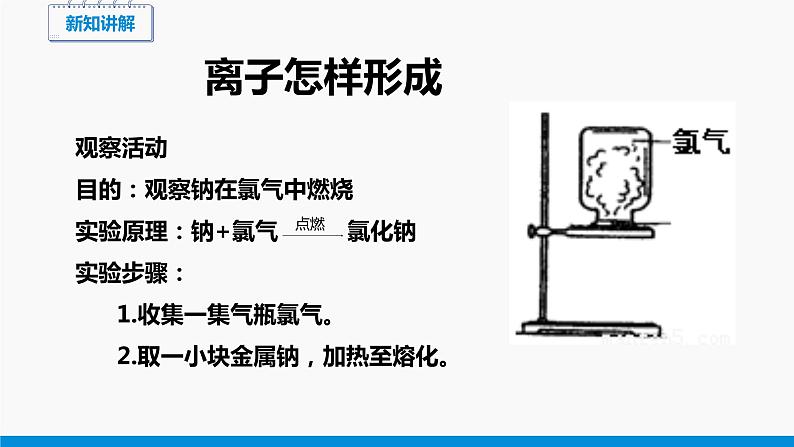
观察活动目的:观察钠在氯气中燃烧实验原理:钠+氯气 氯化钠实验步骤: 1.收集一集气瓶氯气。 2.取一小块金属钠,加热至熔化。
3.把装满氯气的集气瓶倒扣在加热至熔化的金属钠上。注意观察现象。
结论:金属钠在氯气中燃烧,生成氯化钠固体。
实验现象:金属钠剧烈燃烧,产生大量白烟
解释:实验中产生的白烟实际上是一种白色的固体小颗粒。这种物质的名称叫氯化钠(NaCl),就是食盐的主要成分。
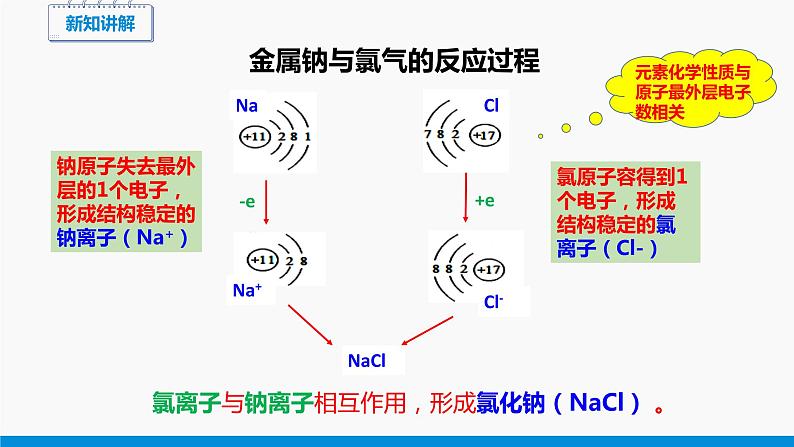
氯离子与钠离子相互作用,形成氯化钠(NaCl) 。
金属钠与氯气的反应过程
钠原子失去最外层的1个电子,形成结构稳定的钠离子(Na+)
氯原子容得到1个电子,形成结构稳定的氯离子(Cl-)
离子的形成 在化学变化中,一些原子容易失去电子形成“成最外层8电子”的稳定结构,另一些原子容易的得到电子形成最外层8电子”的稳定结构。这些带有电荷的、结构稳定的微粒,我们称之为离子。
氢离子: 氧离子: 镁离子: 硫离子:
阅读教材,思考:1.离子的特点。2.什么是阴离子?什么是阳离子?3.原子与离子的区别与联系。4.分子、原子、离子的关系。
离子的特点: 1.离子是构成物质的一种微粒; 2.离子整体显电性; 3.离子的质量和体积都很小; 4.离子是不断运动的。
离子与原子的区别与联系
原子和离子都由原子核与核外电子构成,质量和体积都很小,都在不停的运动,都有一定的间隔,都是构成物质的一种微粒。
原子得失电子后,形成离子。
分子、原子、离子的关系: (1) 分子、原子、离子都是构成物质的微粒 (2)分子由原子构成 (3) 原子得失电子后形成离子
1.结合金属钠与氯气的反应,完成下列内容:(1)金属钠是由什么微粒组成的? 。(2)氯气是由什么微粒组成的? 。(3)在反应中, 失去电子形成阳离子, 失去电子形成阳离子,阴阳离子相互作用结合成 。
初中科粤版第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子授课ppt课件: 这是一份初中科粤版第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子授课ppt课件,共22页。PPT课件主要包含了原子内部结构,道尔顿,卢瑟福,汤姆逊,原子内部的奥秘,原子核,原子结构示意图,镁原子,电子层,质子数等内容,欢迎下载使用。
初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子背景图ppt课件: 这是一份初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子背景图ppt课件,共17页。PPT课件主要包含了温故知新,分子由原子构成,原子是什么,实验加热氧化汞,氧化汞,砖红色固体粉末,HgO,什么是原子,没有新物质生成,生成了新物质等内容,欢迎下载使用。
初中科粤版第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子评课ppt课件: 这是一份初中科粤版第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子评课ppt课件,文件包含第2课时原子的结构pptx、卢瑟福原子模型标清mp4、道尔顿“原子论”模型简介视频-_标清mp4等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。













