





初中化学粤教版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子课文内容课件ppt
展开1.“清明插柳,端午插艾”。艾的茎、叶含有挥发性芳香油,可驱蚊虫、净化空气。下列说法错误的是( )A.艾草所含物质性质决定其的用途B.芳香油挥发过程发生的是化学变化C.闻到艾香是因为艾香的分子不断运动D.芳香油的分子保持其成分的化学性质
2.“不经一番寒彻骨,怎得梅花扑鼻香”,从微观角度分析,诗人能闻到梅花香气的主要原因是( )A.分子的体积和质量都很小 B.分子间有一定的间隔C.分子在不断地运动 D.分子可以再分
3.保持水化学性质的微粒是( )A.氢原子 B.氧分子 C.水分子D.水原子
4.用微粒的观点回答:(1)1滴水中大约有1.67×1021个水分子,说明 。(2)用警犬搜救地震中被埋人员,说明 。(3)氢气和液氢都可以做燃料,说明 。(4)水由液态变为气态的过程中,发生改变的是 。
【复习回顾】上节课我们知道分子是构成物质的一种微粒,不同的分子构成的物质也不同。那么分子是由什么构成的?还能不能再分呢?
实际上,分子还可以分成更小的粒子,这种粒子就是——原子。
原子是什么?它与分子有何不同呢?
到了近代,科学家在实验探究的基础上,发展出近代原子学说,并逐渐认清了原子与分子之间的关系。
原子的概念最初是由古代哲学家提出来的,他们设想的原子是构成万物的不可分割的微粒。
现在,让我们通过化学变化的一些实际例子,来说明这种关系。
将红色粉末氧化汞装在试管里加强热,你能观察到什么现象?
红色粉末逐渐变化,试管内壁上出现银光闪闪的液体,并能收集到能使带火星木条复燃的气体。
思考:在化学变化中,反应物氧化汞的分子发生了怎样变化?构成汞分子的原子又继续发生了什么变化?
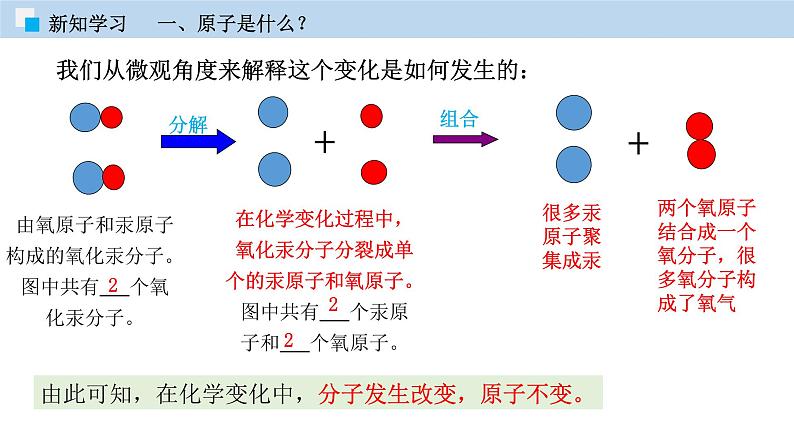
我们从微观角度来解释这个变化是如何发生的:
由氧原子和汞原子构成的氧化汞分子。图中共有 个氧化汞分子。
在化学变化过程中,氧化汞分子分裂成单个的汞原子和氧原子。图中共有 个汞原子和 个氧原子。
两个氧原子结合成一个氧分子,很多氧分子构成了氧气
由此可知,在化学变化中,分子发生改变,原子不变。
1.在化学变化中,氧化汞分解生成了汞原子和氧原子。也就是说氧化汞分子是由汞原子和氧原子构成的。即分子是由原子构成。
3.汞原子和氧原子本身在化学变化中没有变化,只是组合方式发生了改变,他们重新组合后形成新物质。所以,原子是化学变化中的最小微粒。
2.汞原子直接构成了金属汞。所以有的物质可以直接由原子构成。
由原子直接的物质分为三类:
如:氦气、氖气、氩气等
分子和原子的本质区别是___________________
在化学变化中,分子可再分,原子不可再分
分子和原子有什么相同之处吗?
a.跟分子一样,原子也在不断运动着。
b.原子的体积和质量都非常小。小到1在1cm的长度上可以并排约1亿个原子。
即使这么小的原子,科学家也能用STM(扫描隧道显微镜)等现代技术观察到原子的图像。
用STM获得的石墨中碳原子的图像
分子与原子的区别和联系:
体积小、质量小、不停地运动、微粒之间有间隔
化学变化中的最小粒子
化学变化中分子可以再分,而原子不能再分
保持物质化学性质的最小粒子
直接由相应的个原子构成
【练一练】有关原子的说法不正确的是( ) A.原子可以构成分子 B.化学变化中原子重新组合 C.原子可以直接构成物质 D.原子是最小的微粒
【练一练】下图是氧化汞分解的示意图,下列各说法正确的是( )
在化学变化中原子不可再分,是化学变化的最小粒子,那么原子在任何时候都不可再分吗?
为揭开原子的内部结构,科学家进行了长期的科学研究。
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
二、原子内部有何奥秘?
1897年,汤姆森在原子内部发现了带负电电子,摧毁了“原子不可再分”的观点,并建立了新的原子结构模型--“枣糕模型”。
“枣糕模型”认为,原子是一个平均分布着正电荷的圆球状粒子,而带负电荷的电子像一粒粒葡萄干一样镶嵌其中,中和了正电荷,从而形成了中性原子。
1911年,卢瑟福通过精密的实验证明在原子中心有一个带正电的极小的核,电子在一个很大的空间绕核做高速旋转。
即原子的内部结构如下:
1个质子带1个单位的正电荷
(1个电子带1个单位负电荷)
【练一练】下列关于原子的叙述中,正确的是( ) A.原子由电子和质子构成的 B.原子由电子和中子构成的 C.原子由质子和中子构成的 D.原子由原子核和核外电子构成的
【练一练】如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是( )
A.原子、原子核、核外电子B.原子核、原子、核外电子C.原子、核外电子、原子核 D.核外电子、原子核、原子
通过下表,你能得出哪些结论?
结论1:在同一个原子中,核电荷数_____质子数。
结论2:在同一个原子中,质子数_____核外电子数。
结论3:在同一个原子中,质子数_____________中子数。
结论5:原子中不一定含有中子,如 。
结论4:不同的原子的质子数和核外电子数均 。
根据刚才的判断我们可以得到:1.在同一个原子中,核电荷数=__________=__________;2.在同一个原子中,质子数_____________中子数;
同一原子中,原子核中带正电的_____和核外带负电的________,所带的电量 且电性________,故整个原子不显电性。
4.原子中不一定含有中子,如氢原子;
3.不同种类的原子,其根本区别在于它们核内 的不同。
【练一练】下列关于原子结构的说法正确的是( )A.所有原子的原子核中都一定含有质子和中子B.原子核外,能量高的电子在离核近的区域里运动C.具有稳定结构的原子,最外层上的电子数一定为8D.原子中,质子数和中子数不一定相等
【练一练】钛被称为“航空金属”,国产C919大飞机的钛合金用量达到9.3%.已知一种钛原子核内有22个质子和26个中子,该原子的核外电子数为( )A.22B.26 C.48 D.4
在原子中,原子核的体积非常小,核外电子在核外有相对较大的运动空间,电子在核外的空间里做高速的运动。电子在核外的排布会有什么特点?
排布特点1:电子在核外是分层排布的
电子从离核最近(能量最低)的一层开始排,这层为第一层,排满第一层再排第二层,依次类推为三、四、五、六、七层,离核最远的也叫最外层。
三、核外电子的排布规律
排布特点2:各电子层上最多排2n2个电子;其中第一层最多排2个电子,最外层最多排8个电子。
为了更简明、方便地表示原子的内部结构,科学家们设计了原子结构示意图。
当原子的最外层电子数为8(只有一个电子层时有2个电子)时的结构,属于相对稳定的结构,元素化学性质相对稳定。
画出1-20号元素原子结构示意图,并判断这些结构是不是稳定结构?
金属原子:最外层电子数一般少于4个,为不稳定结构
非金属原子:最外层电子数一般等于或多于4个(氢原子特殊),属于不稳定结构
稀有气体原子:最外层电子数等于8个(氦原子除外,最外层电子数为2),为稳定结构
【练一练】高纯硅是制造手机、电脑等电子产品芯片的重要材料。硅的原子结构示意图如图,其中说法错误的是( )
A.第一层有2个电子 B.共有三个电子层C.硅的相对原子质量为14 D.硅原子不易得失电子
最外层的电子数不为8的原子,在化学反应中容易得到或者失去电子,趋于变成稳定结构。当原子得到或失去电子之后便变为离子。
观察金属钠在氯气中的燃烧
【实验2-8】把装满氯气的集气瓶倒扣于加热至熔化的金属钠上,观察现象。
钠燃烧,发出黄色火焰并生成白烟
【注意】这里生成的白烟实际上是NaCl固体小颗粒,是食盐的主要成分。
氯原子和钠原子如何形成的氯化钠呢?
在上述过程中,钠原子因失去l个电子而带上1个单位的正电荷;氯原子因得到1个电子而带上1个单位的负电荷。 像这种 叫做离子。其中 叫做阳离子,如钠离子(Na+); 叫做阴离子,如氯离子(CI-)。
如何判断某结构是离子结构和还是原子结构?
·原子不带电,核电荷数=核外电子数;·离子带电,即离子的质子数≠电子数, 当质子数大于电子数时为阳离子,当质子数小于电子数时为阴离子。
【练一练】下列结构中属于原子结构的是 ,属于阳离子的是 ;属于阴离子的是 。
【练一练】关于氯化钠的说法正确的是( )A.Na+的最外层的电子数为1 B.Cl﹣的结构示意图为
C.Na+和Cl﹣靠静电作用结合成NaCl D.Na+和Cl﹣都是带电的,因此氯化钠也带电
【练一练】下列关于徽观粒子的说法,正确的是( )A.带电的粒子一定是离子B.在干冰中,分子因相互作用而静止不动C.所有原子都由原子核和核外电子构成D.并不是所有分子都是由原子构成的
氯化钠是由极多的钠离子和氯离子相互结合生成的物质,即离子也是构成物质的基本微粒。
【练一练】下列关于分子、原子、离子的说法不正确的是( )A.二氧化碳、水、氨气都是由分子构成的物质B.氯化钠、硫酸铜、硝酸钾都是由离子构成的物质C.铁、铜、汞等金属单质都是由原子构成的物质D.氧气、白磷、金刚石等非金属单质都是由分子构成的物质
【练一练】下列粒子中,不能直接构成物质的是( )A.原子B.分子C.离子D.电子
原子很小,但仍然具有一定的质量,而且不同原子的质量各不相同。在原子中,整个原子的质量几乎都集中在原子核上。每个质子和每个中子的质量几乎相等,都大约等于l个氢原子的质量,而电子的质量仅仅约等于质子质量的1/1836。那么,原子的质量又有多大呢?
一个氢原子的质量是:0.00000000000000000000000000167千克 即1.67×10-27千克一个碳原子的质量是:0.00000000000000000000000001993千克 即1.993×10-26千克一个氧原子的质量是:0.00000000000000000000000002657千克 即2.657×10-26千克
原子的质量很小,记忆、计算都很不方便,怎么办?
五、原子的质量有多大?
为更方便地书写和使用原子的质量,国际上采用相对质量,即以一种碳原子(核内有6个质子和6个中子)质量的1/12为标准,其它原子的质量与它相比较得到的比值,作为这种原子的相对原子质量。
例:氢原子的相对原子质量=
1.67×10-27kg
1.661×10-27kg
氧原子的相对原子质量=
2.657×10-26kg
(1)相对原子质量不是原子的真实质量;
(2)相对原子质量是个比值,单位为1,一般不写;
(3)相对原子质量与原子的真实质量成正比。
结论:相对原子质量≈ + 。
【练一练】我国研制新型环保磁制冷冰箱,钆(Gd)是所需的重要材料。钆元素相对原子质量为157,核电荷数为64,则该原子核外电子数为( ) A.64 B.57 C.93 D.128
【练一练】考古学家通过C﹣14测定法将我省宁波地区的文明发展史推到距今8000多年前。C﹣14原子的核电荷数为6.相对原子质量为14,则该原子核外电子数为( )A.6 B.8C.14 D.20
1.分子是由原子构成。
3.原子是化学变化中的最小微粒。
2.原子可以直接构成物质。
a.原子也在不断运动着。
b.原子的体积和质量都非常小。
(每个质子带1个单位正电荷)
(每个电子带1个单位负电荷)
核电荷数=质子数=核外电子数
三、核外电子的分层排布
质子数(核电荷数)
(1)电子在核外是分层排布的。
电子从离核最近的一层开始排。
(2)各电子层上最多排2n2个电子, 其中第一层最多排2个电子,最外层最多排8个电子。
3.相对原子质量=质子数+中子数
1.定义:以碳-12原子的质量的1/12为标准,其它原子的质量跟它的比值。
(1)定义:带电的原子。
阳离子(带正电荷)如:Na+
阴离子(带负电荷)如:Cl-
(3)判断:质子数≠电子数
(4)离子是构成物质的一种粒子。
1.下列关于分子和原子的叙述中,不正确的是( )A.分子比构成它的原子大B.在化学变化中,分子可再分,而原子不可再分C.分子间有间隔,而原子间没有间隔D.分子、原子的质量和体积都很小
2.下列物质由原子直接构成的是( )A.空气 B.水 C.汞 D.氧气
3.原子是构成物质的一种微粒,张红同学对其“心目中的原子”进行了如下阐述,你认为其中不正确的是( )A.原子可以转化为离子B.原子是微小的实心球体,可以再分C.原子可以结合成分子D.原子由居于中心的原子核和核外电子构成
4.下列各种微粒,不带电的是( )A.原子B.电子C.质子D.原子核
5.人类对原子结构的认识为现代量子理论的建立奠定了基础,如图几位科学家对原子的观点,按出现的先后顺序排列正确的是( )
A.③④①②B.③①②④C.③①④②D.③②①④
6.已知四种微粒的结构示意图如图,下列说法正确的是( )
A.①和②的都容易失去最外层的电子B.④属于稳定结构C.②易得到电子 D.③属于阳离子
初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子课文ppt课件: 这是一份初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子课文ppt课件,共18页。PPT课件主要包含了相对原子质量,Na+,Cl-,离子的形成,O2-等内容,欢迎下载使用。
初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子教学演示ppt课件: 这是一份初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子教学演示ppt课件,共25页。PPT课件主要包含了学习目标,情境导入,为汞原子,为氧原子,原子是什么,氢原子,直径为1cm的小球,放大一亿倍,原子体积大小的比较,原子操纵术等内容,欢迎下载使用。
初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子背景图课件ppt: 这是一份初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子背景图课件ppt,文件包含第3课时相对原子质量离子课件ppt、第1课时原子的性质课件ppt、第3课时相对原子质量离子教案doc、第1课时原子教案doc、第2课时原子内部的奥秘教案doc、第2课时原子的结构课件ppt、卢瑟福原子模型标清mp4、氧化汞受热分解视频-_标清mp4、相对原子质量介绍视频-_标清mp4、道尔顿“原子论”模型简介视频-_标清mp4、钠在氯气中的燃烧-_标清mp4等11份课件配套教学资源,其中PPT共52页, 欢迎下载使用。













