






科粤版化学九上·2.3《 构成物质的微粒(II)——原子和离子 (课时3)》(课件+教案含练习)
展开第二章 空气、物质的构成
2.3 构成物质的微粒(Ⅱ)——原子和离子第三课时
教学过程
导入新课
【复习回顾】
学生做以下三个题
1.某原子结构示意图为,该原子的核电荷数为 个,核外有 个电子层,第二层上有 个电子,最外电子层上有 个电子,该原子为 。
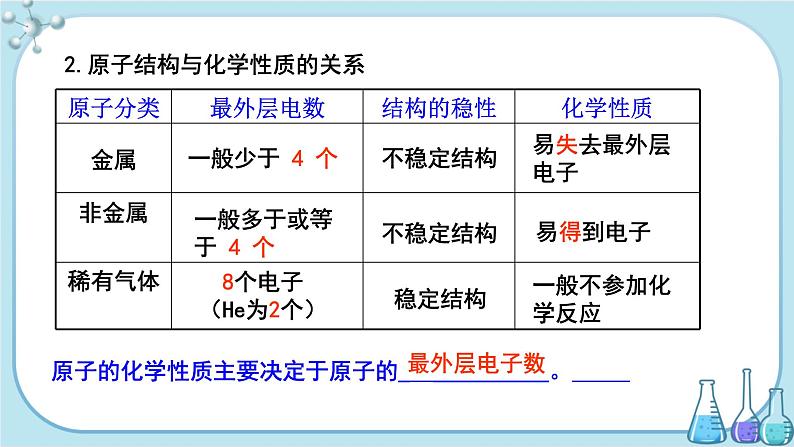
2.原子结构与化学性质的关系
原子分类 | 最外层电数 | 结构的稳定性 | 化学性质 |
金属 |
|
|
|
非金属 |
|
|
|
稀有气体 |
|
|
|
原子的化学性质主要决定于原子的___________。
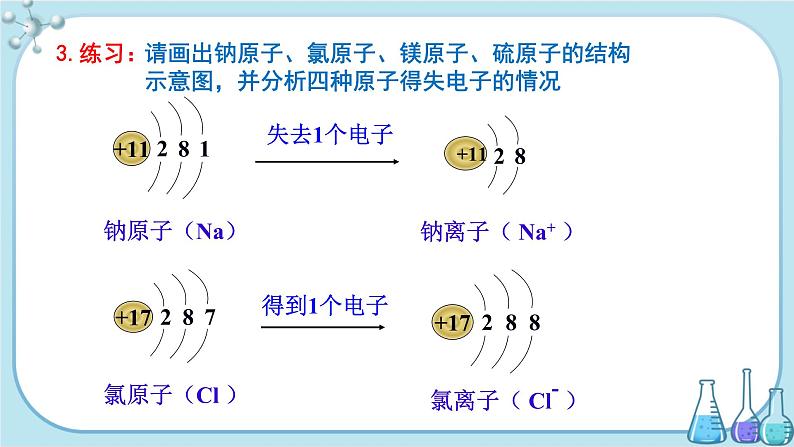
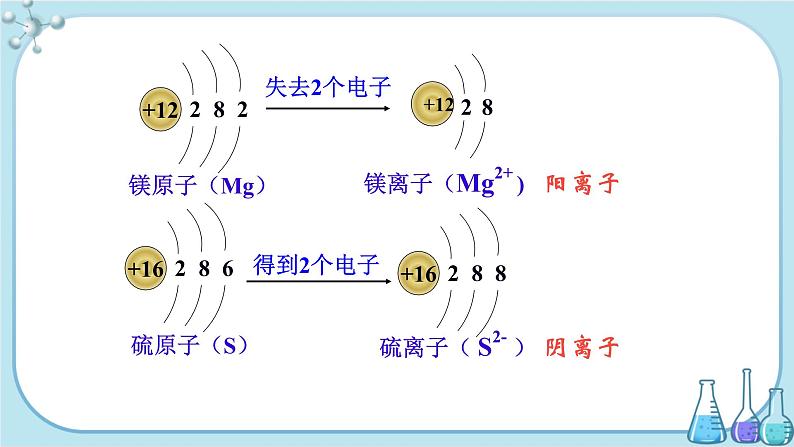
3.练习:请画出钠原子、氯原子、镁原子、硫原子的结构示意图,并分析四种原子得失电子的情况。
讲授新课
五、离子
【教师讲解】
根据前面的联系,我们画出的钠原子、氯原子、镁原子、硫原子经过得失电子后变成的粒子就是离子,钠原子和镁原子失电子后核内质子数大于核外电子数,带正电,是阳离子;氯离子和硫原子得到电子后,核内质子数小于核外电子数,带负电,是阴离子。
1.离子的定义:当原子得到或失去核外电子从而带上电荷以后,便转变成离子。
2.离子的分类
(1)阳离子:带正电的原子(或原子团)叫做阳离子。
①特点:核外电子数<质子数。
②示例:Na+、K+、Mg2+、Al3+。
(2)阴离子:带负电的原子(或原子团)叫做阴离子。
①特点:核外电子数>质子数。
②示例:O2-、S2-、 F- 、Cl-。
原子团是由原子按照一定的个数比构成的原子集团,常命名为“某某根”。常见的原子团有硫酸根离子()、碳酸根离子()、硝酸根离子()、氢氧根离子(OH-)、铵根离子()等。
由于金属原子、非金属原子的原子核外最外层没有达到稳定结构,在化学反应中易得失电子,从而达到稳定结构,那么,得失电子的结果怎样呢?
3.探究离子的形成过程
实验演示:钠在氯气中燃烧
实验目的:观察钠在氯气中燃烧。
实验步骤:把装满氯气的集气瓶倒扣于加热至熔化的金属钠上。
实验现象:钠燃烧,产生白烟。
实验结论:钠+氯气氯化钠
实验解释:当点燃的钠与氯气相遇时,氯分子(Cl2)分开成单个的氯原子(Cl),与钠原子(Na)发生了下述变化:
通过结构示意图我们可以知道,钠原子最外层有一个电子,而氯原子最外层有七个电子。钠在氯气中燃烧生成氯化钠,在这个反应中,每个钠原子失去一个电子,形成钠离子,每个氯原子得到一个电子,形成氯离子。钠离子与氯离子由于静电作用结合成稳定的化合物——氯化钠。
阳离子的形成:金属原子的最外层电子数一般小于4,在化学反应中易失去电子,质子数大于核外电子数,所以带正电荷,为阳离子,电子层减少1层。
阴离子的形成:非金属原子的最外层电子数一般大于4,在化学反应中易得到电子,质子数小于核外电子数,所以带负电荷,为阴离子,电子层数不变。
4.离子符号的书写:先写元素或原子团符号,然后在符号右上方先标电荷数值(数值为“1”时省略),后标“+”“-”号。离子所带电荷数由该元素原子的最外层电子数决定。
【教师提问】2Mg2+中数字“2”表示何种意义?
【学生回答】
5.离子符号表示的意义
【教师讲述】教师介绍原子团,要求学生熟记常见原子团(根)的符号、名称。
名称: 氢氧根 硝酸根 铵根 碳酸根 硫酸根
符号: OH-
【学生讨论】原子和离子的比较有哪些区别和联系?
【归纳总结】(1)区别:①原子结构一般不稳定(稀有气体除外),而离子结构稳定;②原子不显电性,离子带电;③原子在化学反应中不变,离子可能变;④原子用元素符号表示,离子用离子符号表示。
(2)联系:①都能构成物质,保持物质的化学性质;②用图示表示它们之间的关系。
【学生思考】想一想分子、原子、离子、物质间的关系。
【教师展示】
【教师点拨】构成物质的粒子包括原子、分子、离子。
(1)由原子直接构成的物质:稀有气体(如He、Ne等);金属(如Hg、Fe等);少数固态非金属(如C、Si等)。
(2)由分子构成的物质:双原子气体分子(如H2、O2、N2等);多原子共价化合物(如H2O、CO2、HCl等)。
(3)由离子构成的物质:离子化合物(如NaCl、K2S、CuSO4等)。
当堂达标
1.下列结构示意图,表示阴离子的是( )
A B C D
答案:D
2.某元素的原子结构示意图为,下列说法错误的是( )
A.该元素原子的质子数为11
B.该元素原子的核外有三个电子层
C.该元素属于非金属元素
D.该元素原子的核外电子总数为11
答案:C
3.下列粒子结构示意图中,表示阳离子的是( )
A B C D
答案:C
4.甲、乙是两种粒子的结构示意图,下列说法正确的是( )
甲 乙
A.甲是阳离子
B.乙是阴离子
C.甲、乙属于不同种粒子
D.甲、乙都属于金属原子
答案:C
板书设计
2.3 构成物质的微粒(Ⅱ)——原子和离子
第三课时
五、离子
1.离子的定义
2.离子的分类
阳离子
阴离子
3.探究离子的形成过程
4.离子符号的书写
5.离子符号表示的意义









