





苏教版 (2019)选择性必修1第三单元 化学平衡的移动图片课件ppt
展开1.了解化学平衡移动的概念和化学平衡移动的原因。2.了解浓度、压强影响化学平衡移动的规律。3.能通过浓度商判断化学平衡移动的方向。
当一个可逆反应达到平衡后,如果改变条件(如浓度、压强、温度),平衡体系会发生哪些变化?
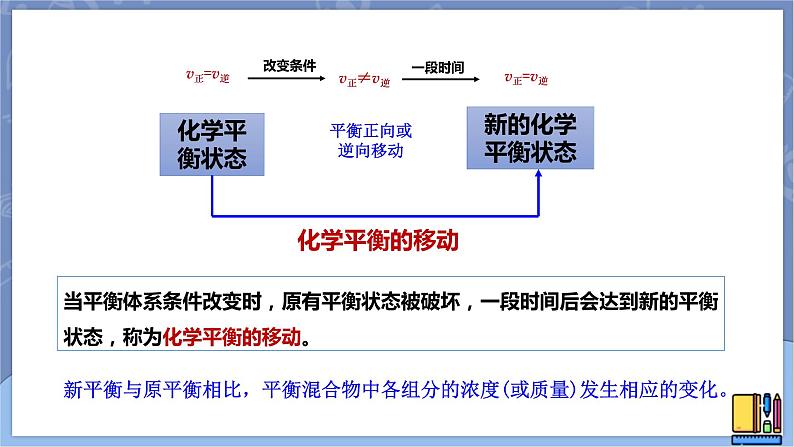
改变条件,引起:①v正≠v逆 ②各组分的百分含量发生改变。
当平衡体系条件改变时,原有平衡状态被破坏,一段时间后会达到新的平衡状态,称为化学平衡的移动。
新平衡与原平衡相比,平衡混合物中各组分的浓度(或质量)发生相应的变化。
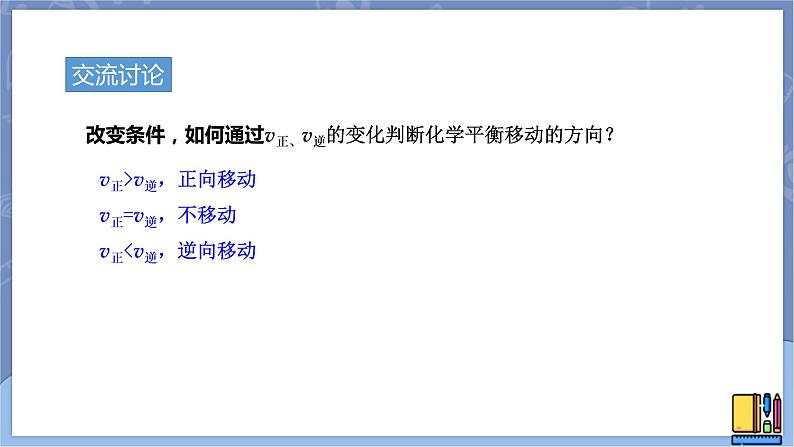
改变条件,如何通过v正、v逆的变化判断化学平衡移动的方向?
v正>v逆,正向移动v正=v逆,不移动v正
浓度变化对化学平衡的影响
其他条件不变,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向方向移动。
对于可逆反应 ,一定温度下,设为该反应的浓度商,简称反应商。试讨论Qc与K的关系。
Qc>K,可逆反应向逆反应方向进行Qc=K,可逆反应处于平衡状态Qc
已知一定温度下,可逆反应aA(g) bB(g)达到平衡状态。(1)写出该反应的平衡常数表达式K和反应商的表达式Qc。(2)若增大体系压强,c(A)、c(B)如何变化? (3)若增大压强,讨论Qc与K的关系,并判断平衡移动方向: ①若a>b,Qc____K,平衡________移动 ②若a=b,Qc____K,平衡________移动 ③若a
压强变化对化学平衡的影响
减小容器体积增大压强,化学平衡向气体分子数目减小的方向移动;增大容器体积减小压强,化学平衡向气体分子数目增大的方向移动。对于反应前后气体分子数目不变的反应,增大压强时,改变反应体系的压强,平衡不发生移动。
充入“惰气”对化学平衡的影响恒温恒容条件下,充入“惰气”,体系中各物质的浓度没有发生变化,化学平衡不发生移动;恒温恒压条件下,充入“惰气”,体系所占的体积增大,各物质的浓度减小,化学平衡向气体分子数目增大的方向移动。
若在恒温恒容条件下充入“惰气”,化学平衡如何移动?若在恒温恒压条件下充入“惰气”,化学平衡如何移动?
1.在一定条件下,反应:2SO2(g)+O2(g) 2SO3(g)达到了平衡,改变某一条件,发生下述变化,其中可确定该平衡一定发生移动的是( )A.v(SO2)增大 B.v(SO3)减小C.O2的百分含量发生变化 D.SO3的质量不变
答案:C解析:正、逆反应速率同等倍数的增大或减小,仍然相等,平衡不移动;O2的百分含量发生变化,化学平衡一定发生移动;SO3的质量不变,平衡不移动。
2.已知反应:mA(g)+nB(g) pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化和化学平衡的移动方向。
t1时刻,增大反应物浓度,使v′正增大,而v′逆不变,则v′正>v′逆,平衡向正反应方向移动。请参照上图,画出t1时刻,减小反应物浓度,其反应速率的变化,并分析化学平衡的移动方向。
t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动。
3.压强变化不会使下列化学平衡发生移动的是( )A.H2(g)+I2(g) 2HI(g) B.3H2(g)+N2(g) 2NH3(g)C.2SO2(g)+O2(g) 2SO3(g) D.C(s)+CO2(g) 2CO(g)
高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动优秀课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动优秀课件ppt,共41页。PPT课件主要包含了课前导入,v正v逆,v正≠v逆,v’正v’逆,v正>v逆,v正<v逆,实验探究一,注意事项,总结·归纳,习题研究等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第三单元 化学平衡的移动优秀课件ppt: 这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动优秀课件ppt,共60页。PPT课件主要包含了内容索引,课时对点练,原有的平衡状态,新的平衡状态,溶液由黄色变为橙色,正反应,逆反应,逆反应方向,正反应方向,正误判断等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第三单元 化学平衡的移动教课课件ppt: 这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动教课课件ppt,共60页。PPT课件主要包含了课时对点练等内容,欢迎下载使用。













