
高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动学案
展开2.3.3 化学平衡中的图像问题
【学习目标】
1.会分析常见的关于化学平衡的图像题。
2.学会化学平衡图像题的分析解答方法。
【核心知识探究】
一、化学平衡图像的类型及特点
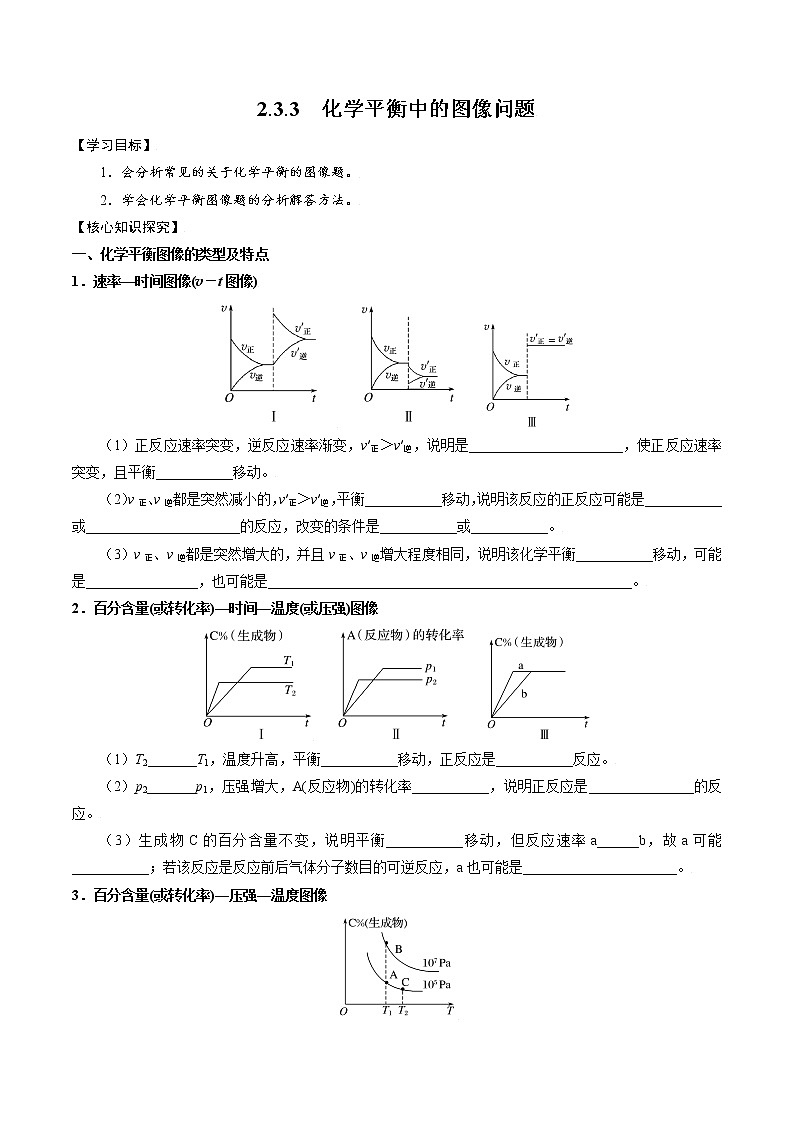
1.速率—时间图像(v-t图像)
(1)正反应速率突变,逆反应速率渐变,v′正>v′逆,说明是______________________,使正反应速率突变,且平衡___________移动。
(2)v正、v逆都是突然减小的,v′正>v′逆,平衡___________移动,说明该反应的正反应可能是___________或______________________的反应,改变的条件是___________或___________。
(3)v正、v逆都是突然增大的,并且v正、v逆增大程度相同,说明该化学平衡___________移动,可能是________________,也可能是____________________________________________________。
2.百分含量(或转化率)—时间—温度(或压强)图像
(1)T2_______T1,温度升高,平衡___________移动,正反应是___________反应。
(2)p2_______p1,压强增大,A(反应物)的转化率___________,说明正反应是_______________的反应。
(3)生成物C的百分含量不变,说明平衡___________移动,但反应速率a______b,故a可能___________;若该反应是反应前后气体分子数目的可逆反应,a也可能是______________________。
3.百分含量(或转化率)—压强—温度图像
压强不变时,生成物C的百分含量随温度T的升高而逐渐__________,说明正反应是_________反应;
温度T不变,做横坐标的垂线,与压强线出现两个交点,分析生成物C的百分含量随压强p的变化可以发现,压强_________,生成物C的百分含量_________,说明正反应是____________________的反应。
4.物质的量 (浓度)—时间图像(n/c-t图像)
在2 L刚性密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。根据图像回答下列问题:
(1)横坐标表示反应过程中___________,纵坐标表示反应过程中______________________。
(2)该反应的化学方程式是______________________。
(3)在反应达2 min时,正反应速率与逆反应速率之间的关系是___________。
(4)若用A物质的量浓度的变化,表示反应达平衡(2 min)时的正反应速率是___________________。
二、化学平衡图像解题方法
1.判断平衡移动方向
判断平衡移动方向,根据v′正、v′逆的相对大小;判断改变的哪种外界条件,根据改变条件的那一时刻v′正、v′逆的变化,若v′正或v′逆有一个发生了“突变”,则为改变的浓度;若两个都发生了“突变”,则为改变的温度或压强;若两个都发生了“突变”且仍然相等,则为加入催化剂或等体反应改变压强。
2.“定一议二”原则
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的意义共三个量。确定横坐标所表示的量后,讨论纵坐标与曲线的关系;或者确定纵坐标所表示的量,讨论横坐标与曲线的关系。即“定一议二”原则。解题过程中,可以作辅助线帮助分析。例如反应aA(g)+bB(g)cC(g)在不同温度下(T1<T2),压强(p)与混合气体中C的含量(C%)的关系图像如图所示。根据图像回答下列问题:
(1)T1为一条等温线,随着压强的增大,C%________,化学平衡_________移动,a+b____c。
(2)在压强一定时(如p3),温度升高,C%________,化学平衡________移动,正反应是___________反应。
3.“先拐先平”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以aA(g)+bB(g)cC(g)为例]。
根据图像回答下列问题:
(1)图1中,温度T1、T2的大小关系是___________,温度升高,C%(C的含量)的变化是___________,化学平衡___________移动,正反应是___________反应。
(2)图2中,压强p1、p2的大小关系是___________,压强增大,C%(C的含量)的变化是___________,化学平衡___________移动,a+b___________c。
【课堂检测】
1.分析下面的两个图像,回答问题:
(1)如图①,该平衡向_________方向移动,改变的条件是____________________。
(2)如图②,可能是改变什么条件引起的平衡移动?并判断其对应的化学反应的特点。
2.如图,甲、乙、丙分别表示在不同条件下可逆反应A(g)+B(g)xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则______曲线表示无催化剂时的情况,原因是__________________________________________________。
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下充入氦气后的情况,则____曲线表示恒温恒容的情况,原因是________________________________________________________。
(3)根据丙图可以判断该可逆反应的正反应是________(填“吸”或“放”)热反应,化学计量数x的值________。
参考答案
【核心知识探究】
一、化学平衡图像的类型及特点
1.(1)增大了反应物的浓度 正向
(2)正向 放热反应 气体分子数目增大 降低温度 减小压强。
(3)没有发生 使用了催化剂 对反应前后气体气体分子数目不变的反应增大压强(压缩体积)
2.(1)> 逆向 放热 (2)> 减小 气体分子数目增大
(3)不发生 > 使用了催化剂 增大了压强(压缩体积)
3.减小 放热 增大 增大 气体分子数目减小
4.(1)时间变化 物质的物质的量的变化
(2) 3A(g)+B(g)2C(g)
(3)相等
(4)0.15_mol·L-1·min-1
二、化学平衡图像解题方法
2.(1)减小 逆向 < (2)增大 正向 吸热
3.(1) T2>T1 减小 逆向 放热
(2) p1>p2 减小 逆向 <
【课堂检测】
1.答案:(1)正反应 增大反应物浓度
(2)可能是升高温度引起的平衡移动,如果是升高温度,则该反应的正反应是吸热反应;也可能是增大压强引起的平衡移动,如果是增大压强,则该反应的正反应是气体体积减小的反应。
2.答案:(1)b b达到平衡所用时间长,说明b的反应速率小于a
(2)a a中充入氦气,w(C)不变,平衡不移动
(3)吸 大于2(>2)或大于等于3(≥3)
解析:(1)催化剂能够加快反应速率,缩短反应达到平衡时的时间,所以a曲线表示有催化剂时的情况,b曲线表示无催化剂时的情况。
(2)恒温恒容条件下,向平衡体系中通入稀有气体,平衡不移动;恒温恒压条件下,向平衡体系中通入稀有气体,平衡向体积增大的方向移动。
(3)由丙图可知,恒压条件下,升高温度,平衡向正反应方向移动,所以正反应为吸热反应;恒温条件下,增大压强,平衡向逆反应方向进行,所以正反应为体积增大的反应,x>2。
化学选择性必修1第三单元 盐类的水解导学案: 这是一份化学选择性必修1第三单元 盐类的水解导学案,共5页。学案主要包含了学习目标,基础知识梳理,课堂检测等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动导学案: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动导学案,共4页。学案主要包含了学习目标,基础知识梳理,课堂检测等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第三单元 化学平衡的移动导学案及答案: 这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动导学案及答案,共5页。学案主要包含了学习目标,基础知识梳理,课堂检测等内容,欢迎下载使用。













