





化学选择性必修1第四章 化学反应与电能第二节 电解池授课ppt课件
展开1.了解电解池的构造和工作原理。2.会写电解池的电极反应式和总反应方程式。3.认识电解在实现物质转化和储存能量中的具体应用。4.能够运用电子守恒的观点进行电化学计算。5.能设计简单的电解池。
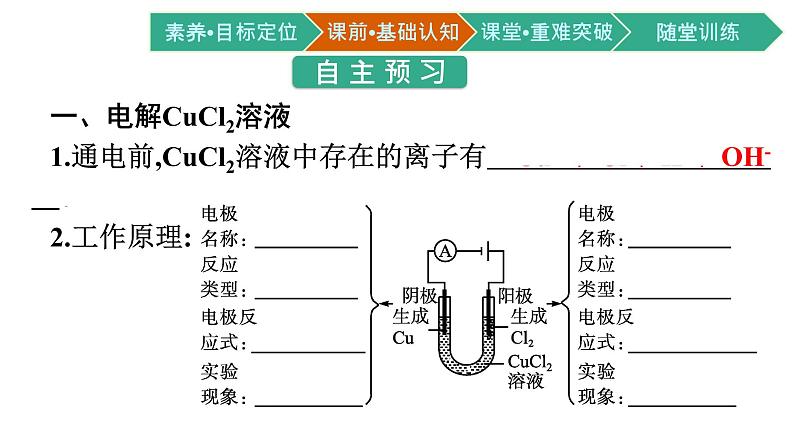
一、电解CuCl2溶液1.通电前,CuCl2溶液中存在的离子有 Cu2+、Cl-、H+、OH- 。 2.工作原理:
3.总反应:CuCl2 Cu+Cl2↑。微思考电解质溶液导电与金属导电有什么不同?提示:电解质溶液导电实际上是电解过程,发生氧化还原反应,是化学变化。金属导电是因为在外加电场作用下,自由电子发生定向移动,是物理变化。
二、电解和电解池1.电解的定义:使 电流 通过电解质溶液(或熔融电解质)而在阳极、阴极引起 氧化还原反应 的过程。 2.电解装置——电解池。(1)定义:将 电 能转化为 化学 能的装置,也称电解槽。
(2)构成条件。①两个电极:阳极——与电源 正 极连接; 阴极——与电源 负 极连接。 ②电解质溶液或 熔融电解质 。 ③直流电源。④用导线连接形成 闭合回路 。
(3)装置中电子和离子的移动方向。①电子:从电源 负 极流出后,流向电解池 阴 极;从电解池的 阳 极流出后流向电源的 正 极。 ②离子:阳离子移向电解池的 阴 极,阴离子移向电解池的 阳 极。
1.判断正误,正确的画“√”,错误的画“×”。(1)电解与电离均需要通电才可发生。( )(2)电解CuCl2溶液,Cu2+放电发生氧化反应。( )(3)电解池的阳极与原电池的负极电极反应类型相同。( )(4)电解过程中电子流向为负极→阴极→阳极→正极。( )(5)电解池是将化学能转化成电能的装置。( )(6)电解池两个电极材料可以相同。( )
2.下列关于如图所示①②两个装置的叙述,正确的是( )。A.装置名称:①是原电池,②是电解池B.c(H2SO4)变化:①增大,②减小C.电极反应式:①中阳极反应为4OH--4e-══2H2O+O2↑,②中正极反应为Zn-2e-══Zn2+D.离子移动方向:①中的H+向阴极方向移动,②中的H+向负极方向移动答案:B
解析:①中有外加电源,为电解池,②为原电池,A项错误;①中电解水,c(H2SO4)增大,②中正极消耗H+,生成H2,c(H2SO4)减小,B项正确;②中正极反应为2H++2e-══H2↑,C项错误;②中H+向正极移动,D项错误。
3.用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是( )。A.a端是直流电源的负极B.通电使CuCl2发生电离C.阳极上发生的反应:Cu2++2e-══CuD.通电一段时间后,在阴极附近观察到黄绿色气体答案:A
解析:根据溶液中阳离子Cu2+移向,左边电极为阴极,则a端是直流电源的负极,A项正确;CuCl2发生电离不需要通电,B项错误;Cu2+在阴极上反应,C项错误;通电一段时间后,Cl-在阳极附近放电生成氯气,D项错误。
一 电解原理重难归纳1.电解原理示意图。
2.电解池的阴极、阳极的判断方法。
3.原电池与电解池的比较。
电解过程中发生的化学反应与原电池中的化学反应有什么区别?提示:电解过程中发生的化学反应是在“被迫状态下”发生的,因此非自发发生的氧化还原反应可通过电解来实现。如Cu与H+不反应,但在电解条件下可实现反应:Cu+2H+ Cu2++H2↑。原电池中的化学反应均可自发进行。
典例剖析如图所示是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关判断正确的是( )。A.a为负极、b为正极B.a为阳极、b为阴极C.电解过程中,d电极质量增大D.电解过程中,氯离子浓度不变答案:C
解析:电流从电源的正极流出,因此a为正极,b为负极,则c为阳极,d为阴极。电解CuCl2溶液电极反应为阳极(c电极):2Cl--2e-══Cl2↑,阴极(d电极):Cu2++2e-══Cu,C项正确。
【拓展延伸】 在氯化铜溶液中除了Cu2+和Cl-之外还有H+和OH-,这两种离子为什么没有得到或失去电子?答案:电解过程实质上发生了氧化还原反应,一般来说氧化性强的阳离子先得电子被还原,还原性强的阴离子先失电子被氧化。Cu2+比H+更容易得电子,而Cl-比OH-更容易失电子。
学以致用1.如下图所示装置中,属于电解池的是( )。答案:C解析:根据电解池的构成条件进行判断。装置A、B、D中无直流电源,且装置D中不能形成闭合回路,A、B、D不属于电解池。
2.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增大,b极板处有无色、无臭气体放出。符合这一情况的是下表中的( )。
解析:由题意知,通电后a极板质量增大,说明有金属析出,由此可知,a极为电解池的阴极,则X为电源负极,B、C两项均不符合题意;又因为b极放出的是无色、无臭的气体,D项不符合题意。
二 电解规律重难归纳1.电解池中电解产物的判断。电解池中的电解产物,与溶液中的离子的放电顺序有关,阳极产物还与电极材料有关。(1)阳极产物。①若阳极为活性金属电极,则金属失电子溶解,一般生成相应金属阳离子(Fe生成Fe2+而不是生成Fe3+),此时溶液中的离子不放电。
②若阳极为惰性电极(Pt、C等),则溶液中的离子放电,放电的一般顺序是S2->I->Br->Cl->OH->含氧酸根离子>F-,即在水溶液中含氧酸根离子和F-不放电,阳极产物一般为对应非金属单质。
(2)阴极产物。阴极产物与电极材料无关,直接根据阳离子放电顺序进行判断。一般放电顺序是Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。阳离子放电后的产物一般是相应单质,但是在水溶液中Fe3+放电后的产物一般是Fe2+。离子的放电顺序也不是绝对的,放电情况与离子性质、溶液浓度、电流和电极材料等有关。
①K+、Ca2+、Na+、Mg2+、Al3+在水溶液中不放电,要使这些离子放电,需电解熔融电解质,如熔融NaCl、熔融MgCl2、熔融Al2O3等。②在水溶液中,当H+浓度较小时,放电能力Zn2+>H+;当H+浓度较大时,放电能力H+>Zn2+。
2.酸、碱、盐溶液的电解规律(惰性电极)。用惰性电极电解下列酸、碱、盐溶液。(1)电解水型。
(2)电解电解质型。
(3)电解质和水都发生电解型。
典例剖析用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与电解前原来溶液完全一样的是( )。A.NaCl溶液(盐酸)B.NaOH溶液(H2O)C.CuCl2溶液(HCl)D.CuSO4溶液[Cu(OH)2]答案:B
解析:电解NaCl溶液时,阳极氯离子放电生成氯气,阴极氢离子得到电子生成氢气,所以应加HCl让电解质溶液复原,A项错误;电解NaOH溶液时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,B项正确;电解CuCl2溶液时,阳极氯离子放电生成氯气,阴极析出铜,所以应加氯化铜让电解质溶液复原,C项错误;电解硫酸铜溶液时,阳极产生氧气,阴极产生金属铜,所以应加CuO让电解质溶液复原,加入氢氧化铜相当于多加入了水,D项错误。
方法归纳 电解注意事项。(1)电解池的阴极不管是惰性电极(Pt、石墨)还是活性电极,都是电解质溶液(或熔融电解质)中的阳离子放电,电极本身不可能溶解。(2)若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴极为H+放电,同时阳极为OH-放电,相当于电解水,电解质溶液浓度增大(饱和溶液例外)。(3)电解质溶液恢复原状的方法:少什么加什么,少多少加多少。
学以致用1.如图为用直流电源电解稀Na2SO4溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )。A.逸出气体的体积,a电极的小于b电极的B.一电极逸出无臭气体,另一电极逸出有刺激性气味的气体C.a电极附近呈红色,b电极附近呈蓝色D.a电极附近呈蓝色,b电极附近呈红色答案:D
解析:电解Na2SO4溶液时,a为阴极:4H++4e-══2H2↑,b为阳极:4OH--4e-══O2↑+2H2O;a极周围由于H+放电溶液呈碱性,石蕊溶液显蓝色,b极周围由于OH-放电溶液呈酸性,石蕊溶液显红色。
2.用惰性电极电解下列各组物质的水溶液时,发生的电极反应完全相同的是( )。A.NaOH、H2SO4B.CuCl2、Cu(NO3)2C.Na2SO4、NaClD.KNO3、AgNO3答案:A
解析:用惰性电极电解NaOH、H2SO4的水溶液时实质均为电解水,电极反应均相同,A项正确;电解B、C两组物质的水溶液时,阳极反应不同,阴极反应相同,B、C两项错误;电解KNO3溶液、AgNO3溶液,阳极反应相同,阴极反应不同,D项错误。
1.下列有关电解池的说法正确的是( )。A.在电解池中与外接电源负极相连的电极是阳极B.电解任何物质,阳极上失电子数与阴极上得电子数相等C.电解氯化铜溶液时在阴极上有黄绿色气体生成D.电解NaCl、CuCl2两种溶液时参加反应的物质是相同的答案:B
解析:在电解池中,与负极相连的是阴极,A项错误;电解氯化铜溶液时阳极上有氯气生成,阴极上有铜析出,C项错误;电解NaCl溶液时阴极得到的是H2和NaOH,而电解CuCl2溶液时阴极得到的是Cu,D项错误。
2.某学生欲完成反应2HCl+2Ag══2AgCl+H2↑,设计了下列四个实验,你认为可行的实验是( )。答案:C解析:反应不能自发进行,应设计成电解池,金属银失电子作阳极与电源的正极相连。
3.用惰性电极电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )。①稀NaOH溶液 ②HCl溶液 ③酸性MgSO4溶液 ④酸性AgNO3溶液A.①③B.①②C.③④D.②④答案:A
解析:阴极和阳极主要产物是H2和O2,说明溶液中H+和OH-分别在阴极、阳极放电。①中NaOH溶液和③中酸性MgSO4溶液均是H+和OH-放电;②中HCl溶液,阴极是H+放电生成H2,阳极是Cl-放电生成Cl2;④中AgNO3溶液中Ag+和OH-放电分别生成Ag和O2。
4.用惰性电极电解下列溶液,电解一段时间后,阴极质量增大,电解质溶液的pH减小的是( )。①CuSO4 ②BaCl2 ③AgNO3 ④H2SO4A.①②B.①③C.①④D.②④答案:B解析:阴极质量增大,说明溶液中含有不活泼金属的阳离子;电解质溶液的pH减小,说明在阳极上是OH-放电,而相应的阴离子应是含氧酸的酸根离子,故本题的答案应为不活泼金属的含氧酸盐,B项正确。
5.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不正确的是( )。A.x是正极,y是负极B.a极产生氢气,b极生成I2C.a极和Pt电极都有气泡产生D.U形管中溶液的碱性增强答案:A
6.用石墨棒作电极,从Na+、Cu2+、Cl-、 中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:(1)阴极放出H2,阳极放出O2,电解质是 ; (2)阴极析出金属,阳极放出O2,电解质是 ; (3)阴极放出H2,阳极放出Cl2,电解质是 ; (4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1,电解质是 。答案:(1)Na2SO4 (2)CuSO4 (3)NaCl (4)CuSO4
解析:用惰性电极电解电解质溶液的类型有电解水型、电解电解质型、放氢气生碱型和放氧气生酸型,再根据阴、阳离子在电极的放电顺序判断。(1)阴极生成H2、阳极生成O2,实质为电解水,电解质可以是活泼金属的含氧酸盐,即Na2SO4。(2)实质为放氧气生酸型,电解质为不活泼金属的含氧酸盐,即CuSO4。
化学第二节 电解池图文ppt课件: 这是一份化学第二节 电解池图文ppt课件,共39页。PPT课件主要包含了拓展延伸,特别提醒等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池教案配套课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池教案配套课件ppt,共31页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池公开课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池公开课课件ppt,共14页。PPT课件主要包含了学习目标等内容,欢迎下载使用。













