
2021学年第四节 羧酸 羧酸衍生物精练
展开第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第1课时 羧酸
- 认识羧酸的官能团与组成,能对简单羧酸进行分类。
- 认识羧酸的结构特点与物理性质、化学性质。
教学重点:羧酸的结构及性质
教学难点:羧酸酸性强弱的比较,酯化反应中有机化合物的断键规律
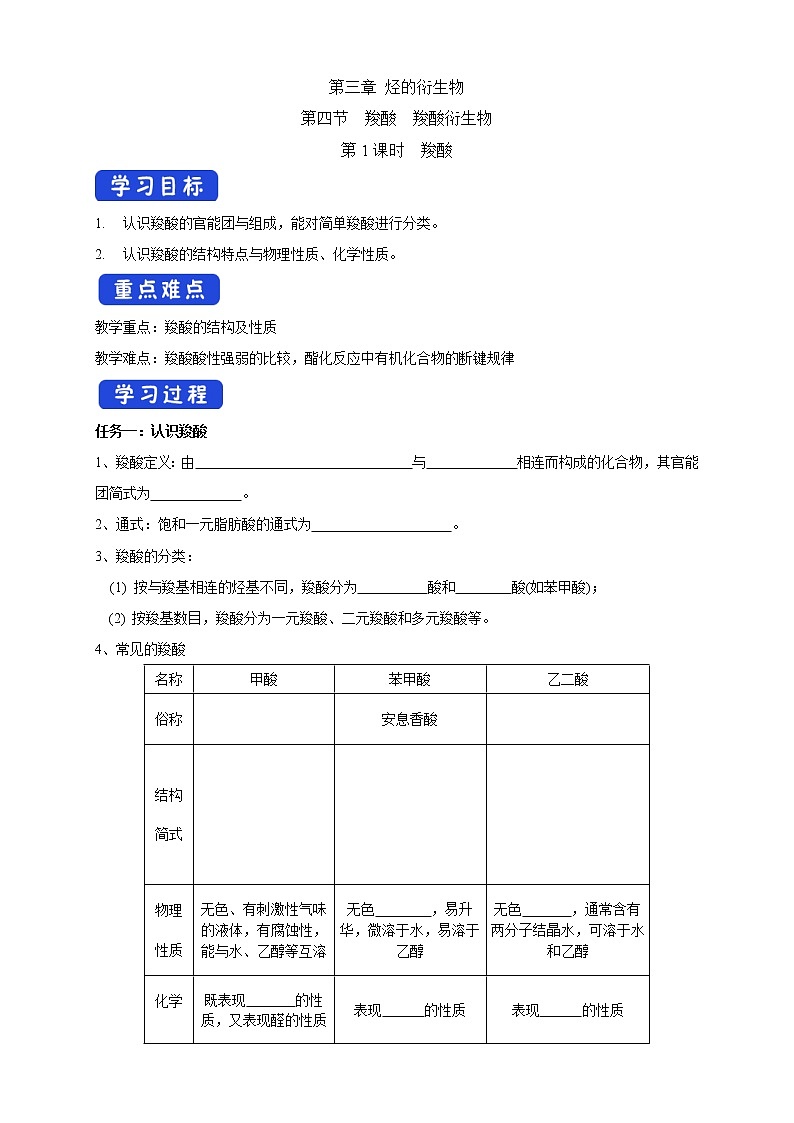
任务一:认识羧酸
1、羧酸定义:由 与 相连而构成的化合物,其官能团简式为 。
2、通式:饱和一元脂肪酸的通式为 。
3、羧酸的分类:
(1) 按与羧基相连的烃基不同,羧酸分为 酸和 酸(如苯甲酸);
(2) 按羧基数目,羧酸分为一元羧酸、二元羧酸和多元羧酸等。
4、常见的羧酸
名称 | 甲酸 | 苯甲酸 | 乙二酸 |
俗称 |
| 安息香酸 |
|
结构 简式 |
|
|
|
物理 性质 | 无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶 | 无色 ,易升华,微溶于水,易溶于乙醇 | 无色 ,通常含有两分子结晶水,可溶于水和乙醇 |
化学 性质
| 既表现 的性质,又表现醛的性质 | 表现 的性质 | 表现 的性质 |
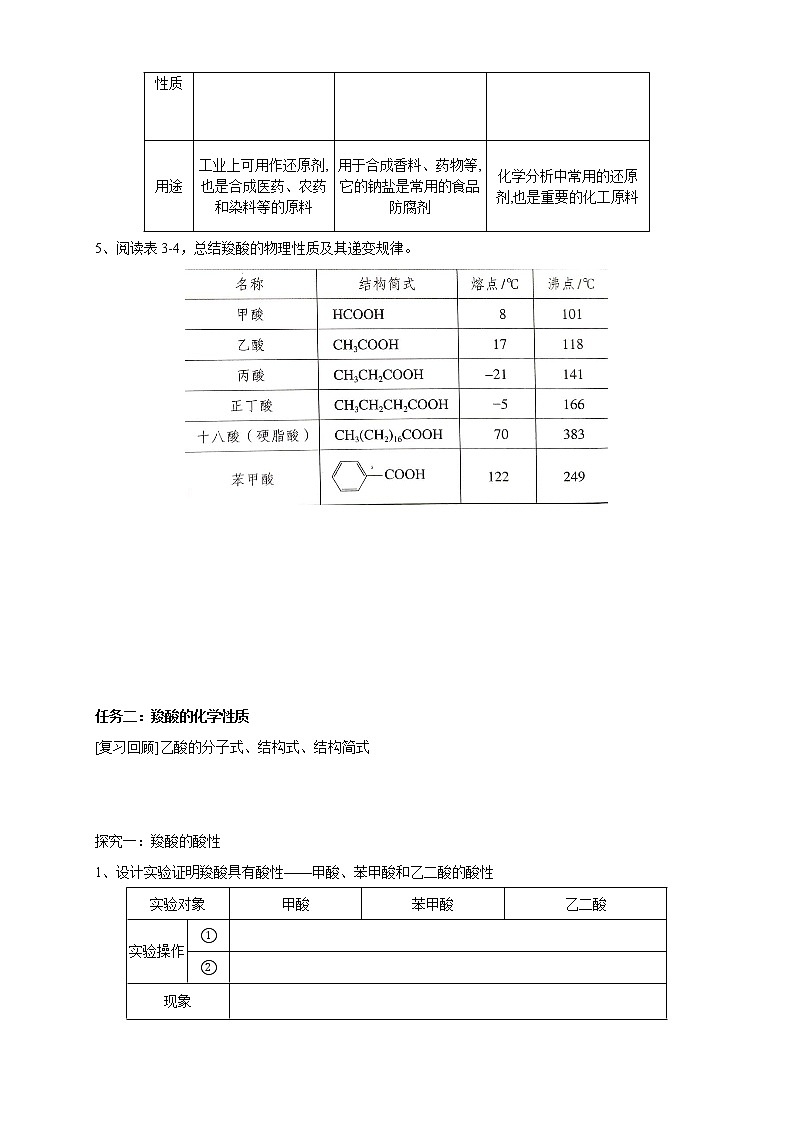
用途 | 工业上可用作还原剂,也是合成医药、农药和染料等的原料 | 用于合成香料、药物等,它的钠盐是常用的食品防腐剂 | 化学分析中常用的还原剂,也是重要的化工原料 |
5、阅读表3-4,总结羧酸的物理性质及其递变规律。
任务二:羧酸的化学性质
[复习回顾]乙酸的分子式、结构式、结构简式
探究一:羧酸的酸性
1、设计实验证明羧酸具有酸性——甲酸、苯甲酸和乙二酸的酸性
实验对象 | 甲酸 | 苯甲酸 | 乙二酸 | |
实验操作 | ① |
| ||
② |
| |||
现象 |
| |||
结论 |
| |||
2、设计实验证比较乙酸、碳酸和苯酚酸性强弱
注:D、E、F、G分别是双孔橡胶塞上的孔
[思考与讨论]
- 上述装置中饱和NaHCO3溶液的作用是什么?可否将其撤去?
- 写出各装置中反应的化学方程式。
- 甲酸除了具有酸性,还可能有哪些化学性质?请从分子结构的角度进行分析。
- 甲酸和乙酸的鉴别方法
探究二:酯化反应
环节一:酯化反应原理探究
[思考与讨论]
乙酸与乙醇的酯化反应,从形式上看是羧基与羟基之间脱去一个水分子。脱水时有以下两种可能的方式,你能设计一个实验方案来证明是哪一种吗?
环节二:酯化反应产率探究
[思考与讨论]
在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请结合化学反应原理的有关知识进行说明。
任务三: 羧酸的化学性质探究
理解羧酸的化学性质取决于羧基官能团。
任务四:羧酸知识建构
- 下列关于乙酸的说法中正确的是
A. 通常状况下乙酸是有刺激性气味的液体
B. 乙酸分子中4个氢原子均在同一平面上
C. 乙酸在常温下能发生酯化反应
D. 乙酸酸性较弱,不能使石蕊试液变红
- 下列关于乙酸的说法不正确的是
A. 乙酸是一种重要的有机酸,且具有强烈的刺激性气味
B. 乙酸分子中含有4个H原子,所以乙酸不是一元酸
C. 无水乙酸又称冰醋酸,它是纯净物
D. 乙酸易溶于水和乙醇
- 酒精和醋酸是生活里的常用品,下列方法不能将二者鉴别开的是
A. 闻气味
B. 分别用来浸泡水壶中的水垢看是否溶解
C. 分别滴加NaOH溶液
D. 分别滴加紫色石蕊溶液
- 下列有关化学用语的表示中正确的是
A. 乙醇分子的球棍模型为
B. 一氯甲烷的电子式为
C. 乙酸的结构简式:
D. 分子式为的有机物有3种
- 如图是乙酸乙酯的绿色合成路线之一:
的分子式为_______________。
下列说法不正确的是____________填字母序号。
A.淀粉和纤维素都属于天然高分子化合物
B.M可与新制的氢氧化铜悬浊液在加热条件下生成砖红色沉淀
C.所有的糖类都有甜味,都可以发生水解反应
D.用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
乙醇分子结构中的化学键如图所示:
乙醇与乙酸反应时,断裂的化学键是___________填字母序号,
反应的化学方程式为__________。反应类型:_______________________
乙醇在铜作催化剂时与氧气反应,断裂的化学键是________填字母序号,反应的化学方程式为__________,
乙醇和乙酸在一定条件下制备乙酸乙酯。
乙酸中官能团的名称是______________________ 。
生成乙酸乙酯的反应是可逆反应,下列能说明该反应已达到化学平衡状态的是_______填序号。
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的物质的量相等
乙酸乙酯和丁酸互为同分异构体,丁酸有______________________种结构。
化学选择性必修3第四节 羧酸 羧酸衍生物巩固练习: 这是一份化学选择性必修3第四节 羧酸 羧酸衍生物巩固练习,共6页。试卷主要包含了单选题,实验题,推断题等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物随堂练习题: 这是一份高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物随堂练习题,共8页。
高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物课时作业: 这是一份高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物课时作业,共11页。试卷主要包含了常见的羧酸等内容,欢迎下载使用。













