





苏教版 (2019)必修 第一册第一单元 含硫化合物的性质课文课件ppt
展开硫是人类最先知道的化学元素之一,每次火山爆发都带出大量的硫。在古代,硫的主要用途是制作黑火药(制造黑火药的三大原料为炭粉、硝酸钾、硫黄),我国是世界上最早发明黑火药的国家。硫的另一个重要的用途是制造它的化合物——硫酸(H2SO4)。硫酸被人们誉为“化学工业之母”。
1.了解硫单质的物理性质和化学性质。2.掌握二氧化硫的物理性质和化学性质。3.了解SO2对环境的危害以及环保措施。
1.从硫、二氧化硫的属类及硫元素化合价角度认识硫及二氧化硫的性质、用途,体会性质决定用途的核心理念。(宏观辨识与微观探析)2.结合真实情境中的应用实例或通过实验探究,理解SO2的酸性、漂白性及强还原性。(科学探究与创新意识)3.热爱生活,树立环保意识和绿色化学的理念。(科学态度与社会责任)
一、硫1.物理性质:硫(俗称硫黄)是一种黄色或浅黄色固体,质脆,易研成粉末。硫难溶于水,微溶于酒精,易溶于CS2。
试管内壁附着硫怎样洗掉?
提示:硫单质易溶于CS2,可用CS2洗涤。
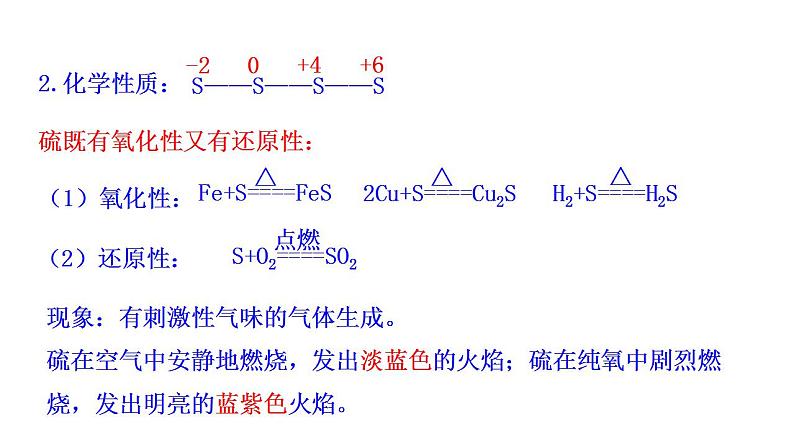
2.化学性质:硫既有氧化性又有还原性:(1)氧化性:
现象:有刺激性气味的气体生成。硫在空气中安静地燃烧,发出淡蓝色的火焰;硫在纯氧中剧烈燃烧,发出明亮的蓝紫色火焰。
H2+S====H2S
硫与铁、铜在一定条件下反应的产物,与氯气在一定条件下与铁、铜反应的产物有什么不同?(科学探究与创新意识)
【提示】硫与铁、铜在一定条件下反应生成金属的低价硫化物;而氯气在一定条件下与铁、铜反应生成金属的高价氯化物。
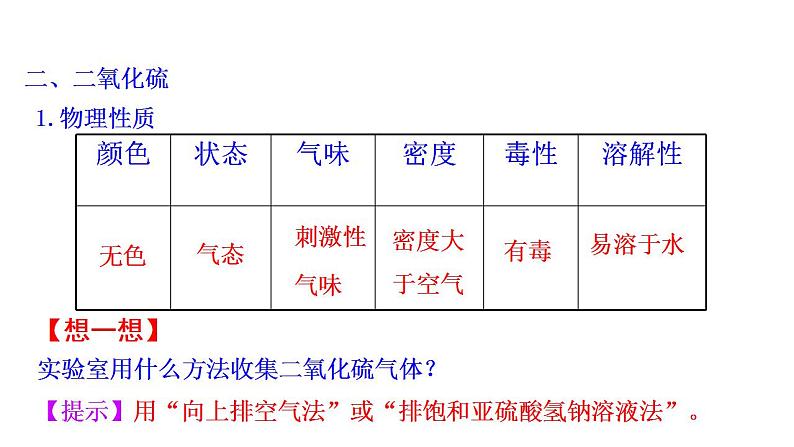
1.物理性质
【想一想】 实验室用什么方法收集二氧化硫气体?
【提示】用“向上排空气法”或“排饱和亚硫酸氢钠溶液法”。
2.化学性质(1)酸性氧化物的通性 ①与H2O反应:
实验Ⅰ:把充满SO2、塞有胶塞的试管倒扣在水中,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验Ⅱ使用)。
SO2+H2O H2SO3
亚硫酸是一种弱酸,不稳定,可分解成二氧化硫和水。可逆反应: 在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应。
实验中原盛有SO2气体的试管水位有什么变化?说明了什么?【提示】试管内水位上升,说明SO2易溶于水。
不能进行到底,反应物、生成物同时存在
②与碱反应 SO2+2NaOH====Na2SO3+H2O③与碱性氧化物反应: SO2+Na2O====Na2SO3 (亚硫酸钠) SO2 +CaO====CaSO3 (亚硫酸钙)实验室制取SO2时,可选择用碱液吸收尾气,防止空气污染。
SO2与CO2均能使澄清的石灰水先变浑浊后变澄清
(2)还原性 (3)氧化性
SO2+2H2S====3S↓+2H2O
SO2+Cl2+2H2O====H2SO4+2HCl
能使氯水、溴水、碘水、酸性高锰酸钾溶液褪色。
CO2与SO2性质比较
易溶(体积比1∶40)
SO2+H2O⇌H2SO3
CO2+H2O====H2CO3
SO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解:Ca(OH)2+SO2====CaSO3↓+H2OCaSO3+SO2+H2O====Ca(HSO3)2
CO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解:Ca(OH)2+CO2====CaCO3↓+H2OCaCO3+CO2+H2O====Ca(HCO3)2
CO2与SO2的常用鉴别法
实验Ⅱ:用试管取2 mL在实验Ⅰ中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液中的颜色变化。然后加热试管,注意通风,再观察溶液的变化。
漂白后生成的物质不稳定
SO2的漂白与氯水的漂白相同吗?
用途:它可以用来漂白纸浆、毛、丝、草编制品等。
SO2和氯水的漂白性对比
二氧化硫与水反应生成亚硫酸,可以与一些有色物质直接化合生成不稳定的无色物质
氯水中的次氯酸将有色物质氧化成无色物质
不能恢复原色——永久漂白
注意:SO2能使酸性KMnO4溶液、氯水、溴水、FeCl3溶液褪色,是因为具有还原性,不是因为漂白性。
漂白某些有色物质,只能使紫色石蕊试液变红,不能褪色
可漂白大多数有色物质,能使紫色石蕊试液先变红后褪色
(1)SO2和Cl2都能用于漂白,若将SO2和Cl2等物质的量混合通入品红溶液,能达到“强强联合”的漂白效果吗?(宏观辨识与微观探析)
【提示】SO2+Cl2+2H2O====H2SO4+2HCl
(2)SO2能使溴水、KMnO4溶液褪色,与SO2使品红溶液褪色的实质相同吗? (科学探究与创新意识)
【提示】不同。前者体现SO2的还原性,发生的是氧化还原反应,后者体现其漂白性,发生的是非氧化还原反应。
食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用。
2SO2 +O2 2SO3
SO2+2NaOH=Na2SO3+H2O
具有漂白性,能使品红溶液褪色
SO2+CaO===CaSO3
SO2+2H2S=3S↓+2H2O
SO2 SO42-
KMnO4、FeCl3
Cl2、H2O2、O2
Cu、C、HI、H2S
KMnO4、HNO3、Fe3+
Cl2、O2、SO2、Fe3+、 HNO3 、 KMnO4
1. 下列说法中,不正确的是( ) A.硫是一种淡黄色的不溶于水的固体B.硫的化合物常存在于火山喷出的气体中C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
2.区别SO2和CO2气体可选用的方法是( ) A.通入澄清石灰水中 B.通入品红溶液中 C.用带火星的木条检验 D.通入石蕊试液中
3.下列实验不能达到目的的是( )
高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第一单元 含硫化合物的性质优秀课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第一单元 含硫化合物的性质优秀课件ppt,共24页。PPT课件主要包含了学习目标,课程导入,学习探究,学习小结,当堂检测等内容,欢迎下载使用。
必修 第一册专题4 硫与环境保护第一单元 含硫化合物的性质教学课件ppt: 这是一份必修 第一册专题4 硫与环境保护第一单元 含硫化合物的性质教学课件ppt,共39页。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质教案配套ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质教案配套ppt课件,共39页。PPT课件主要包含了学业基础,黑火药,刺激性,无明显,白色沉淀,H2SO4,不稳定的无色物质,答案B,C中溴水褪色,B中出现淡黄色沉淀等内容,欢迎下载使用。













