




高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学课件ppt
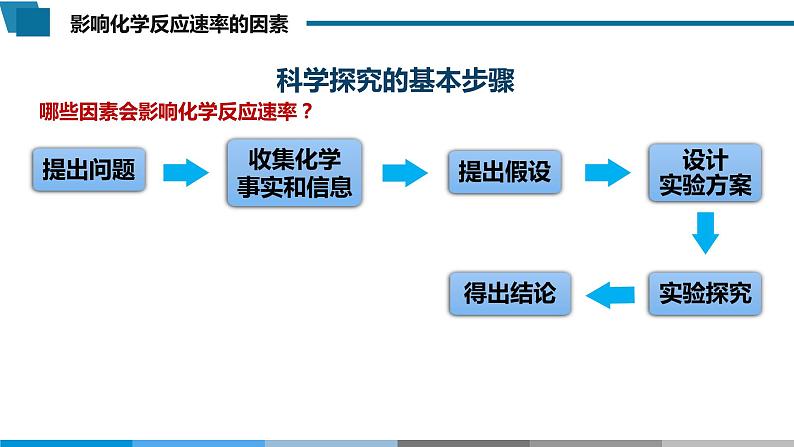
展开哪些因素会影响化学反应速率?
Na与水的反应比Mg与水的反应剧烈
向H2O2中加入MnO2后会迅速分解产生气泡
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快
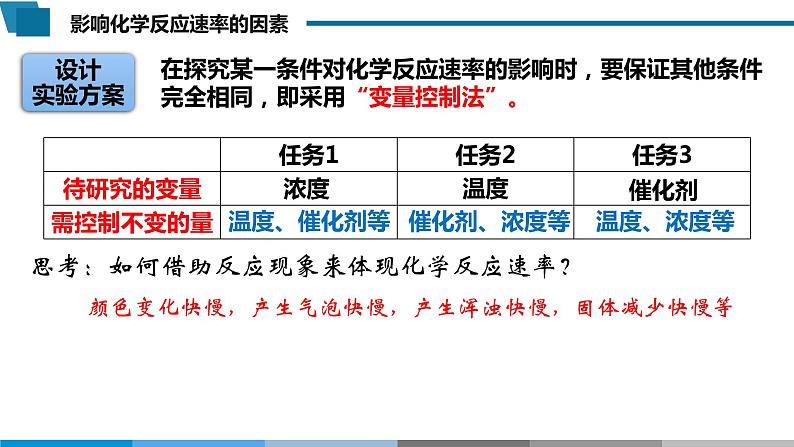
在探究某一条件对化学反应速率的影响时,要保证其他条件完全相同,即采用“变量控制法”。
思考:如何借助反应现象来体现化学反应速率?
颜色变化快慢,产生气泡快慢,产生浑浊快慢,固体减少快慢等
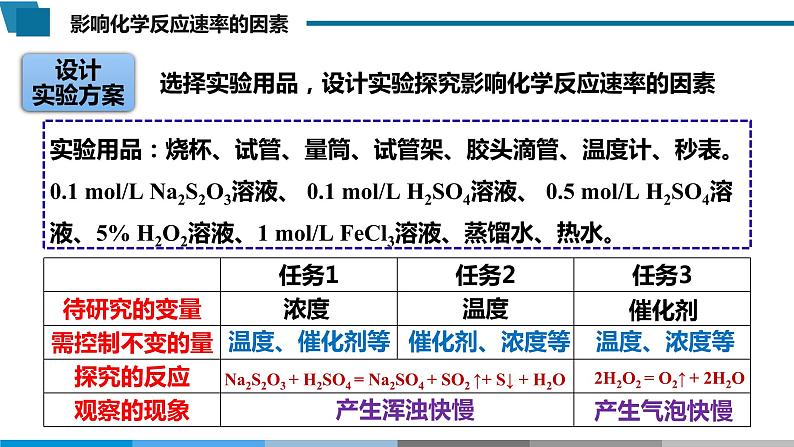
选择实验用品,设计实验探究影响化学反应速率的因素
实验用品:烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。0.1 ml/L Na2S2O3溶液、 0.1 ml/L H2SO4溶液、 0.5 ml/L H2SO4溶液、5% H2O2溶液、1 ml/L FeCl3溶液、蒸馏水、热水。
Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑+ S↓ + H2O
2H2O2 = O2↑ + 2H2O
浓度对化学反应速率的影响
均出现浑浊,但后者出现浑浊更快
增大反应物浓度,化学反应速率增大
(1)固体和纯液体的浓度可视为常数,改变其物质的量,对反应速率无影响。(2)若某物质的浓度变化改变了其性质,反应实质可能发生改变,要具体分析反应速率的变化(如铁与稀硫酸反应,在一定浓度范围内反应速率与浓度有关,但常温下铁遇浓硫酸钝化)。(3)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
温度对化学反应速率的影响
70 ℃热水一组先出现浑浊
升高温度,化学反应速率增大
(1)温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。(2)温度对反应速率的影响,无论固体、液体、气体都适用。(3)大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍,利用这一规律可以对一些化学反应速率进行粗略估算。
催化剂对化学反应速率的影响
前者无明显现象,后者出现大量气泡
催化剂能加快化学反应速率
(1)催化剂只能改变化学反应速率,不能改变反应方向,也不能改变反应热的大小。(2)同一催化剂能同等程度地改变化学反应的正、逆反应速率。
高温、高压、催化剂是为了增大工业合成氨的反应速率
为什么高压可以加快工业合成氨的化学反应速率?
压强对化学反应速率的影响
通过缩小容器体积使压强增大,气体分子间间隙减小,相当于增大反应物浓度,化学反应速率加快
如果压缩固体或液体呢?
压强对反应速率的影响是通过浓度对反应的影响实现的
(1)内因:反应物本身的 是影响化学反应速率的主要因素。(2)外因(其他条件不变,只改变一个条件)
有没有比观察沉淀和气泡生成快慢更准确的方法来分析实验结果呢?
定量研究浓度对化学反应速率的影响
实验结论:在其他条件不变时,反应物浓度越高,反应速率越大。
【思考】在用上述实验测定锌与硫酸反应的速率时:(1)为确保测定的准确性,应注意哪些事项?
①锌的颗粒(即表面积)大小基本相同;②稀硫酸要迅速加入;③装置气密性良好,且计时要迅速准确。
(2)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?
①在恒容反应装置中,测定一段时间内压强的变化;②测定一段时间内H+的浓度变化;③测定一段时间内锌粒的质量变化。
实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
1.控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是A.浓度 B.温度 C.催化剂 D.固体质量
3.亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量ClO2,这是因为A.酸使亚氯酸的氧化性增强B.溶液中的H+起催化作用C.溶液中的Cl-起催化作用D.逸出的ClO2使反应生成物的浓度降低
4.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
A.5 mL 2% H2O2溶液 B.10 mL 2% H2O2溶液C.10 mL 5% H2O2溶液 D.5 mL 10% H2O2溶液
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教学ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教学ppt课件,共47页。PPT课件主要包含了课前·新知导学,能够发生化学反应,有效碰撞,平均能量之差,活化能,反应热,百分数,活化分子百分数,无催化剂,使用催化剂等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 化学反应速率优秀课件ppt: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率优秀课件ppt,共24页。PPT课件主要包含了学习目标,内因主要因素,注意以下两种情况,产生气泡速率较慢,产生气泡速率较快,产生气泡速率很慢,△HE-E,活化能,基元反应等内容,欢迎下载使用。
高中人教版 (2019)第一节 化学反应速率教课ppt课件: 这是一份高中人教版 (2019)第一节 化学反应速率教课ppt课件,文件包含选择性必修1第二章第一节第2课时影响化学反应速率的因素-教学课件pptx、选择性必修1第二章第一节第2课时影响化学反应速率的因素-教学设计docx、选择性必修1第二章第一节第2课时影响化学反应速率的因素-学案docx、选择性必修1第二章第一节第2课时影响化学反应速率的因素-作业设计docx等4份课件配套教学资源,其中PPT共24页, 欢迎下载使用。













