






还剩16页未读,
继续阅读
所属成套资源:全套新人教版高中化学选择性必修2教学PPT课件
成套系列资料,整套一键下载
新人教版高中化学选择性必修2第三章晶体结构与性质本章整合课件
展开
这是一份新人教版高中化学选择性必修2第三章晶体结构与性质本章整合课件,共24页。
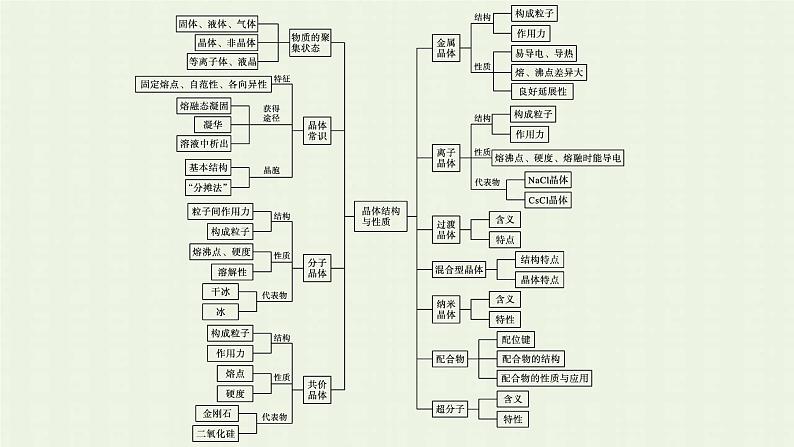
第三章内容索引知识网络·系统构建专题归纳·素养整合知识网络·系统构建专题归纳·素养整合1.“五依据”判断晶体类型(1)依据构成晶体的粒子和粒子间的作用判断。①离子晶体的构成粒子是阴、阳离子,粒子间的作用是离子键。②共价晶体的构成粒子是原子,粒子间的作用是共价键。③分子晶体的构成粒子是分子,粒子间的作用为范德华力或氢键。④金属晶体的构成粒子是金属原子和自由电子,粒子间的作用是金属键。(2)依据物质的类别判断。①金属氧化物(如K2O、Na2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。②大多数非金属单质(金刚石、石墨、晶体硅、晶体硼等除外)、气态氢化物、非金属氧化物(SiO2等除外)、酸、绝大多数有机化合物(有机盐等除外)是分子晶体。③常见的共价晶体单质有金刚石、晶体硅、晶体硼等;常见的共价晶体化合物有碳化硅、二氧化硅等。④金属单质(常温下汞除外)与合金是金属晶体。(3)依据晶体的熔点判断。①离子晶体的熔点较高,常在数百至1 000多摄氏度。②共价晶体的熔点高,常在1 000摄氏度至几千摄氏度。③分子晶体熔点低,常在数百摄氏度以下至很低温度。④金属晶体多数熔点高,但也有相当低的。(4)依据导电性判断。①离子晶体的水溶液及熔融状态时能导电。②共价晶体一般为非导体。③分子晶体为非导体,而分子晶体中的电解质(主要指酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电。④金属晶体是电的良导体。(5)依据硬度和机械性能判断。①离子晶体硬度较大或硬而脆。②共价晶体硬度大。③分子晶体硬度小且较脆。④金属晶体多数硬度大,但也有较低的,且具有延展性。2.“两角度”比较晶体熔、沸点的高低(1)不同类型晶体熔、沸点的比较。①不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。(2)同种类型晶体熔、沸点的比较。①共价晶体:原子半径越小→键长越短→键能越大→熔、沸点越高,如熔点:金刚石>碳化硅>硅。 ②离子晶体: 一般地说,阴、阳离子的电荷数越多,离子半径越小,晶体的熔、沸点越高,如熔点:MgO>MgCl2,NaCl>CsCl。③分子晶体:a.分子间范德华力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。c.组成和结构不相似的分子晶体(相对分子质量接近),其分子的极性越大,熔、沸点越高,如CH3Cl>CH3CH3。d.同分异构体支链越多,熔、沸点越低。④金属晶体:金属离子半径越小,离子所带电荷数越多,其金属键越强,金属晶体的熔、沸点越高,如熔、沸点:Na
第三章内容索引知识网络·系统构建专题归纳·素养整合知识网络·系统构建专题归纳·素养整合1.“五依据”判断晶体类型(1)依据构成晶体的粒子和粒子间的作用判断。①离子晶体的构成粒子是阴、阳离子,粒子间的作用是离子键。②共价晶体的构成粒子是原子,粒子间的作用是共价键。③分子晶体的构成粒子是分子,粒子间的作用为范德华力或氢键。④金属晶体的构成粒子是金属原子和自由电子,粒子间的作用是金属键。(2)依据物质的类别判断。①金属氧化物(如K2O、Na2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。②大多数非金属单质(金刚石、石墨、晶体硅、晶体硼等除外)、气态氢化物、非金属氧化物(SiO2等除外)、酸、绝大多数有机化合物(有机盐等除外)是分子晶体。③常见的共价晶体单质有金刚石、晶体硅、晶体硼等;常见的共价晶体化合物有碳化硅、二氧化硅等。④金属单质(常温下汞除外)与合金是金属晶体。(3)依据晶体的熔点判断。①离子晶体的熔点较高,常在数百至1 000多摄氏度。②共价晶体的熔点高,常在1 000摄氏度至几千摄氏度。③分子晶体熔点低,常在数百摄氏度以下至很低温度。④金属晶体多数熔点高,但也有相当低的。(4)依据导电性判断。①离子晶体的水溶液及熔融状态时能导电。②共价晶体一般为非导体。③分子晶体为非导体,而分子晶体中的电解质(主要指酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电。④金属晶体是电的良导体。(5)依据硬度和机械性能判断。①离子晶体硬度较大或硬而脆。②共价晶体硬度大。③分子晶体硬度小且较脆。④金属晶体多数硬度大,但也有较低的,且具有延展性。2.“两角度”比较晶体熔、沸点的高低(1)不同类型晶体熔、沸点的比较。①不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。(2)同种类型晶体熔、沸点的比较。①共价晶体:原子半径越小→键长越短→键能越大→熔、沸点越高,如熔点:金刚石>碳化硅>硅。 ②离子晶体: 一般地说,阴、阳离子的电荷数越多,离子半径越小,晶体的熔、沸点越高,如熔点:MgO>MgCl2,NaCl>CsCl。③分子晶体:a.分子间范德华力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。c.组成和结构不相似的分子晶体(相对分子质量接近),其分子的极性越大,熔、沸点越高,如CH3Cl>CH3CH3。d.同分异构体支链越多,熔、沸点越低。④金属晶体:金属离子半径越小,离子所带电荷数越多,其金属键越强,金属晶体的熔、沸点越高,如熔、沸点:Na
相关资料
更多









