
专题04 金属- 2022年中考化学考前回归教材必备知识
展开第一章 元素化合物
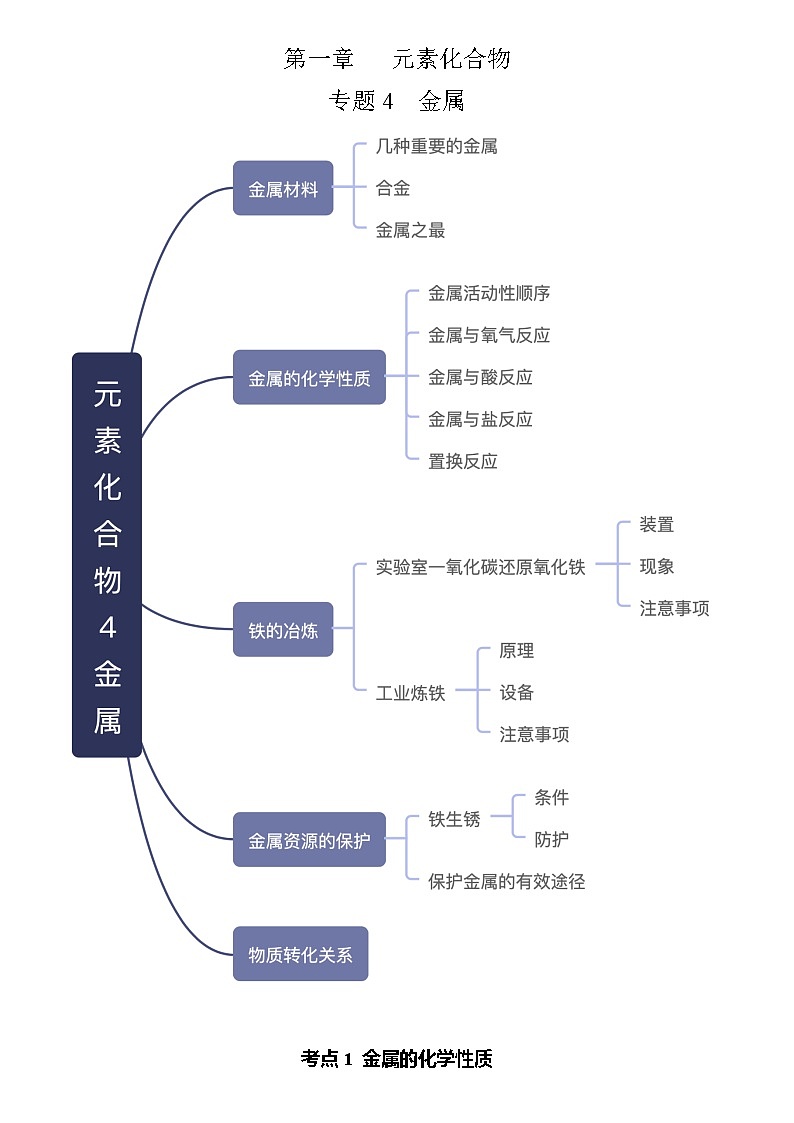
专题4 金属
考点1 金属的化学性质
- 金属材料 :包括纯金属(纯净物)和合金(混合物)
- 金属物理性质:常温下为固体(特殊:汞为液体),
(2)大多数金属呈银白色,特殊:铜(紫红色),金(黄色),铁粉(黑色)(铁片为银白色)
(3)具有优良的导电性、导热性,有延展性
- 合金
(1)概念:在金属中加热融合某些金属或非金属,制得具有金属特征的合金。
合金是混合物 ②形成合金的过程是物理变化 ③合金各成分的化学性质不变
(2)合金的优点
合金和组成其的纯金属相比较,硬度一般更大,熔点一般更低,抗腐蚀性更好
(3)常见的合金
合金 | 铁的合金 | 钛和钛合金 | |
| 生铁 | 钢 | |
成分 | 含碳量2%~4.3% | 含碳量0.03%~2% |
|
备注 | 铁的合金主要含Fe、C, 区别主要是含碳量不同 | 与人体有很好的相容性,用于制造人造骨 | |
- 金属之最
(1)铝:地壳中含量最多的金属元素 (2)钙:人体中含量最多的金属元素
(3)铁:目前世界年产量最多的金属(铁>铝>铜)(4)银:导电、导热性最好的金属(银>铜>金>铝)
考点2 金属的化学性质
1.常见金属在溶液中的活动性顺序 (巧记:捡个大美女;身体细纤轻;总共一百斤)
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
(1)判断不同金属的活动性强弱:金属的位置越靠前,活动性越强。
(2)判断金属能否与酸反应:位于氢之前的金属能置换出稀盐酸、稀硫酸中的氢元素。
(3)判断金属能否与金属化合物溶液反应:位于前面的金属能把位于后面的金属从其化合物的溶液里置换出来。
- 金属与氧气的反应 金属+氧气→金属氧化物 (化合反应)
镁 | 铝 | 铁 | 铜 |
2Mg+O2 = 2MgO | 4Al+3O2 = 2Al2O3 | 3Fe+2O2Fe3O4 | 2Cu+O22CuO |
常温下表面形成氧化膜 | 常温下表面形成 氧化膜 | 铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | 紫红色的铜丝加热后变黑 |
铝具有很好的抗腐蚀性能原因:铝与空气中氧气反应,表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
3.金属与酸的反应: 金属+酸→盐+H2↑ (置换反应) 反应条件:金属活动性排在H前
注意:实验前用砂纸打磨金属,除去镁、铁等金属表面的氧化膜,便于金属与酸接触反应。
4.金属与金属化合物的反应:金属+盐→新盐+新金属 (置换反应)
现象的描述重点:金属表面生成固体的颜色,溶液颜色的变化。
实验 | 铁钉+硫酸铜溶液 | 铜丝+硝酸银溶液 |
现象 | 铁表面有红色固体产生, 溶液由蓝色变为浅绿色。 | 铜表面有银白色固体产生, 溶液由无色逐渐变为蓝色。 |
化学方程式 | Fe+CuSO4 =Cu+FeSO4 | Cu+2AgNO3 =2Ag+Cu(NO3)2 |
5.置换反应
(1)定义:由一种单质生成另一种单质 A+BC→AC+B
(2)置换反应类型
①金属+酸→金属化合物+H2 ②金属+金属化合物→另一金属+另一金属化合物
考点3 铁的冶炼
- 常见的矿石
赤铁矿: 主要成分Fe2O3;磁铁矿: 主要成分Fe3O4 ;铝土矿: 主要成分Al2O3 ;
- 实验室一氧化碳还原氧化铁装置
| A处 | B处 | C处 |
实验现象 | 红棕色粉末逐渐变成黑色 | 澄清石灰水变浑浊 | 产生蓝色火焰 |
化学方程式 | Fe2O3+3CO2Fe+3CO2 | Ca(OH)2 +CO2 = CaCO3↓ + H2O | 2CO + O22CO2 |
- 实验注意事项
(1)先通CO再加热;排尽装置中的空气,防止加热CO与空气的混合气体发生爆炸
(2)停止加热,继续通CO至玻璃管冷却;防止生成的热的铁被空气再次氧化
(3)尾气处理:①点燃,使CO变成无毒的CO2;②在导管末端系一个气球
- 装置改进
优点:节约药品 | 优点:双管集气瓶既可以检验并吸收二氧化碳,还能收集多余的一氧化碳 | 优点:节约能源, 减少空气污染 |
6.工业炼铁 设备:高炉
(1)炼铁的原料:铁矿石、 焦炭、石灰石、空气
(2)反应原理:Fe2O3+3CO2Fe+3CO2
(3)焦炭的作用:
①提供热量( C+O2CO2);②提供还原剂CO(C + CO22CO)
(4)石灰石的作用:将矿石中的二氧化硅变为炉渣
(5)产物:生铁
(6)高炉气体的主要成分:N2、CO、CO2等
处理方法:收集后集中处理,或工业生产中常用于制煤气
考点4 金属资源的保护
- 铁制品锈蚀的条件
与水和氧气同时接触(注:铁纯度,环境温度、湿度也是影响铁生锈的因素,酸、氯化钠会加快生锈)
- 防止铁生锈的原理
隔绝空气(或氧气)和水
- 常见的防锈措施
①表面覆盖一层保护膜:如刷油漆、涂油、烧制搪瓷、烤蓝、镀耐腐蚀的金属如铬等;
- 保护金属资源的途径:
①防止金属的腐蚀; ②回收利用废旧金属;
③有计划、合理的开采矿物,严禁乱采滥挖;④寻找金属的代用品;
(金属回收利用的意义:节约金属资源和能源,减少环境的污染)
考点5 物质转化关系








