2021年上海市虹口区高考二模化学试卷(含答案)
展开虹口区 2020 学年度第二学期期中学生学习能力诊断测试
高三化学 试 卷
2021.04
相对原子质量: H-1 O-16 Mg-24 Ca-40 Fe-56
一、选择题(本题共 40 分,每小题 2 分,每题只有一个正确选项)
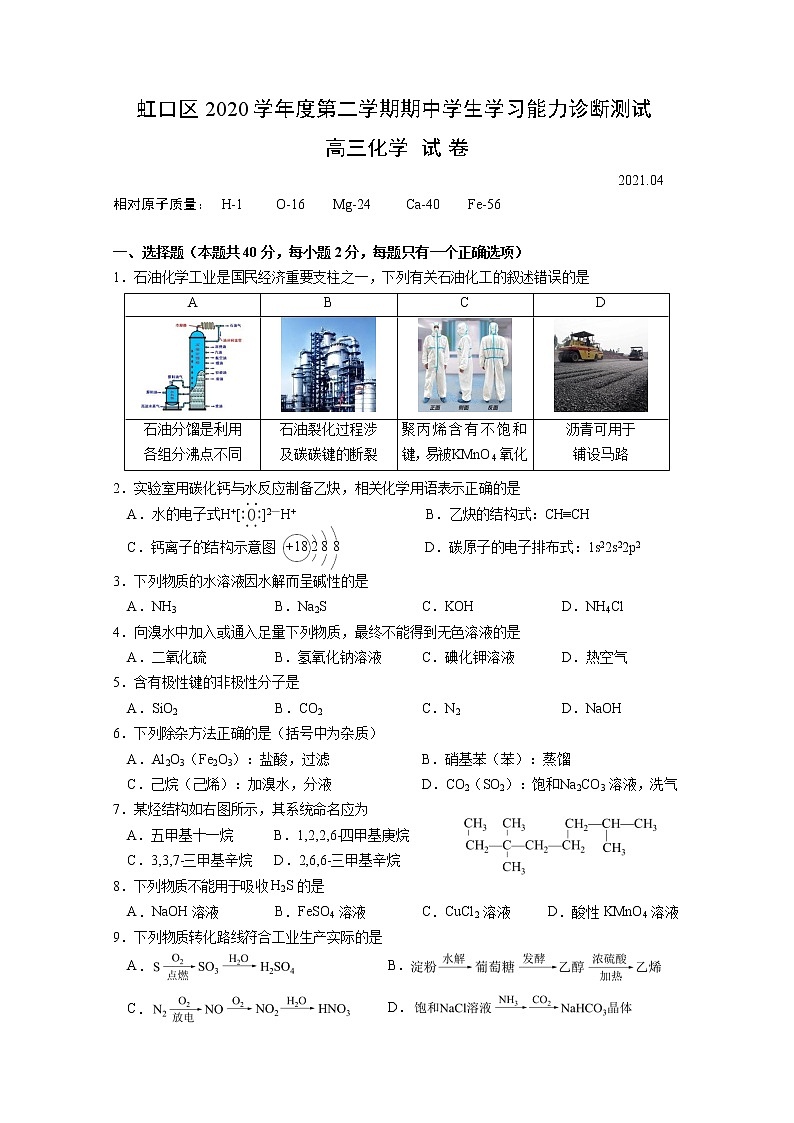
1.石油化学工业是国民经济重要支柱之一,下列有关石油化工的叙述错误的是
A | B | C | D |
石油分馏是利用 各组分沸点不同 | 石油裂化过程涉 及碳碳键的断裂 | 聚丙烯含有不饱和 键,易被 KMnO4 氧化 | 沥青可用于 铺设马路 |
2.实验室用碳化钙与水反应制备乙炔,相关化学用语表示正确的是
A.水的电子式H+[ ]2—H+ B.乙炔的结构式:CH≡CH
C.钙离子的结构示意图 +18 2 8 8 D.碳原子的电子排布式:1s22s22p2
3.下列物质的水溶液因水解而呈碱性的是
A.NH3 B.Na2S C.KOH D.NH4Cl
4.向溴水中加入或通入足量下列物质,最终不能得到无色溶液的是
A.二氧化硫 B.氢氧化钠溶液 C.碘化钾溶液 D.热空气
5.含有极性键的非极性分子是
A.SiO2 B.CO2 C.N2 D.NaOH
6.下列除杂方法正确的是(括号中为杂质)
A.Al2O3(Fe2O3):盐酸,过滤 B.硝基苯(苯):蒸馏
C.己烷(己烯):加溴水,分液 D.CO2(SO2):饱和 Na2CO3 溶液,洗气
7.某烃结构如右图所示,其系统命名应为
A.五甲基十一烷 B.1,2,2,6-四甲基庚烷
C.3,3,7-三甲基辛烷 D.2,6,6-三甲基辛烷
8.下列物质不能用于吸收 H2S 的是
A.NaOH 溶液 B.FeSO4 溶液 C.CuCl2 溶液 D.酸性KMnO4 溶液
9.下列物质转化路线符合工业生产实际的是
A.
C.
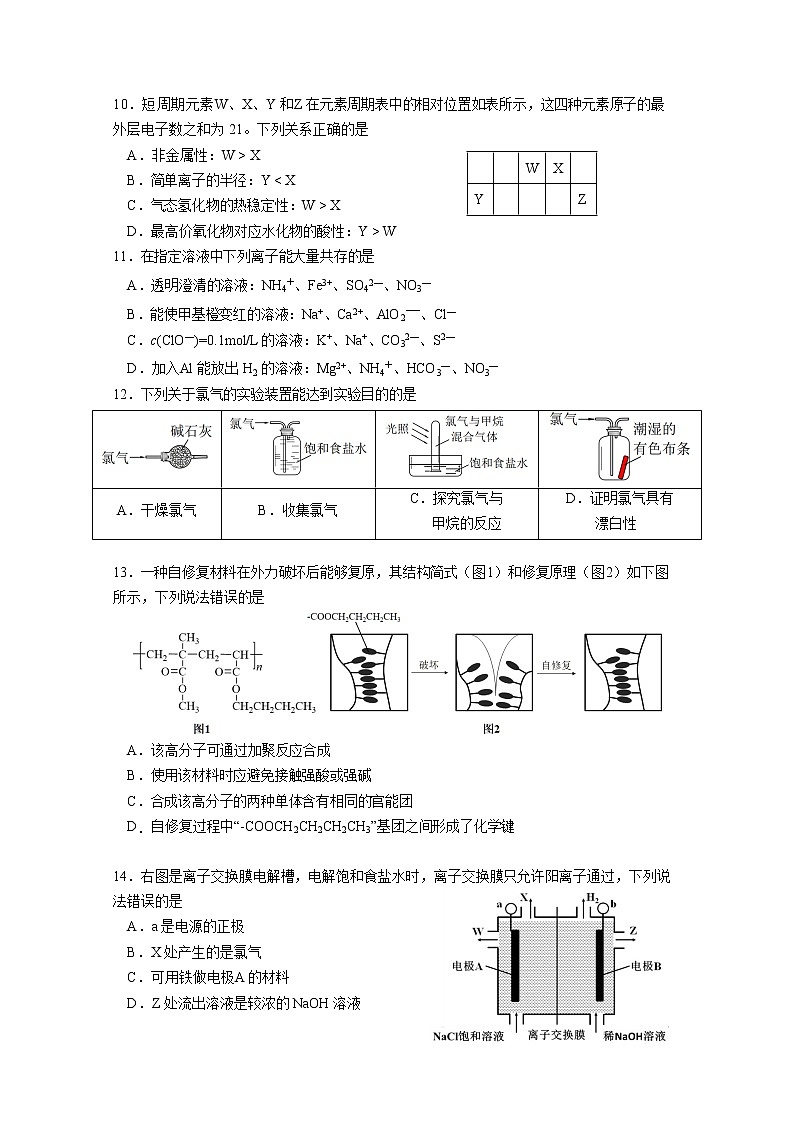
10.短周期元素W、X、Y 和 Z 在元素周期表中的相对位置如表所示,这四种元素原子的最
外层电子数之和为 21。下列关系正确的是
|
| W | X |
|
Y |
|
|
| Z |
A.非金属性:W > X
B.简单离子的半径:Y < X
C.气态氢化物的热稳定性:W > X
D.最高价氧化物对应水化物的酸性:Y > W
11.在指定溶液中下列离子能大量共存的是
A.透明澄清的溶液:NH4+、Fe3+、SO42—、NO3—
B.能使甲基橙变红的溶液:Na+、Ca2+、AlO2—、Cl—
C.c(ClO—)=0.1mol/L 的溶液:K+、Na+、CO32—、S2—
D.加入Al 能放出 H2 的溶液:Mg2+、NH4+、HCO3—、NO3—
12.下列关于氯气的实验装置能达到实验目的的是
A.干燥氯气 | B.收集氯气 | C.探究氯气与 甲烷的反应 | D.证明氯气具有 漂白性 |
13.一种自修复材料在外力破坏后能够复原,其结构简式(图 1)和修复原理(图 2)如下图所示,下列说法错误的是
A.该高分子可通过加聚反应合成
B.使用该材料时应避免接触强酸或强碱
C.合成该高分子的两种单体含有相同的官能团
D.自修复过程中“-COOCH2CH2CH2CH3”基团之间形成了化学键
14.右图是离子交换膜电解槽,电解饱和食盐水时,离子交换膜只允许阳离子通过,下列说法错误的是
A.a 是电源的正极
B.X 处产生的是氯气
C.可用铁做电极A 的材料
D.Z 处流出溶液是较浓的 NaOH 溶液
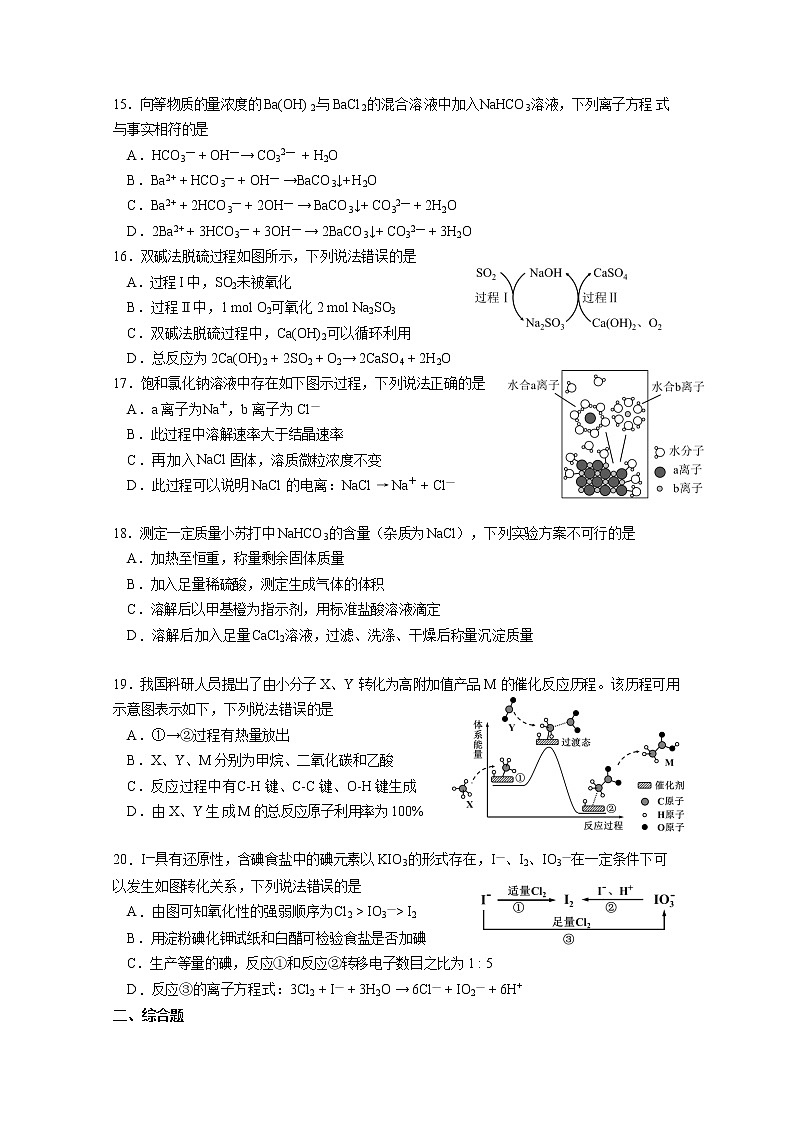
15.向等物质的量浓度的 Ba(OH) 2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程 式与事实相符的是
A.HCO3— + OH—→ CO32— + H2O
B.Ba2+ + HCO3— + OH— →BaCO3↓+ H2O
C.Ba2+ + 2HCO3— + 2OH— → BaCO3↓+ CO32— + 2H2O
D.2Ba2+ + 3HCO3— + 3OH— → 2BaCO3↓+ CO32— + 3H2O
16.双碱法脱硫过程如图所示,下列说法错误的是
A.过程 I 中,SO2未被氧化
B.过程Ⅱ中,1 mol O2可氧化 2 mol Na2SO3
C.双碱法脱硫过程中,Ca(OH)2可以循环利用
D.总反应为 2Ca(OH)2 + 2SO2 + O2→ 2CaSO4 + 2H2O
17.饱和氯化钠溶液中存在如下图示过程,下列说法正确的是
A.a 离子为Na+,b 离子为 Cl—
B.此过程中溶解速率大于结晶速率
C.再加入NaCl 固体,溶质微粒浓度不变
D.此过程可以说明NaCl 的电离:NaCl → Na+ + Cl—
18.测定一定质量小苏打中 NaHCO3的含量(杂质为 NaCl),下列实验方案不可行的是
A.加热至恒重,称量剩余固体质量
B.加入足量稀硫酸,测定生成气体的体积
C.溶解后以甲基橙为指示剂,用标准盐酸溶液滴定
D.溶解后加入足量CaCl2溶液,过滤、洗涤、干燥后称量沉淀质量
19.我国科研人员提出了由小分子 X、Y 转化为高附加值产品 M 的催化反应历程。该历程可用示意图表示如下,下列说法错误的是
A.①→②过程有热量放出
B.X、Y、M 分别为甲烷、二氧化碳和乙酸
C.反应过程中有C-H 键、C-C 键、O-H 键生成
D.由 X、Y 生成M 的总反应原子利用率为 100%
20.I—具有还原性,含碘食盐中的碘元素以 KIO3的形式存在,I—、I2、IO3—在一定条件下可以发生如图转化关系,下列说法错误的是
A.由图可知氧化性的强弱顺序为Cl2 > IO3—> I2
B.用淀粉碘化钾试纸和白醋可检验食盐是否加碘
C.生产等量的碘,反应①和反应②转移电子数目之比为 1 : 5
D.反应③的离子方程式:3Cl2 + I— + 3H2O → 6Cl— + IO2— + 6H+
二、综合题
(一)本题共 15 分
镁元素在自然界分布广泛,是人体的必需元素之一。工业上可用硅热法(Pidgeon 法)冶炼镁,以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(含硅 75%)混合置于密闭还原炉,1200℃下发生反应:
2(CaO·MgO)(s) + Si(s) Ca2SiO4 (l) + 2Mg(g)
完成下列填空:
21.已知还原性 Mg > Si,上述反应仍能发生的原因是_________________________________
_______________________________________________________________________________。
22.由右图推测上述反应正向为______________(填“吸热”或“放热”)反应。
23.若还原炉体积不变,能证明上述反应达到平衡的是________(选填序号)。
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内 Ca2SiO4与CaO·MgO 的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 : n(Ca2SiO4)生成 = 2: 1
24.平衡后若其他条件不变,将还原炉体积缩小一半,
则达到新平衡时 Mg(g)的浓度将______________(填“升高”“降低”或“不变”)。
25.若还原炉容积为 400 m3,原料中煅白质量为 9600 kg,5 小时后,
测得煅白的转化率为 50%,计算这段时间内 Mg 的生成速率________________mol/(L·h)。
26.工业上也可用电解法来制备镁。相关化合物的熔点如下表所示:
| MgCl2 | MgO |
熔点 /℃ | 712 | 2850 |
(1)镁原子核外有________种能量不同的电子,它们的运动状态有__________种。
(2)MgCl2的电子式为_____________________;
(3)判断工业上应选择 MgCl2还是 MgO 作为电解原料并说明理由。
_______________________________________________________________________________
_______________________________________________________________________________
(二)本题共 15 分
NaClO2 是一种高效氧化剂和优质漂白剂,一种“二氧化氯泡腾片”有效成分为 NaClO2、NaHCO3、NaHSO4,该泡腾片能快速溶于水,产生大量气泡,得到 ClO2溶液。
完成下列填空:
27.“二氧化氯泡腾片”使用过程中产生ClO2的反应为:
____ ClO2—+____ ________ → ____ Cl— +____ ClO2 +____ H2O
完成并配平上述化学方程式,标出电子转移方向与数目。
氧化剂与还原剂的物质的量之比为__________________。
28.“二氧化氯泡腾片” 使用过程中“产生大量气泡”的离子方程式为:
________________________________________________________________________。
常温下,向 20 mL 某新制氯水中逐滴滴入相同物质的量浓度的氢氧化钠溶液,pH 变化与加入NaOH 溶液体积关系(不考虑HClO 分解)如下图所示。
29.①→②过程中,水的电离程度的变化是_______________。
30.用离子方程式表示点③所示溶液中存在的水解平衡:
_____________________________________________________。
31.在②点所示溶液中,用“>、<或 =”判断下列关系:
(1)V1 ____________40 mL;
(2)[Cl—] ___________ [ClO—] + [HClO]。
(三) 本题共 14 分
化合物 M 是一种天然产物合成中的重要中间体,其合成路线如下
已知:
完成下列填空:
32.写出反应类型:反应①______________________,反应②______________________
33.写出 X 的结构简式:_______________________________
34.仅以 B 为单体形成的高分子的结构简式为_________________________________。
35.检验 D 中含有碳碳双键的实验方法是__________________________________________。
36.写出同时满足下列条件的C 的一种同分异构体的结构简式________________________。
ⅰ. 含有苯环,分子中只含三种化学环境不同的氢原子
ⅱ. 能发生银镜反应,1 mol 该同分异构体最多能生成 4 mol Ag
37.设计以 和 为原料制备 的合成路线。
(四)本题共 16 分
葡萄糖酸亚铁(C6H11O7)2Fe(M = 446 g·mol-1)易溶于水,几乎不溶于乙醇,是常用的补铁剂。工业上制备葡萄糖酸亚铁的方法之一是用新制的碳酸亚铁与葡萄糖酸反应,其流程为:
完成下列填空:
38.反应Ⅰ的实验室模拟装置如下图所示:
稀硫酸
铁屑
碳酸钠溶液
B C
为成功制得碳酸亚铁,需依次进行如下操作,分析操作的目的:
操作 | 内容 | 目的 |
① | 实验开始时先打开K1、K3,关闭 K2 |
|
② | 待 B 中反应即将结束时再打开K2,关闭K1、K3 |
|
39.反应Ⅰ结束后将浊液过滤,洗涤。写出检验碳酸亚铁是否洗净的实验操作。
__________________________________________________________________。
40.反应Ⅱ的化学方程式为_________________________________________________________
(葡萄糖酸用化学式表示)。
41.反应Ⅱ结束后加入葡萄糖酸调节溶液 pH 至 5.8 左右再进行结晶,目的是________________
_________________________________________________________。结晶时加入乙醇可以提高葡萄糖酸亚铁的析出率,原因是____________________________________________________。
42.为测定(C6H11O7)2Fe·nH2O 的结晶水数目,称取 1.205 g 晶体,在氢气流中加热至 600℃使其完全分解,最终得到 0.140 g 铁单质。
晶体中结晶水数目 n =______________。
若最终得到固体中含有少量 Fe3+,则 n 的值_______________(选填“偏大”“偏小”或“不变”)。
2021虹口二模参考答案
一、(本题共 40 分)
1-10 CDBCB BDBDB 11-20 ACDCB CCDCC
二、综合题
(一)本题共 15 分
21.该反应条件下,镁为气体,从反应体系逸出,使平衡不断正向移动。(2 分)
22.吸热;(2 分)
23.c (2 分)
24.不变 (2 分)
25. 0.025mol/(L·h) (2 分)
26.(1) 4 12 (各 1 分)
(2) (1 分)
(3)选择 MgCl2,原因是 MgCl2 熔点低,能耗小。 (2 分)
(二)本题共 15 分
27. 5_ClO2- + _4_H+ → _1_Cl- + _4 ClO2 + _2 H2O
(配平、电子转移方向与数目共 3 分) 1:4(2 分)
28.H++HCO3-→H2O+CO2↑(2 分)
29.变大 (2 分)
30.ClO- + H2O HClO + OH- (2 分)
31.(1)< (2 分) (2)= (2 分)
(三) 本题共 14 分
32. 取代(1 分);加成(1 分)
33. (2 分) 34. (2 分)
35. 取样,加入足量银氨溶液水浴加热,充分反应后加入稀硝酸酸化,再加入溴水,溴水褪色, 说明D 中含有碳碳双键(3 分,或取样后加入溴的四氯化碳溶液,溴的颜色褪去,说明D 中含有碳碳双键)
36.(任写一种,2 分)(方框为苯环)
37. (3 分)
(四) 本题共 16 分
38.生成硫酸亚铁,并用生成的 H2排尽装置内空气(2 分);利用氢气将 FeSO4溶液压入 C
中与Na2CO3反应(2 分)
39.取最后一次洗涤液,加入稀盐酸酸化,再加入BaCl2溶液,无沉淀产生,说明碳酸亚铁已洗净(2 分)
40. FeCO3+ 2C6H12O7 → (C6H12O7)2Fe + H2O + CO2↑(2 分)
41. 抑制 Fe2+水解(2 分);葡萄糖酸亚铁几乎不溶于乙醇(2 分)
42. 2(2 分);偏小(2 分)
2021年上海市虹口区高考化学二模试卷: 这是一份2021年上海市虹口区高考化学二模试卷,共38页。试卷主要包含了选择题,综合题本题共15分,综合题共15分,综合题共14分,解答题等内容,欢迎下载使用。
2023年上海市虹口区高考二模化学答案: 这是一份2023年上海市虹口区高考二模化学答案,共2页。试卷主要包含了综合题等内容,欢迎下载使用。
2023年上海市虹口区高考二模化学试卷: 这是一份2023年上海市虹口区高考二模化学试卷,共9页。试卷主要包含了5 Ba-137, 下列离子方程式正确的是等内容,欢迎下载使用。












