




还剩36页未读,
继续阅读
所属成套资源:人教版选择性必修第二册高中化学课件PPT
成套系列资料,整套一键下载
高中化学第三章晶体结构与性质章末整合课件新人教版选择性必修第二册
展开
这是一份高中化学第三章晶体结构与性质章末整合课件新人教版选择性必修第二册,共44页。
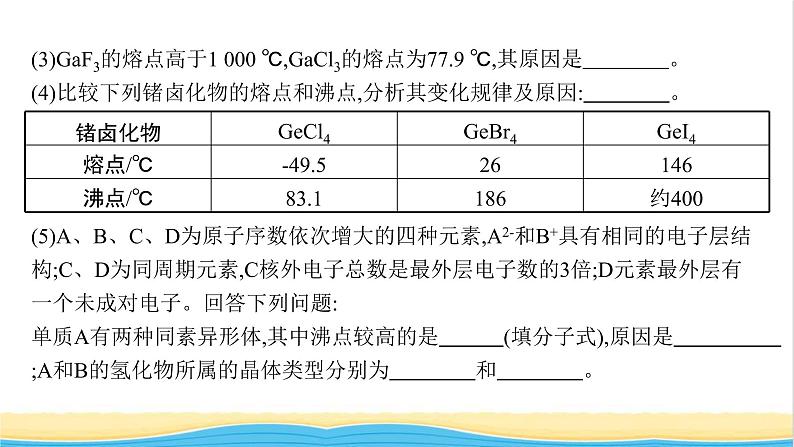
第三章2021知识网络专题突破典例1(高考题改编)完成下列空白:(1)苯胺( )的晶体类型是 。苯胺与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是 。 (2)一些氧化物的熔点如表所示:解释表中氧化物之间熔点差异的原因: 。Fe、Co、Ni是三种重要的金属元素,这三种元素+2价氧化物的晶胞类型相同,其熔点由高到低的顺序为 。 (3)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是 。 (4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因: 。 (5)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子层结构;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:单质A有两种同素异形体,其中沸点较高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。 答案 (1)分子晶体 苯胺分子之间存在氢键(2)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。离子键强弱:MgO>Li2O;分子间作用力强弱:P4O6> NiO>CoO>FeO(3)GaF3为离子晶体,GaCl3为分子晶体(4)GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是锗的卤化物分子结构相似,随相对分子质量的增大,分子间作用力逐渐增强(5)O3 O3相对分子质量较大且分子具有弱极性,分子间范德华力大 分子晶体 离子晶体解析 (1)苯胺为有机化合物,结合题给信息中苯胺的熔、沸点可知,苯胺为分子晶体。苯胺分子中有—NH2,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢键可使分子晶体的熔、沸点较高。(2)氧化锂、氧化镁是离子晶体,六氧化四磷和二氧化硫是分子晶体,离子键比分子间作用力强。因为Fe、Co、Ni的+2价氧化物是离子化合物,Fe2+、Co2+、Ni2+的半径依次减小,形成的离子键依次增强,熔点依次升高,故熔点顺序是NiO>CoO>FeO。方法点拨晶体熔、沸点高低的判断方法四种晶体熔、沸点的高低,取决于组成晶体的粒子间作用力的大小,粒子间作用力越大,晶体的熔、沸点就越高;粒子间的作用力越小,其熔、沸点就越低,具体有以下规律:一般来说,不同晶体类型的物质的熔、沸点存在如下关系:共价晶体>离子晶体>分子晶体。同类型晶体熔、沸点的比较如下:(1)分子晶体熔、沸点的高低取决于分子间作用力的大小,而分子间作用力与其相对分子质量的大小及分子的极性有关。①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点就越高。②组成和结构不相似的物质(相对分子质量相近),分子的极性越大,其熔、沸点就越高。③同分异构体的比较。一般是支链越多,熔、沸点越低。结构越对称,沸点越低。例如,沸点:邻二甲苯>间二甲苯>对二甲苯。④氢键的影响。若分子间可以形成氢键,则分子间作用力比结构相似的同类物质大,熔、沸点较高。例如,沸点:HF>HI>HBr>HCl。(2)共价晶体熔、沸点的高低取决于共价键的强弱,键能越大,键长越小,共价键越强,熔、沸点就越高。例如,熔、沸点:金刚石>金刚砂(SiC)>晶体硅。(3)离子晶体一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。(4)金属晶体①熔、沸点的高低取决于金属键的强弱,离子半径越小,阳离子所带的电荷越多,金属键越强,其熔、沸点就越高。例如,熔点:Al>Mg>Na。②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。对点训练 1-1下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )A.食盐和蔗糖熔化 B.钠和硫熔化C.碘和干冰升华 D.二氧化硅和氧化钠熔化答案 C解析 根据构成晶体的粒子种类(离子、原子、分子等),以及粒子之间相互作用的强弱不同来判断。A项中食盐为离子晶体,蔗糖为分子晶体;B项中钠为金属晶体,硫为分子晶体;D项中SiO2为共价晶体,Na2O为离子晶体,以上三组物质均不属于同类晶体,其粒子间相互作用也就不属于同种类型。选项C,碘和干冰均属于分子晶体,二者升华都是克服范德华力,属于同种类型。对点训练 1-2四种物质的某些性质如下表所示: 晶体类型:单质硫是 晶体;单质硼是 晶体;氯化铝是 晶体;苛性钾是 晶体。 答案 分子 共价 分子 离子解析 单质硫为非金属单质,由于其熔、沸点都较低,则晶体为分子晶体;单质硼为非金属单质,其熔、沸点都很高,则晶体为共价晶体;氯化铝为化合物,其熔、沸点都较低,并能在较低温度下升华,则晶体为分子晶体;苛性钾为化合物,其熔、沸点较高,晶体不导电,熔融态导电,则晶体为离子晶体。典例2(高考题改编)完成下列空白:(1)氧与钠所形成的一种离子化合物Na2O晶体的晶胞如图所示,则图中黑球代表的离子是 (填离子符号)。 (2)某镍白铜合金的立方晶胞结构如图所示。①晶胞中铜原子与镍原子的数量比为 。 ②若合金的密度为d g·cm-3,晶胞参数a= nm。 (3)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为 ,Ga与As以 键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为 。 (4)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为 。则D原子的坐标参数为 。 ②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为 g·cm-3(列出计算式即可)。 解析 (1)由“均摊法”可知晶胞中白球有4个,黑球有8个,由化学式Na2O可知黑球代表钠离子。方法点拨1.均摊法确定晶胞的化学组成(1)方法晶胞中任意位置上的一个原子如果是被n个晶胞所共有,那么,每个原子对这个晶胞的贡献就是 。(2)类型①长方体(含正方体)晶胞中不同位置的粒子对晶胞的贡献:②非长方体晶胞中粒子对晶胞的贡献视具体情况而定。如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为 。再如图所示的正三棱柱形晶胞中:2.晶体密度及微粒间距离的计算(1)计算晶体密度的方法(2)微粒间距离的计算方法:依据粒子半径和晶胞结构,利用立体几何知识计算。3.熟悉几种常见的晶胞结构及晶胞含有的粒子数目 A.NaCl型(含4个Na+,4个Cl-)B.干冰型(含4个CO2)C.CaF2型(含4个Ca2+,8个F-)D.金刚石型(含8个C)E.体心立方(含2个原子)F.面心立方(含4个原子)对点训练 2完成下列空白:(1)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p能级上有4个电子。元素Z的原子最外层电子数是其内层的3倍。X与Y所形成的化合物晶体的晶胞如图所示。①在1个晶胞中,X离子的数目为 。 ②该化合物的化学式为 。 (2)RCl可用作有机合成催化剂,并用于颜料、防腐等工业。R+中所有电子正好充满K、L、M三个电子层,它与Cl-形成的晶体结构如图所示。R的元素符号是 ,与同一个Cl-相连的R+有 个。 (3)ZnS的晶胞结构如图所示,其晶胞边长为x pm,则ZnS晶体的密度为 g·cm-3(列式即可,NA表示阿伏加德罗常数的值);a与b之间的距离为 pm(用含x的式子表示)。 解析 (1)X的核外电子排布式为[Ar]3d104s2,则X为Zn;Y的核外电子排布式为1s22s22p63s23p4,则Y为S;Z为O。一个晶胞中Zn2+的数目= =4,S2-的数目=4(4个S2-在晶胞内部)。(2)R+中所有电子正好充满K、L、M三个电子层,说明R+的电子排布式为1s22s22p63s23p63d10,是铜元素,从图中看出,一个R+与4个Cl-相连,同理与同一个Cl-相连的R+有4个。【实验目的】1.加深对配合物的认识。2.了解配合物的形成。【实验用品】实验仪器:试管、胶头滴管;实验试剂:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇、氯化钡溶液、氢氧化钠溶液、浓硝酸。【实验过程和结论】1.简单配合物的形成提示 (1)生成蓝色絮状沉淀 Cu2++2NH3·H2O→Cu(OH)2↓+2 蓝色絮状沉淀溶解,得到深蓝色溶液 Cu(OH)2+4NH3 ===[Cu(NH3)4]2++2OH-析出深蓝色的晶体 乙醇的极性较小,降低了盐的溶解度(2)生成白色沉淀 Ag++Cl- === AgCl↓ 白色沉淀溶解,得到无色溶液 AgCl+2NH3 ===[Ag(NH3)2]++Cl-2.简单离子与配离子的区别 提示 (1)溶液变红色 Fe3+可与SCN-形成红色的配离子 (2)无明显现象 K3[Fe(CN)6]与SCN-不能形成红色物质【拓展实验】配合物的性质 提示 【问题讨论】(1)画出[Cu(NH3)4]2+的结构式。提示 (2)K3[Fe(CN)6]在水中可电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体各是什么?配位数是多少?[Fe(CN)6]3-和Fe3+的性质一样吗?提示 [Fe(CN)6]3-的中心离子是Fe3+;配体是CN-;配位数是6;[Fe(CN)6]3-与Fe3+的性质不一样。(3)结合上述实验探究,分析[Cu(H2O)4]2+和[Cu(NH3)4]2+哪一个离子更稳定?原因是什么?提示 [Cu(NH3)4]2+更稳定。配位原子电负性越小,越易给出孤电子对,生成的配合物越稳定。(4)写出[Cu(NH3)4]SO4在水中的电离方程式。提示 [Cu(NH3)4]SO4 ===[Cu(NH3)4]2++
第三章2021知识网络专题突破典例1(高考题改编)完成下列空白:(1)苯胺( )的晶体类型是 。苯胺与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是 。 (2)一些氧化物的熔点如表所示:解释表中氧化物之间熔点差异的原因: 。Fe、Co、Ni是三种重要的金属元素,这三种元素+2价氧化物的晶胞类型相同,其熔点由高到低的顺序为 。 (3)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是 。 (4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因: 。 (5)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子层结构;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:单质A有两种同素异形体,其中沸点较高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。 答案 (1)分子晶体 苯胺分子之间存在氢键(2)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。离子键强弱:MgO>Li2O;分子间作用力强弱:P4O6> NiO>CoO>FeO(3)GaF3为离子晶体,GaCl3为分子晶体(4)GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是锗的卤化物分子结构相似,随相对分子质量的增大,分子间作用力逐渐增强(5)O3 O3相对分子质量较大且分子具有弱极性,分子间范德华力大 分子晶体 离子晶体解析 (1)苯胺为有机化合物,结合题给信息中苯胺的熔、沸点可知,苯胺为分子晶体。苯胺分子中有—NH2,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢键可使分子晶体的熔、沸点较高。(2)氧化锂、氧化镁是离子晶体,六氧化四磷和二氧化硫是分子晶体,离子键比分子间作用力强。因为Fe、Co、Ni的+2价氧化物是离子化合物,Fe2+、Co2+、Ni2+的半径依次减小,形成的离子键依次增强,熔点依次升高,故熔点顺序是NiO>CoO>FeO。方法点拨晶体熔、沸点高低的判断方法四种晶体熔、沸点的高低,取决于组成晶体的粒子间作用力的大小,粒子间作用力越大,晶体的熔、沸点就越高;粒子间的作用力越小,其熔、沸点就越低,具体有以下规律:一般来说,不同晶体类型的物质的熔、沸点存在如下关系:共价晶体>离子晶体>分子晶体。同类型晶体熔、沸点的比较如下:(1)分子晶体熔、沸点的高低取决于分子间作用力的大小,而分子间作用力与其相对分子质量的大小及分子的极性有关。①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点就越高。②组成和结构不相似的物质(相对分子质量相近),分子的极性越大,其熔、沸点就越高。③同分异构体的比较。一般是支链越多,熔、沸点越低。结构越对称,沸点越低。例如,沸点:邻二甲苯>间二甲苯>对二甲苯。④氢键的影响。若分子间可以形成氢键,则分子间作用力比结构相似的同类物质大,熔、沸点较高。例如,沸点:HF>HI>HBr>HCl。(2)共价晶体熔、沸点的高低取决于共价键的强弱,键能越大,键长越小,共价键越强,熔、沸点就越高。例如,熔、沸点:金刚石>金刚砂(SiC)>晶体硅。(3)离子晶体一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。(4)金属晶体①熔、沸点的高低取决于金属键的强弱,离子半径越小,阳离子所带的电荷越多,金属键越强,其熔、沸点就越高。例如,熔点:Al>Mg>Na。②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。对点训练 1-1下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )A.食盐和蔗糖熔化 B.钠和硫熔化C.碘和干冰升华 D.二氧化硅和氧化钠熔化答案 C解析 根据构成晶体的粒子种类(离子、原子、分子等),以及粒子之间相互作用的强弱不同来判断。A项中食盐为离子晶体,蔗糖为分子晶体;B项中钠为金属晶体,硫为分子晶体;D项中SiO2为共价晶体,Na2O为离子晶体,以上三组物质均不属于同类晶体,其粒子间相互作用也就不属于同种类型。选项C,碘和干冰均属于分子晶体,二者升华都是克服范德华力,属于同种类型。对点训练 1-2四种物质的某些性质如下表所示: 晶体类型:单质硫是 晶体;单质硼是 晶体;氯化铝是 晶体;苛性钾是 晶体。 答案 分子 共价 分子 离子解析 单质硫为非金属单质,由于其熔、沸点都较低,则晶体为分子晶体;单质硼为非金属单质,其熔、沸点都很高,则晶体为共价晶体;氯化铝为化合物,其熔、沸点都较低,并能在较低温度下升华,则晶体为分子晶体;苛性钾为化合物,其熔、沸点较高,晶体不导电,熔融态导电,则晶体为离子晶体。典例2(高考题改编)完成下列空白:(1)氧与钠所形成的一种离子化合物Na2O晶体的晶胞如图所示,则图中黑球代表的离子是 (填离子符号)。 (2)某镍白铜合金的立方晶胞结构如图所示。①晶胞中铜原子与镍原子的数量比为 。 ②若合金的密度为d g·cm-3,晶胞参数a= nm。 (3)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为 ,Ga与As以 键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为 。 (4)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为 。则D原子的坐标参数为 。 ②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为 g·cm-3(列出计算式即可)。 解析 (1)由“均摊法”可知晶胞中白球有4个,黑球有8个,由化学式Na2O可知黑球代表钠离子。方法点拨1.均摊法确定晶胞的化学组成(1)方法晶胞中任意位置上的一个原子如果是被n个晶胞所共有,那么,每个原子对这个晶胞的贡献就是 。(2)类型①长方体(含正方体)晶胞中不同位置的粒子对晶胞的贡献:②非长方体晶胞中粒子对晶胞的贡献视具体情况而定。如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为 。再如图所示的正三棱柱形晶胞中:2.晶体密度及微粒间距离的计算(1)计算晶体密度的方法(2)微粒间距离的计算方法:依据粒子半径和晶胞结构,利用立体几何知识计算。3.熟悉几种常见的晶胞结构及晶胞含有的粒子数目 A.NaCl型(含4个Na+,4个Cl-)B.干冰型(含4个CO2)C.CaF2型(含4个Ca2+,8个F-)D.金刚石型(含8个C)E.体心立方(含2个原子)F.面心立方(含4个原子)对点训练 2完成下列空白:(1)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p能级上有4个电子。元素Z的原子最外层电子数是其内层的3倍。X与Y所形成的化合物晶体的晶胞如图所示。①在1个晶胞中,X离子的数目为 。 ②该化合物的化学式为 。 (2)RCl可用作有机合成催化剂,并用于颜料、防腐等工业。R+中所有电子正好充满K、L、M三个电子层,它与Cl-形成的晶体结构如图所示。R的元素符号是 ,与同一个Cl-相连的R+有 个。 (3)ZnS的晶胞结构如图所示,其晶胞边长为x pm,则ZnS晶体的密度为 g·cm-3(列式即可,NA表示阿伏加德罗常数的值);a与b之间的距离为 pm(用含x的式子表示)。 解析 (1)X的核外电子排布式为[Ar]3d104s2,则X为Zn;Y的核外电子排布式为1s22s22p63s23p4,则Y为S;Z为O。一个晶胞中Zn2+的数目= =4,S2-的数目=4(4个S2-在晶胞内部)。(2)R+中所有电子正好充满K、L、M三个电子层,说明R+的电子排布式为1s22s22p63s23p63d10,是铜元素,从图中看出,一个R+与4个Cl-相连,同理与同一个Cl-相连的R+有4个。【实验目的】1.加深对配合物的认识。2.了解配合物的形成。【实验用品】实验仪器:试管、胶头滴管;实验试剂:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇、氯化钡溶液、氢氧化钠溶液、浓硝酸。【实验过程和结论】1.简单配合物的形成提示 (1)生成蓝色絮状沉淀 Cu2++2NH3·H2O→Cu(OH)2↓+2 蓝色絮状沉淀溶解,得到深蓝色溶液 Cu(OH)2+4NH3 ===[Cu(NH3)4]2++2OH-析出深蓝色的晶体 乙醇的极性较小,降低了盐的溶解度(2)生成白色沉淀 Ag++Cl- === AgCl↓ 白色沉淀溶解,得到无色溶液 AgCl+2NH3 ===[Ag(NH3)2]++Cl-2.简单离子与配离子的区别 提示 (1)溶液变红色 Fe3+可与SCN-形成红色的配离子 (2)无明显现象 K3[Fe(CN)6]与SCN-不能形成红色物质【拓展实验】配合物的性质 提示 【问题讨论】(1)画出[Cu(NH3)4]2+的结构式。提示 (2)K3[Fe(CN)6]在水中可电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体各是什么?配位数是多少?[Fe(CN)6]3-和Fe3+的性质一样吗?提示 [Fe(CN)6]3-的中心离子是Fe3+;配体是CN-;配位数是6;[Fe(CN)6]3-与Fe3+的性质不一样。(3)结合上述实验探究,分析[Cu(H2O)4]2+和[Cu(NH3)4]2+哪一个离子更稳定?原因是什么?提示 [Cu(NH3)4]2+更稳定。配位原子电负性越小,越易给出孤电子对,生成的配合物越稳定。(4)写出[Cu(NH3)4]SO4在水中的电离方程式。提示 [Cu(NH3)4]SO4 ===[Cu(NH3)4]2++
相关资料
更多









