




初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐授课课件ppt
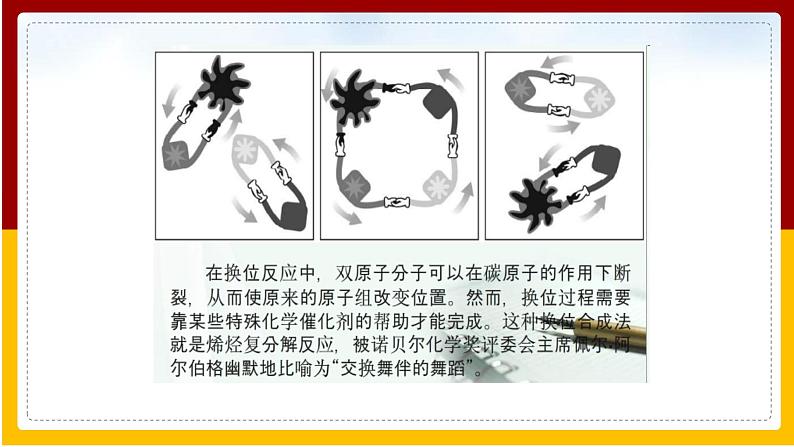
展开2005年诺贝尔化学奖获得者,从左至右依次为:肖万、格拉布、施罗克
“交换舞伴”的肖万机理
CaCl2+H2O+CO2↑
2NaCl+H2O+CO2↑
NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2
Na2CO3+2HCl
写出相关反应方程式:
Na2CO3+CaCl2
CaCO3↓+2NaCl
CaCO3↓+2NaOH
【设疑】 碳酸钠溶液能与酸反应,也能与氢氧化钙溶液反应,能否与其他的碱,如氢氧化钠溶液反应呢?
1.常见的酸大多溶于水;2.常见的碱中只有五种溶于水:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O;3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
4.盐酸盐(也称氯化物)不溶于水的有AgCl;5.硫酸盐不溶于水的有BaSO4;6.碳酸盐:含钾、钠、铵根离子的碳酸盐溶于水。
酸类易溶除硅酸;碱溶钾、钠、铵和钡;钾、钠、铵盐、硝酸盐,都能溶在水中间;盐酸盐不溶银;硫酸盐不溶钡;碳酸盐很简单,能溶只有钾、钠、铵。
部分酸、碱、盐的溶解性口诀
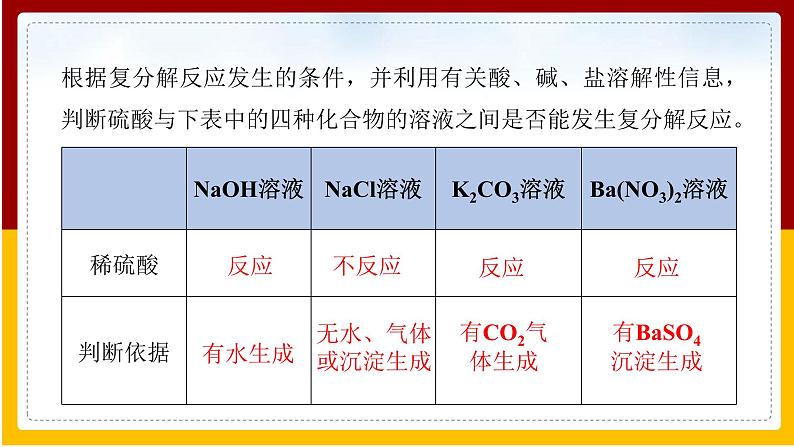
根据复分解反应发生的条件,并利用有关酸、碱、盐溶解性信息,判断硫酸与下表中的四种化合物的溶液之间是否能发生复分解反应。
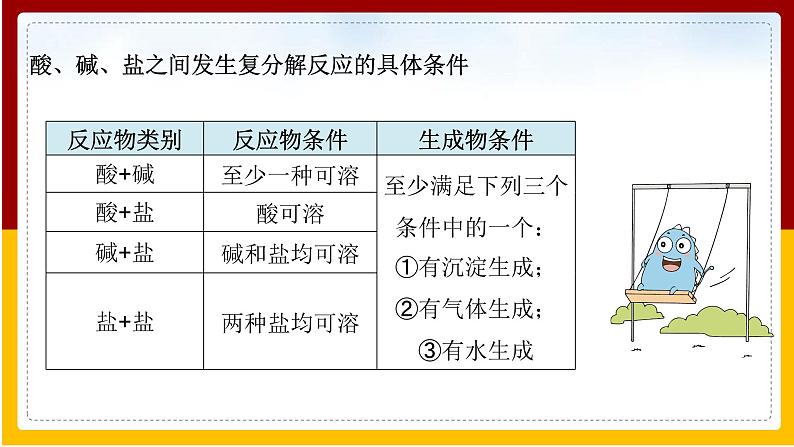
酸、碱、盐之间发生复分解反应的具体条件
复分解反应的实质是两种化合物在水溶液中互相交换离子,只要离子之间能够互相结合生成气体、沉淀或水,反应就可以发生。
Ca(OH)2 + Na2CO3 ——
2NaOH+ CaCO3↓
(2019·重庆模拟)下列各组物质中,能发生复分解反应且反应后溶液总质量变小的是( )
A.铁和硫酸铜溶液 B.氢氧化钠溶液和盐酸C.稀硫酸和氯化钡溶液 D.碳酸钠溶液和氯化钾溶液
同学们能够用你们已有的知识对上述概念进行整理,并用图示把这些概念的相互关系表示出来吗?(如图所示)
物质分类依据不同,因而类别也不同。根据物质的组成和性质,我们可以将物质分为单质、氧化物、酸、碱、盐等。
【练习】 写出下列物质的化学式,并将其分类。氢氧化钠、氧化铁、硫化锌、盐酸、硫酸钠、胆矾、氢氧化铜、三氧化硫、生石灰、硝酸、碳酸氢钠、碱式碳酸铜、氢氧化钙、硫酸亚铁。
离子的共存:同一溶液中若离子之间符合以下三个条件之一就会发生反应,这些离子便不能在溶液中大量共存。 ①生成沉淀物:如Cl-与Ag+,Ba2+与SO42-,OH-与Cu2+、Fe3+、Mg2+ ; CO32-与Ca2+、Ba2+等不能大量共存。②生成气体:如OH-与NH 4+,H+与CO32-、HCO3-等不能共存。③生成水;如H+与OH-不能共存。另外还要注意题目中的附加条件,如溶液无色透明,则溶液中肯定没有有色离子,如Fe3+、 Cu 2+、 Fe 2+、MnO4-等;pH=1时为强酸溶液;pH=14为强碱溶液。
1.一看成分:一般反应物如有相同的离子成分,则该反应不能发生.
判断复分解反应能否发生有“三看”:
口诀:复分解,两头顾,先顾头,后顾尾,顾头要看溶解性,顾尾气体沉淀水,有酸参加可不溶,无酸参加都要溶。
3.三看反应物的溶解性:有酸参加的复分解反应,另外一种物质可不溶于水,但需溶于酸,反应才能发生。无酸参加的复分解反应,反应物均需溶于水,反应才可能发生。
2.二看产物:生成物中是否有沉淀(固体)、水(液体)或气体生成。只需有其中一种生成,反应就能发生。
1.下列物质在溶液中组内两两之间都能互相发生化学反应的是 ( )A.硫酸铜、氯化钙、硝酸钠 B.硫酸、碳酸钾、氢氧化钡C.氯化钙、碳酸钠、氢氧化钾 D.盐酸、硝酸钾、氢氧化锌
解析:硫酸铜、氯化钙、硝酸钠三者相互交换成分均没有水、气体或沉淀生成,则不能反应;硫酸、碳酸钾与氢氧化钡相互交换成分有白色沉淀生成,硫酸、碳酸钾相互交换成分有气体生成,能发生复分解反应;氯化钙、氢氧化钾或碳酸钠、氢氧化钾相互交换成分均没有水、气体或沉淀生成,则不能反应;盐酸、硝酸钾或硝酸钾、氢氧化锌相互交换成分均没有水、气体或沉淀生成,则不能反应。
2.“分类”可以使人们有序地研究物质,以下分类正确的是( )A.合金:生铁、锰钢、青铜B.碱:纯碱、烧碱、消石灰C.盐:氯化银、氯化钠、氯化氢D.合成材料:塑料、合成纤维、铝合金
解析:纯碱不是碱,属于盐类;氯化氢不属于盐类;铝合金属于金属材料中的合金。
3.判断复分解反应能否发生,可以不必考虑的是( )A.生成物中是否有沉淀B.生成物中是否有水C.生成物中是否有气体D.金属的活动性顺序
解析:复分解反应能否发生需要考虑生成物中是否有沉淀、水、气体。金属是单质,复分解反应能否发生不需要考虑金属的活动性顺序。
4.将下列各组物质的溶液相混合,不会发生复分解反应的是 ( )A.BaCl2和Na2SO4B.HCl和NaHCO3C.NaCl和KNO3D.HCl和KOH
解析:氯化钡和硫酸钠反应生成硫酸钡白色沉淀,符合复分解反应发生的条件,能发生反应;盐酸和碳酸氢钠反应生成水、二氧化碳和氯化钠,符合复分解反应发生的条件,能发生反应;硝酸钾和氯化钠相互交换成分没有沉淀、气体或水,不符合复分解反应发生的条件,不能发生反应;盐酸和氢氧化钾反应生成氯化钾和水,故能发生复分解反应。
5.在溶液中发生AB+CD AD↓+CB类型的反应,下列说法不正确的是( )A.该反应属于复分解反应B.A在反应前后的化合价无变化C.D一定是原子团D.若AB是AgNO3,则CD可能是NaCl
解析:AB+CD ==AD↓+CB是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;由复分解反应的特点可知A在反应前后的化合价无变化;D不一定是原子团,例如AgNO3和NaCl反应生成氯化银沉淀和硝酸钠,D是氯离子;AgNO3和NaCl反应生成氯化银沉淀和硝酸钠。
初中化学人教版九年级下册课题2 化学肥料教案配套ppt课件: 这是一份初中化学人教版九年级下册课题2 化学肥料教案配套ppt课件,共18页。PPT课件主要包含了辨别真假化肥,新知导入,新知探究,白色晶体,灰白色粉末,有刺激性气味,无气味,有酸味,溶于水,不溶于水等内容,欢迎下载使用。
初中化学人教版九年级下册课题2 化学肥料教学演示ppt课件: 这是一份初中化学人教版九年级下册课题2 化学肥料教学演示ppt课件,共21页。PPT课件主要包含了学习目标,新知导入,这些植物怎么了,化学肥料,新知构建,常见的磷肥,磷肥一般为灰色的,常见的钾肥,复合肥料,化学农药等内容,欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐课文配套ppt课件: 这是一份人教版九年级下册课题1 生活中常见的盐课文配套ppt课件,共29页。PPT课件主要包含了学习目标,我说你猜,新知导入,氯化钠,新知构建,食盐的用途及分布,思路二,⒈氯化钠的用途,氯化钠的生理作用,氯化钠的分布等内容,欢迎下载使用。













